围绝经期非器质性失眠妇女肝郁与PI3K/Akt信号通路的相关性研究*
2019-01-04吴海红吕绍光郑姜钦
李 红 ,陈 莹 ,吴海红 ,马 坤 ,吕绍光 ,郑姜钦
(1.福建医科大学省立临床医学院,福州 350001;2.福建省立医院中医科,福州 350001;3.福州中医药大学,福州 350122)
中国围绝经期妇女的失眠发病率高达66.7%,其中非器质性失眠是失眠的最常见类型,表现为辗转难眠、眠浅易醒、彻夜不眠等[1-2]。长期失眠会使机体的神经-内分泌-免疫功能紊乱,导致免疫力低下、抑郁、焦虑等不良情绪、慢性病和认知功能障碍,甚至危及生命[3-4]。气郁体质是围绝经期失眠的最常见体质之一,而且较其他体质患者入睡更难[5]。正如《素问·痹论》云:“静则神藏,躁则消亡。”研究显示[6-8],肝郁可通过影响PI3K/Akt信号通路,从而参与多种疾病的发生发展,而免疫调节因子白介素1-β(IL-1β)、肿瘤坏死因子-α(TNF-α)是 PI3K/Akt信号通路的下游效应分子之一,在睡眠调节方面起到重要作用。本研究通过观察围绝经期非器质性失眠妇女的肝郁分级、PI3K/Akt信号通路各指标和匹兹堡睡眠质量指数(PSQI)之间的相互关系,探讨肝郁影响围绝经期非器质性失眠的可能免疫学机制。
1 临床资料
1.1 纳入标准 本研究遵循人道主义,患者自愿参加本研究并签署《知情同意书》。围绝经期诊断标准参照《妇产科学》[9];非器质性失眠诊断标准参照ICD-10[10];肝郁积分和分级标准参照《证素辨证学》[11]。纳入标准:1)年龄在40~55岁未绝经或绝经后1 a内。2)卵泡刺激素(FSH>10 U/L)。3)对睡眠的质和(或)量不满、入睡困难、辗转难眠、眠浅易醒。4)失眠表现>3次/周,时间长达1个月以上。5)忧心失眠对机体产生的不良损害。6)对睡眠的质和/或量不满意,并影响生活和工作能力。7)PSQI累计分大于7分。
1.2 排除标准 1)不满足研究的纳入条件。2)阴道出血长期未治愈,且其原因未查明者。3)双侧卵巢缺失或已衰竭或发生严重器质性病变者,乳腺恶性肿瘤。4)有雌、孕激素替代治疗史。5)体内重要脏器或系统发生严重疾病。6)因身体病变、精神严重异常、滥用食物或药物引起的失眠,其他类型的失眠。7)近期发生炎症,并予对症对因治疗者。
1.3 一般资料 选取2014年9月—2016年1月就诊于福建省医科大学临床医学院、福建省第二人民医院、福建省中医药研究院的围绝经期女性患者150例,均符合上述纳入标准,其中“肝郁0级组”30例、“肝郁1级组”40例、“肝郁 2级组”40例、“肝郁 3 级组”40 例,平均年龄(48.1±4.0)岁。
2 方法
2.1 检测IL-1β、TNF-α的含量 根据北京北方生物公司生产的试剂盒操作说明测定人外周血血清中IL-1β、TNF-α的含量,试验方法为酶联免疫的吸附法(ELISA)。
2.2 检测磷脂酰肌醇3活酶(PI3K)、蛋白激活酶B(Akt)、磷酸化蛋白激酶 B(pAkt)蛋白含量及其mRNA水平
2.2.1 主要试剂 人外周血淋巴细胞分离液购自Solaibio(北京);蛋白裂解液、蛋白酶抑制剂、磷酸酶抑制剂购自Brij(上海);BCATM试剂盒购自Thermo(美国);PI3K兔抗人多克隆抗体、Akt兔抗人多克隆抗体、pAkt兔抗人多克隆抗体购自CST(美国);β -actin Antibody、HRP goat anti-rabbit IgG 购 自Proteintech(美国);Tranzol up购自全式金生物;RNA酶抑制剂购自 Epicentre(美国);SuperScriptTMIII ReverseTranscriptase购自Thermo Invitrogen(美国)。
2.2.2 取材和保存 尚未绝经者于月经第3~5 d,已绝经者时间可随意,抽取空腹外周血,用Ficoll密度梯度离心法离心、提取PBMC,放入-80℃冰箱中保存备用(用于检测mRNA含量的PBMC需加入Tranzol up)。
2.2.3 WesternBlot检测 PI3K、Akt、pAkt蛋白含量 提取各样本中细胞的总蛋白,BCA法测定蛋白浓度,配4%浓缩胶、8%分离胶,蛋白上样量40 μg,在30 mA恒电流、4℃条件下转膜1夜,常温封闭孵育1 h,洗膜,置于相应的兔抗人多克隆抗体中常温孵育1.5 h,洗膜,再在兔二抗中常温孵育1 h,洗膜,化学法发光、显影,用ImageJ分析软件测定各个蛋白的灰度值含量,结果以目的蛋白与β-actin的比值表示。
2.2.4 RT-QPCR检测 PI3K mRNA、Akt mRNA含量 提取各样本中细胞的总RNA并测定其浓度和纯度,根据逆转录试剂盒(Invitrogen公司)的操作说明获得cDNA,引物由上海康成生物有限公司生产,以 β-actin为参照基因,β-actin引物序列:F:5'GTGGCCGAGGACTTTGATTG3',R:5'CCTGTAACAACGCATCTCATATT3';PI3K 引物序列:F:5'GGAAGCAG CAACCGAAACAAAG3',R:5'TCGCCGTCCACCACTACAGAG3';AKT 引物序列:F:5'CACACCACCTGACCAAGATG3',R:5'GCACCCGAGAAATAAAAACC3'。按RT-QPCR试剂盒操作说明进行扩增反应,条件:95℃预变性10min后,95℃10s,60℃60 s扩增40个循环,95℃溶解曲线采集10 s,扩增结果运用ViiA 7实时荧光定量PCR System软件进行分析,计算循环的阈值(Ct值),用 2-△△Ct表示肝郁组(肝郁1级、2级、3级)目的基因的表达量相对于肝郁0级组的变化倍数。
2.3 统计学分析 运用SPSS 20.0进行分析,正态分布数据用均数±标准差(±s)表示,非正态分布数据用中位数、四分位数表示,即M(P25~P75)。相关性分析用Pearson(正态分布)或Spearman(非正态分布),0.5≤|相关系数 r|<0.8 表示中度相关,0.8≤|相关系数r|≤1.0表示高度相关。正态分布:多组间差异性对比用ANOVA,两组间对比用LSD(方差齐)或Games-Howell(方差不齐)。非正态分布:多组间对比用多个独立样本非参数检验,两组间对比用两独立样本非参数检验。P<0.05表示差异有统计学意义(若为非正态资料的两组间比较,则用校正α=2×0.05/(4×3)=0.008 3,即P<0.008 3表示两组间比较的差异有统计学意义。
3 结果
3.1 肝郁分级与PSQI、PI3K/Akt信号通路各指标之间的相关性分析 肝郁分级与PSQI呈中度正相关(P<0.01);肝郁分级和 PI3K、Akt、pAkt的蛋白表达量呈中度正相关(P<0.01);肝郁分级与 PI3K、Akt的 mRNA 含量呈中度正相关(P<0.01);肝郁分级与IL-1β、TNF-α 含量也呈中度正相关(P<0.01);同时PI3K与PI3K mRNA、Akt与Akt mRNA呈高度正相关(P<0.01);而且 IL-1β、TNF-α 均与 PSQI呈中度正相关(P<0.01)。见表 1。
3.2 不同肝郁分级间PSQI、PI3K/Akt信号通路各指标的比较
3.2.1 PSQI在不同肝郁分级间的比较 PSQI随着肝郁分级的增高而增加,各肝郁分级间的PSQI的差别有统计学意义(χ2=50.093,P<0.01),而且 PSQI在肝郁各级间的两两比较,其差异均有统计学意义(P<0.008 3)。见表 2。
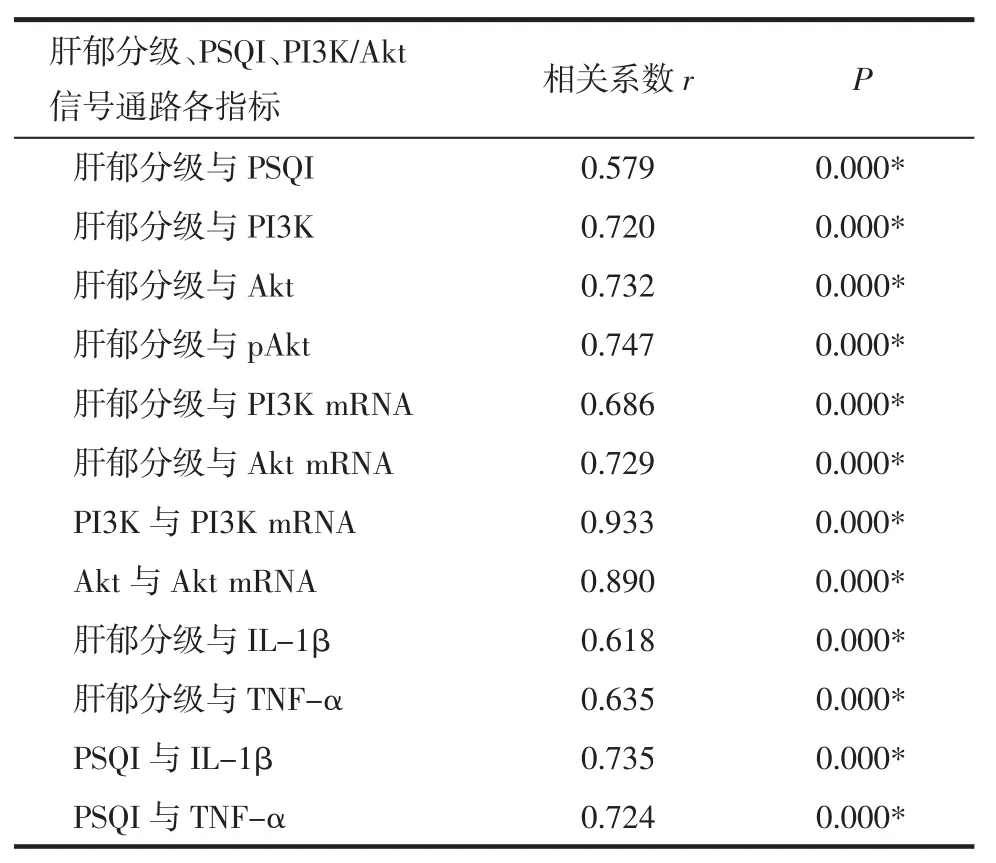
表1 肝郁分级、PSQI、PI3K/Akt信号通路各指标之间的相关性分析
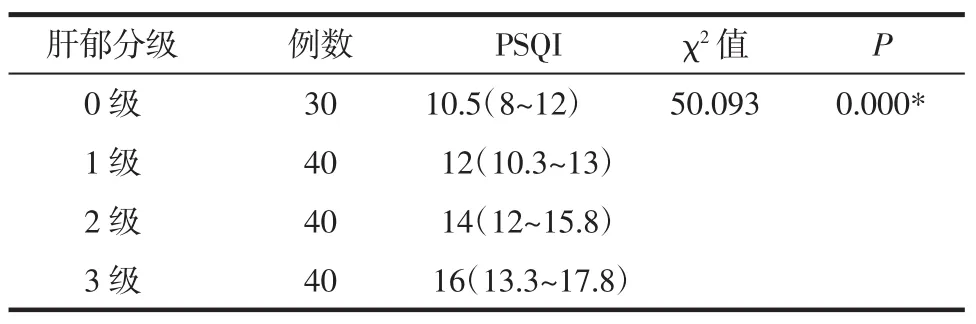
表2 PSQI与肝郁分级间的关系 M(P25~P75)
3.2.2 IL-1β、TNF-α在不同肝郁分级间的比较 从表3得出,IL-1β、TNF-α的含量随着肝郁分级的增加而上升,而且IL-1β、TNF-α在各肝郁分级间的差别有显著统计学意义(分别:F=28.643,P<0.01;F=30.962,P<0.01),同时,IL-1β、TNF-α 在肝郁分级间的两两比较,均有统计学差异(P<0.05)。见表3。
表 3 IL-1β、TNF-α 在不同肝郁分级间的比较(±s)
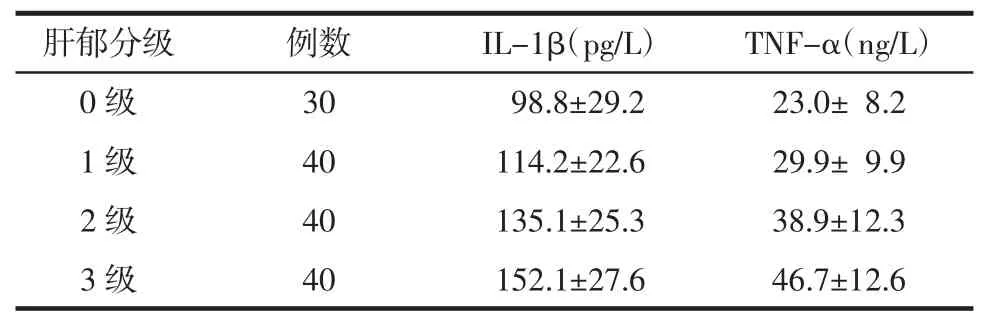
表 3 IL-1β、TNF-α 在不同肝郁分级间的比较(±s)
肝郁分级 例数 IL-1β(pg/L) TNF-α(ng/L)0 级 30 98.8±29.2 23.0± 8.2 1 级 40 114.2±22.6 29.9± 9.9 2 级 40 135.1±25.3 38.9±12.3 3 级 40 152.1±27.6 46.7±12.6
IL-1β、TNF-α在肝郁分级间的两两比较均有统计学差异(P<0.05)。
3.2.3 PI3K、Akt、pAkt在不同肝郁分级间的比较 PI3K、Akt、pAkt的含量也随着肝郁分级的增加而上升,而且在各肝郁分级间的差别也有明显统计学意义(分别:F=44.951,P<0.01;F=46.544,P<0.01;F=54.084,P<0.01),同时,PI3K、Akt、pAkt在不同肝郁分级间的两两比较也均有统计学差异(P<0.01)。见表 4、图 1。
表 4 PI3K、Akt、pAkt在不同肝郁分级间的比较(±s)
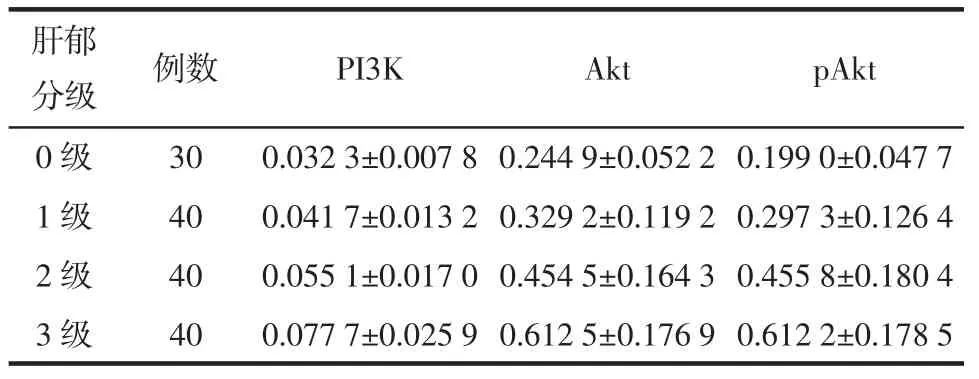
表 4 PI3K、Akt、pAkt在不同肝郁分级间的比较(±s)
肝郁分级 例数 PI3K Akt pAkt 0 级 30 0.032 3±0.007 8 0.244 9±0.052 2 0.199 0±0.047 7 1 级 40 0.041 7±0.013 2 0.329 2±0.119 2 0.297 3±0.126 4 2 级 40 0.055 1±0.017 0 0.454 5±0.164 3 0.455 8±0.180 4 3 级 40 0.077 7±0.025 9 0.612 5±0.176 9 0.612 2±0.178 5
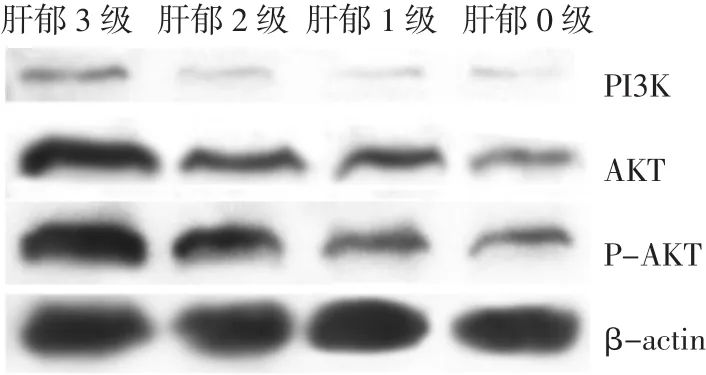
图1 不同肝郁分级间PI3K、Akt、pAkt的比较
3.2.4 PI3K mRNA、Akt mRNA在不同肝郁分级间的比较 肝郁分级越高,PI3K mRNA、Akt mRNA水平越高,而且在各肝郁分级间的差别有明显统计学意义(分别:F=36.808,P<0.01;F=45.291,P<0.01),同时,PI3K mRNA、Akt mRNA在不同肝郁分级间的两两比较均有统计学差异(P<0.01)。见表 5。
表5 PI3K mRNA、Akt mRNA在不同肝郁分级间的比较(±s)
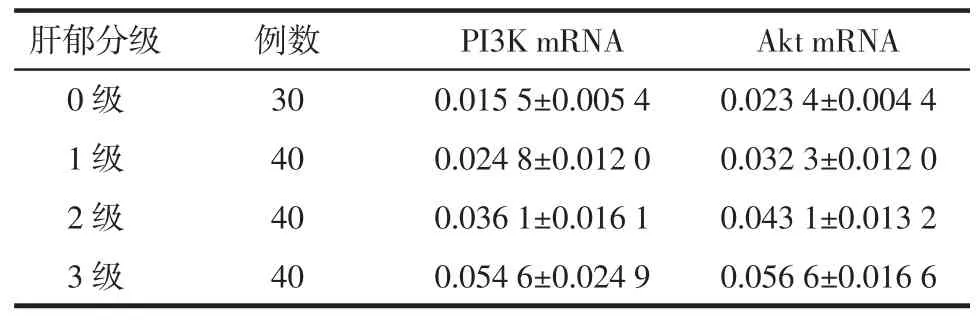
表5 PI3K mRNA、Akt mRNA在不同肝郁分级间的比较(±s)
肝郁分级 例数 PI3K mRNA Akt mRNA 0 级 30 0.015 5±0.005 4 0.023 4±0.004 4 1 级 40 0.024 8±0.012 0 0.032 3±0.012 0 2 级 40 0.036 1±0.016 1 0.043 1±0.013 2 3 级 40 0.054 6±0.024 9 0.056 6±0.016 6
4 讨论
调查显示围绝经期妇女的失眠发病率达34%~37.5%,肝郁的发病率为32%[12]。围绝经期非器质性失眠除了肾虚的共同病因外,肝郁气滞是该病发生发展的又一大诱因。由于围绝经期妇女大多处于40~55岁,掌握了许多工作经验,在工作上正处于上升阶段,在家庭中又处于上有老、下有小的状态,繁重的工作压力、琐碎的生活事件和社会对其期望值不断增加,加之围绝经期妇女精神较敏感,性激素水平不稳定,神经-内分泌-免疫功能紊乱,易诱发或加重肝郁。同时,围绝经期妇女肾精亏虚,水不涵木,致肝血不足,肝气郁结,既扰乱心神,又血不能濡于心,故可诱发和加重失眠。同时,本团队前期研究发现[8]:在围绝经期妇女中,肝郁程度越重,失眠越严重;同时,非器质性失眠组以肝郁2级、3级居多,即肝郁程度较重,无失眠组以肝郁0级为多,即肝郁程度较轻。
本课题研究结果显示:肝气郁滞与围绝经期非器质性失眠密切相关,结合前期研究结果,可得出结论:肝郁气滞是围绝经期非器质性失眠发生或加重的重要原因之一,而且肝郁分级越高,失眠越严重,该结果与“情志致病”理论及古今学者、国内外医家的研究结论相一致[12-15]。
本研究结果显示:围绝经期非器质性失眠患者的肝郁分级与PSQI及PI3K/Akt信号通路调节下的PI3K、Akt、pAkt的蛋白表达量及其基因含量、IL-1β、TNF-α 水平均为中度正关性(0.5≤r<0.8,P<0.01),而且上述各指标在肝郁的各分级间的差别均有统计学的意义(P<0.05),各观察值在肝郁各级间的两两对比也具有统计学的意义(P<0.05);同时,IL-1β、TNF-α与PSQI也表现为中度正相关(0.5≤r<0.8,P<0.01),故肝郁分级、PI3K/Akt信号通路和该疾病三者之间的关系为:两两正相关,提示PI3K/Akt信号通路可能是肝郁影响围绝经期非器质性失眠的部分免疫学机制之一,其机制可能是通过肝郁引起PBMC中PI3K和Akt的mRNA含量增加,进一步促使基因表达,启动PI3K/Akt信号通路,使PI3K、Akt、pAkt的蛋白含量也增加,经过一系列复杂的级联反应后,促使人体血清中免疫调节因子IL-1β、TNF-α也随之大量升高,最终影响睡眠进程。该结果与国内外学者的研究结果有相同之处[6-8,16]:肝郁可影响PI3K/Akt信号通路;而长期的肝郁诱导IL-1β、TNF-α 持续性大剂量升高;IL-1β、TNF-α 参与睡眠进程;肝郁是失眠的重要病因。故今后可考虑通过疏解肝郁情绪、研究PI3K/Akt信号通路的抑制剂以改善围绝经期妇女非器质性失眠。
