Tim-3在胃癌组织中的表达及其临床病理特征和生存的关系*
2019-01-03王良义林中满王德奋
王良义 林中满 王德奋
在我国胃癌的发病率居各类恶性肿瘤之首,其发生、浸润、转移、复发等过程涉及多种细胞因子及其相关的调控网络通路和分子机制。研究表明,胃癌的转移复发不仅依赖于癌细胞本身的生物学特性,肿瘤微环境中各种细胞因子与肿瘤细胞之间的作用及其各种细胞因子的相互作用也对肿瘤恶性增殖、浸润、转移等恶性进展的发生具有重要影响[1-2]。因此,不断探索新的基因功能和完善分子间相互作用仍是目前的研究热点。T细胞免疫球蛋白黏蛋白分子3(T-cell immunoglobulin domain and mucin domain protein-3,Tim-3)属于Tim基因家族蛋白,特异性表达在CD4+IFN-γTh1细胞表面,随着其研究的深入,发现Tim-3在T细胞亚群CD3+CD8+T细胞、辅助性T细胞17(T helper cell 17,Th17)、调节性T细胞(regulatory cells,Treg)、树突细胞(dendritic cell,DC)、自然杀伤细胞(natural killer,NK)等其他淋巴细胞亚群也均有表达[3]。Tim-3属于细胞免疫抑制分子,负向调控Th1细胞,通过Tim-1/galeetin-9途径对免疫耐受起着重要的调节作用[4]。
近年来,越来越多的研究将关注点集中在Tim-3对肿瘤免疫的作用机制上。有研究发现,Tim-3通过调节T细胞保持肿瘤免疫抑制环境,与肿瘤的恶性进展紧密相关[5-6]。本研究应用免疫组织化学方法检测胃癌组织中Tim-3的表达及其临床意义,旨在探讨Tim-3与胃癌的临床病理特征和生存的相关性及其所起的作用机制。
1 资料与方法
1.1 一般资料
选择2009年9月1日至2012年9月1日琼海市中医院收治的56例行胃癌根治术患者的病例资料。56例患者中男性34例,女性22例;年龄29~74岁,平均年龄(56.4±6.4)岁。采集56例患者手术切除的胃癌组织标本及相同病例的癌旁组织标本,经10%中性甲醛固定,石蜡包埋、连续切片。本研究已经通过医院伦理委员会审查,患者均知情同意。
1.2 纳入与排除标准
(1)纳入标准:①术前均经病理学检查确诊为胃癌;②行胃癌根治术;③临床资料及其手术切除标本蜡块保存完整。
(2)排除标准:①术前曾经接受放化疗、免疫及抗肿瘤药物等治疗;②合并其他恶性肿瘤。
1.3 仪器与试剂
采用自动免疫组织化学分析仪(德国徕卡Bond公司);Elivsion试剂盒、DAB显色试剂盒以及兔抗人Tim-3多克隆抗体均购自丹麦Doka公司。
1.4 检测方法
免疫组织化学检测Tim-3的表达采用Elivsion免疫组织化学法,检测胃癌组织及其癌旁组织中Tim-3的表达采用Elivsion试剂盒、DAB显色试剂盒以及兔抗人Tim-3多克隆抗体。严格按照二步法免疫组织化学试剂盒说明书进行操作。
1.5 观察与评价指标
(1)结果判断。阳性表达为定位于肿瘤细胞浆或细胞膜的棕黄色或棕褐色颗粒。由两位病理医师采用双盲法进行判定,每张切片随机选取5个高倍视野(×400),每个视野数100个细胞,按阳性细胞所占百分比评分:阳性细胞<10%为阴性(-),≥10%为阳性(+)。
(2)生存率随访。所有患者出院后通过电话,邮件及上门随访生存情况,随访终止日期为2017年9月1日,或死亡日期为止。随访患者生存期,平均随访时间为(40.7±38.7)个月。
1.6 统计学方法
采用SPSS 13.0统计软件进行数据分析,不同临床病理特征患者的Tim-3蛋白表达比较运用卡方检验,生存资料作Kaplan-Meier生存曲线并Logrank检验和多因素分析(Cox模型)和相对危险度(relative risk,RR)分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 胃癌及癌旁组织中Tim-3表达比较
Tim-3在胃癌组织中的阳性表达率(85.71%)显著高于癌旁组织(21.43%),差异具有统计学意义(x2=46.52,P<0.01),如图1所示。
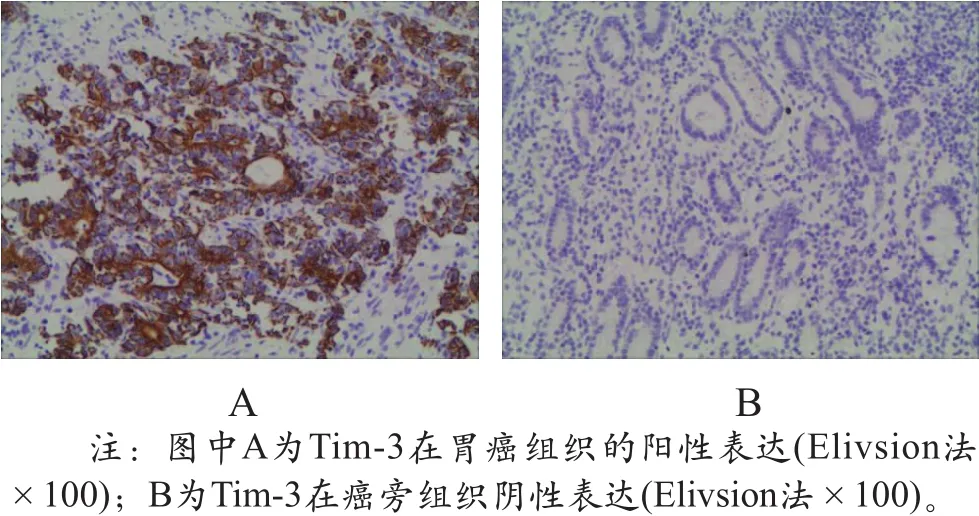
图1 Tim-3在不同组织中的阳性表达
2.2 胃癌组织中Tim-3表达与胃癌临床病理特征的关系
TNM分期为Ⅲ~Ⅳ、伴有淋巴结转移及浸润深及肌层的患者胃癌组织中Tim-3表达明显高于TNM分期为I~Ⅱ、无淋巴结转移及未浸润深及肌层的患者,差异有统计学意义(x2=9.962, x2=8.692, x2=6.941;P<0.01);而患者年龄、性别、肿瘤部位、肿瘤的大小以及组织学分化对胃癌组织中Tim-3表达无显著影响(x2=0.012,x2=0.013,x2=0.080,x2=0.051,x2=0.133;P>0.05),见表1。
2.3 Tim-3阳性表达与胃癌患者预后的关系
本研究对56例胃癌患者进行了随访,随访率为100.00%,其中40例存活,16例死亡;生存时间(32.17±7.93)个月。Tim-3阳性表达患者的Kaplan-Meier生存率曲线如图2所示。
对56例胃癌患者的临床病理资料进行Cox单因素回归模型分析,其结果显示,浸润深度、淋巴结转移、TNM分期以及Tim-3阳性表达与胃癌患者生存率明显相关(r=0.674,r=0.613,r=0.596;P<0.05);Cox回归多因素分析表明,浸润深度、淋巴结转移以及Tim-3阳性表达是影响胃癌患者生存率的独立预后因素(RR=2.806,RR=2.239,RR=1.938;P<0.01),见表2。
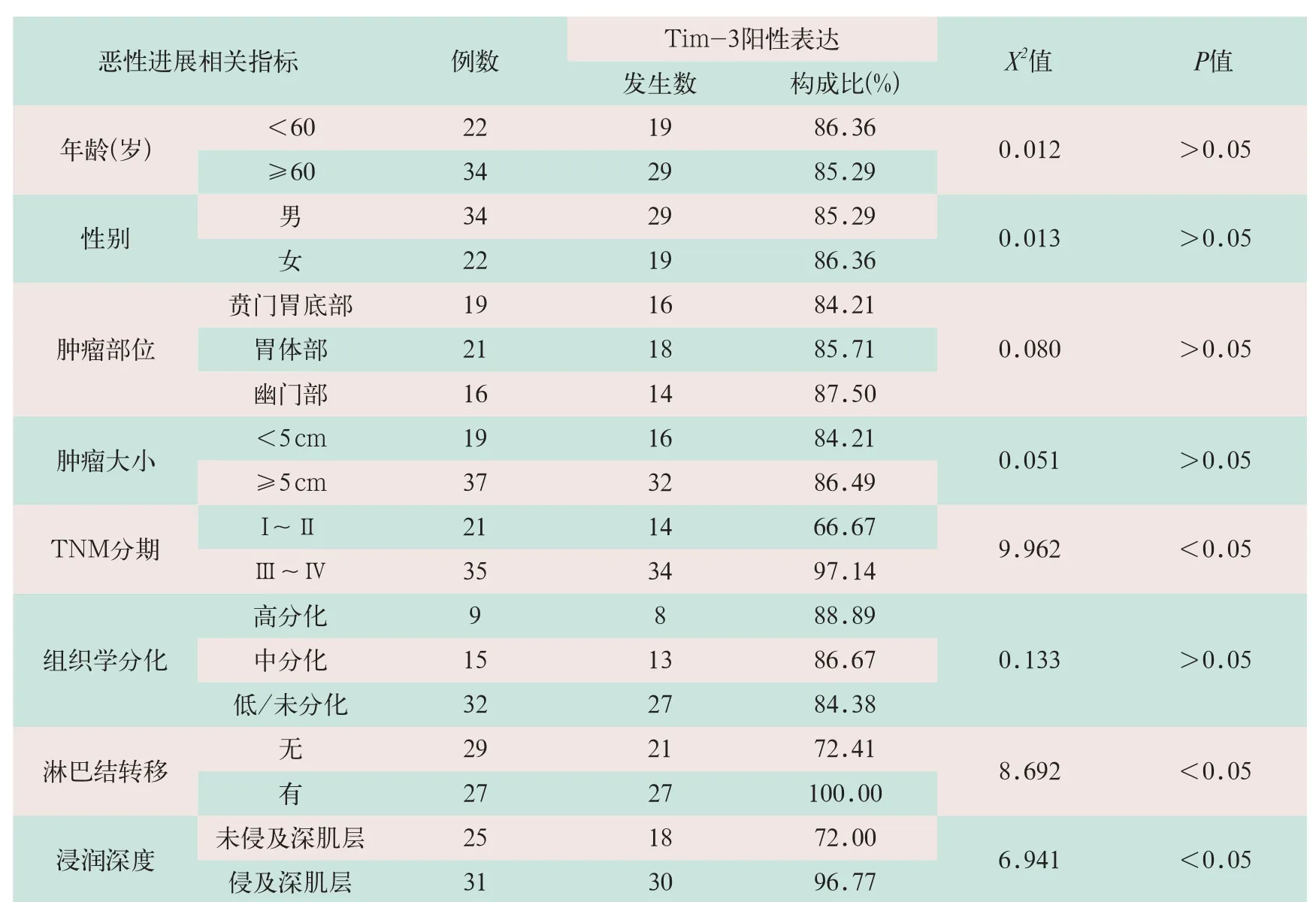
表1 Tim-3表达与胃癌临床病理特征的相关性

图2 Tim-3阳性及阴性胃癌患者的生存曲线图
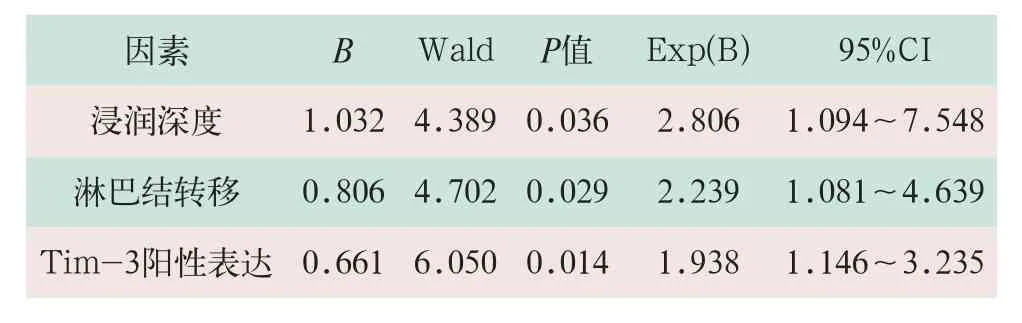
表2 胃癌患者生存率的Cox回归多因素分析
3 讨论
胃癌患者的临床表现多为远期预后不良,治疗效果不佳。目前胃癌发生、发展机制尚不完全清楚,其临床远期预后往往不佳,因此深入探讨胃癌发生、增殖、浸润、转移、复发等恶性进展的作用机制,以寻找评估胃癌进展和预后的新指标,并为胃癌的免疫治疗提供新的分子靶点,对降低胃癌患者的病死率具有重要的临床价值。恶性肿瘤细胞的生长、增殖及浸润离不开肿瘤免疫抑制微环境,这种免疫抑制微环境不仅是肿瘤失控性生长的土壤,更能帮助肿瘤细胞抵抗和抑制机体的抗肿瘤免疫应答。目前,已经发现免疫系统中一群抑制性受体,如细胞毒性淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)在肿瘤免疫逃逸过程中起主要作用,但其如何帮助肿瘤细胞逃避机体免疫监视和攻击的具体作用机制尚不明确,也是目前肿瘤免疫研究中关注的热点[7]。
Tim-3作为一个新发现的Th1细胞表面标志分子,由之前被认为是一种负性调节分子,现在被归类于免疫系统中抑制性受体,和程序性死亡分子-1(programmed death-1,PD-1)及CTLA-4等一样,被视为免疫过程中的关卡分子。近几年,越来越多的学者关注于其结构、功能及其与自身免疫性疾病、过敏性疾病和免疫耐受甚至抗肿瘤免疫的关系,目前有关Tim-3在肿瘤中的研究大多集中在基础研究阶段,较多肿瘤细胞实验过程均检测到Tim-3异常表达,认为Tim-3在肿瘤免疫逃逸和抑制肿瘤免疫应答中扮演着非常重要的角色,推测其机制可能与Tim-3能够介导T细胞耗竭或促进髓系来源抑制细胞增殖的功能有关[8-9]。近来研究资料发现,Tim-3不仅参与了一些上皮来源性恶性肿瘤,如胃癌、宫颈癌、肺癌、前列腺癌等的发生过程,更可能与肿瘤的转移及患者的不良预后密切相关[10-12]。但国内有关胃癌中Tim-3的表达及功能研究并不多见[13]。本研究通过免疫组织化学方法测定Tim-3在胃癌组织中呈异常高表达,明显高于癌旁组织,两者差异具有统计学意义。与此同时,TNM分期为Ⅲ~Ⅳ、伴有淋巴结转移及浸润深及肌层的患者胃癌组织中Tim-3表达明显高于TNM分期为I~Ⅱ、无淋巴结转移及未浸润深及肌层的患者,提示其在胃癌组织中的异常高表达不仅参与了胃癌的发生,可能更进一步参与胃癌的恶性进展,检测到Tim-3高表达的患者可能提示了其肿瘤恶性进展的风险比较高,因此Tim-3有望成为胃癌分子靶向调控的重要靶点,将为胃癌免疫治疗提供新途径。
近年来,Tim-3与肿瘤预后的临床相关性研究已成为热点。为此,本研究对Tim-3表达与胃癌患者预后的关系进行了初步探讨发现,Tim-3高表达的胃癌患者生存率明显低于Tim-3低表达者,而多因素Cox比例风险模型分析显示,Tim-3表达水平是影响胃癌患者生存率的独立危险因素之一,提示胃癌组织中Tim-3的表达差异可能影响其患者的预后,推测这可能与Tim-3促使肿瘤浸润T细胞发生功能耗竭有关,故Tim-3有望成为胃癌早期预后评估的重要分子。
Tim-3在胃癌组织中检测到高表达,其表达与患者TNM分期、淋巴结转移以及是否浸润深度存在一定相关性。同时,胃癌组织中Tim-3的表达差异可能影响其患者的生存率,但其如何影响胃癌发生、进展及预后的作用机制尚有待进一步研究。