左心房去神经化导管消融治疗对血管迷走性晕厥患者心脏自主神经功能的影响
2019-01-03郑黎晖孙巍刘尚雨梁二鹏杜忠鹏胡锋吴灵敏姚焰
郑黎晖,孙巍,刘尚雨,梁二鹏,杜忠鹏,胡锋,吴灵敏,姚焰
作者单位:100037 北京市,中国医学科学院 北京协和医学院 国家心血管病中心 阜外医院 心律失常中心(郑黎晖、刘尚雨、梁二鹏、杜忠鹏、胡锋、吴灵敏、姚焰);北京清华长庚医院 清华大学医学中心(孙巍)
血管迷走性晕厥(VVS)是因体位改变、紧张等各种诱因通过迷走神经介导反射所致的血压降低、心率减慢伴有短暂性意识丧失。迷走神经张力病理性增高是VVS的发病基础[1]。我们之前进行的研究和其他的研究结果提示,选择性消融心脏自主神经节(GP)能有效缓解VVS患者的晕厥症状[2-6]。然而,心脏GP消融是否通过影响患者的迷走神经功能而改善晕厥尚不清楚。心率减速力(DC)通过计算窦性心律R-R间期的周期性变化能定量评价心脏的迷走神经张力[7]。本研究报道42例难治性VVS患者行左心房内膜GP消融对迷走神经功能的影响及与消融结果的相关性。
1 资料与方法
1.1 研究对象
连续入选2013-01至2015-03于我科接受左心房GP消融治疗的VVS患者42例,男性18例,平均年龄(41±14)岁,中位晕厥10(2,52)次。入选标准:(1)所有患者VVS的诊断均符合2009年欧洲心脏病学会晕厥诊断和管理指南中VVS的诊断标准[8];(2)晕厥发作次数≥3次,且半年内至少发作过1次晕厥;(3)经功能锻炼、β受体阻滞剂及米多君等药物治疗或永久起搏器植入晕厥仍反复发作;(4)直立倾斜试验阳性[8]:基础阶段或硝酸甘油激发试验出现近似晕厥(面色苍白、胸闷出汗、听力减退、反应迟钝或黑矇)或晕厥症状,且伴以下任一情况:收缩压≤80 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≤50 mmHg,平均动脉压下降≥25%,平均心率<50次/min、窦性停搏>3 s,一过性交界性逸搏、二度及以上的房室阻滞。
入选患者均排除其他原因所致的晕厥,包括体位性低血压、主动脉瓣狭窄、病态窦房结综合征、高度房室阻滞、室性心律失常、肺动脉高压、肥厚型心肌病、短暂性脑缺血发作、癫痫、脑梗死或脑出血后遗症、锁骨下静脉窃血综合征及药物诱发的晕厥等。影像学检查发现左心房血栓者也排除在外。
1.2 左心房GP定位及导管消融
局麻下常规穿刺静脉放置冠状静脉窦及右心室电极。穿房间隔将4 mm的消融电极(Safire,美国雅培公司)送入左心房。在EnSite-NavX标测系统(美国雅培公司)指导下行左心房三维解剖重建。
采用高频刺激法和解剖方法定位GP。高频刺激法如前报道[2-4,9]:以消融电极于左心房内5个常见的GP发放高频刺激(20 Hz,10~20 V,5 ms),采用MicroPace刺激仪(澳大利亚Micropace EP公司)。刺激部位包括位于左上肺静脉和左心耳嵴部间的左上GP、Marshall韧带附近的左侧GP、左下肺静脉下方的左下GP、右上肺静脉前壁的右前GP和右下肺静脉后方的右下GP。解剖法定位GP,在上述GP分布区域经消融定位GP[2-4,10]。高频刺激或消融即刻出现一过性的心室停搏、房室阻滞或窦性心率下降≥50%定义为迷走反应阳性和GP刺激位点有效[2,6]。
在确定的GP放电,采用温控消融,温度上限60℃,功率上限40 W,每次放电至少60 s。消融终点为所有GP的迷走反应消失。
1.3 DC检测
采集患者24小时的12导联心电信号,导入软件工作平台(MIC-24H,北京今科公司)中以备进一步分析。经位相整序信号平均技术计算DC[7,11,12],简述如下:(1)依次展开24小时长程心电图采集的所有R-R间期,剔除房性及室性期前收缩,仅保留窦性R-R间期,将长于前一个R-R间期的R-R间期定义为减速周期并标记为减速点;(2)以每一个减速点的前后15个R-R间期(共30个R-R间期)作为固定的心率段,按顺序确定所有的心率段;(3)叠加所有心率段并对每一点进行信号平均,以X0定位为所有心率段中心点R-R间期的信号平均值,X1定义为X0右侧的第一个R-R间期的信号平均值,X-1和X-2相应定义为X0左侧第一个和第二个R-R间期的信号平均值;(4)按下列公式计算心率减速力[7,11]:DC=[X0+X1-X-1-X-2]/4。
为便于分析,根据时间段将心率减速力进一步分为昼间心率减速力(DDC, 8:00~23:00)和夜间心率减速力(NDC, 23:00~8:00)分别比较。
1.4 长时程心率变异性时域分析
使用心电监测系统(MIC-24H,北京今科公司)采集患者24小时的心电信号,经过计算机系统的软件和人工分析,剔除非窦性QRS波成分,再经过软件计算窦性QRS波的总体标准差(SDNN)和其差值的均方根(RMSSD)。
1.5 随访
消融术后留院观察24小时,口服阿司匹林(100 mg qd)1个月。术后1天、1个月、3个月、6个月和1年时采集患者24小时12导联心电数据,分析患者的DC、NDC、DDC、SDNN及RMSSD变化,并与基线状态进行比较,评估迷走神经张力变化情况。并了解症状发作,包括是否发生晕厥及相关的摔伤、晕厥前兆等临床事件。
根据1年随访期间,患者有无再发晕厥,分为未复发晕厥组和复发晕厥组。并以9例症状严重、倾斜试验阳性但未行导管消融治疗的VVS患者作为对照组,对照组患者行入选后当日、6个月及1年的24小时12导联心电数据进行分析。
1.6 统计学分析
采用SPSS 19.0软件包进行统计学分析,所有连续性变量以均数±标准差表示,比较采用t检验。离散性变量以比值表示,采用χ2分析。正态性检验采用Kolmogorov-Smimor法,非正态分布变量以中位数(四分位数)表示,采用 Wilcoxon秩和检验。双侧检验P<0.05为差异有统计学意义。
2 结果
2.1 三组患者的消融结果及基线资料比较(表1)
术后随访1年期间,6例(14.3%)患者复发晕厥,其余36例(85.7%)患者未再发生晕厥。复发晕厥组、未复发晕厥组及对照组患者的基线资料相比差异均未见统计学意义(P均>0.05)。
2.2 消融参数
42例患者平均消融放电(19.5±6.1)次达到左心房内膜的去神经化,放电时间(7.1±2.5) min,手术时间(48.5±5.9) min,曝光时间(5.9±2.8) min。术中诱发出迷走反应的部位包括:左上GP 36例(85.7%),左下GP 18例(42.9%),左侧GP 14例(33.3%),右前GP 22例(52.4%)及右下GP10例(23.8%)。
2.3 GP消融对DC值及心率变异性的影响(表2~4)
未复发晕厥组患者在术后1天的DC值较术前(基线)迅速降低(P<0.05),在术后1、3、6及12个月随访期间DC值呈现缓慢增加趋势(P>0.05),但始终低于术前(基线)DC值(P<0.05)。平均最慢心率及SDNN和RMSSD在术后1天较之于术前(基线)均有所变化(P均<0.05),这一效果也持续至术后12个月(P均<0.05)。随访期间,复发晕厥组和对照组患者DC值和心率变异性与术前(基线)相比差异均无统计学意义(P均>0.05)。
表1 三组患者的消融结果及基线资料比较(±s)
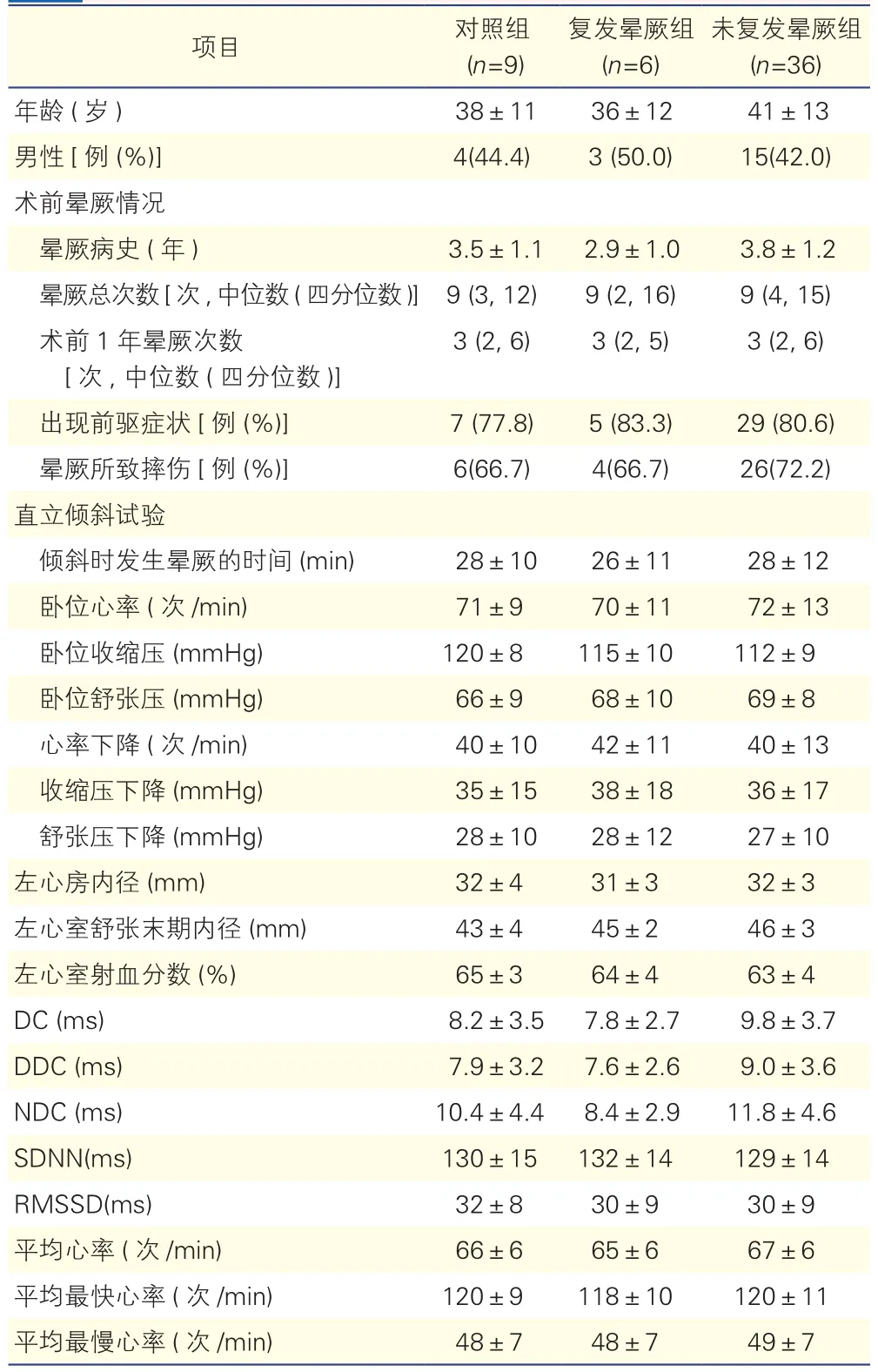
表1 三组患者的消融结果及基线资料比较(±s)
注:DC:心率减速力;DDC:昼间心率减速力;NDC:夜间心率减速力;SDNN:窦性QRS波的总体标准差;RMSSD:窦性QRS波的总体标准差差值的均方根。1 mmHg=0.133 kPa
平均最快心率(次/min) 120±9 118±10 120±11年龄(岁) 38±11 36±12 41±13
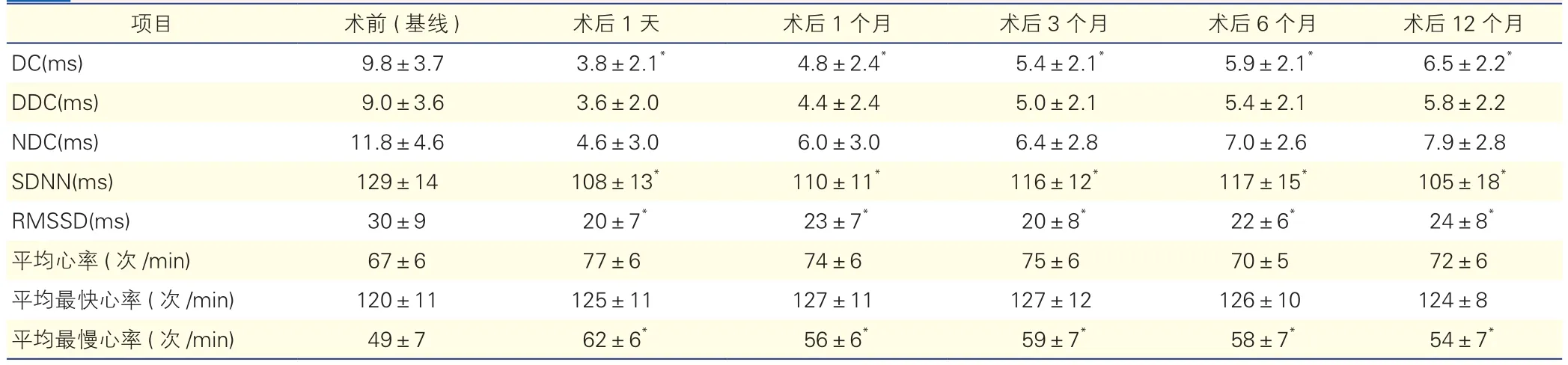
表2 未复发晕厥组患者消融术前后DC值及心率变异性的变化(n=36)
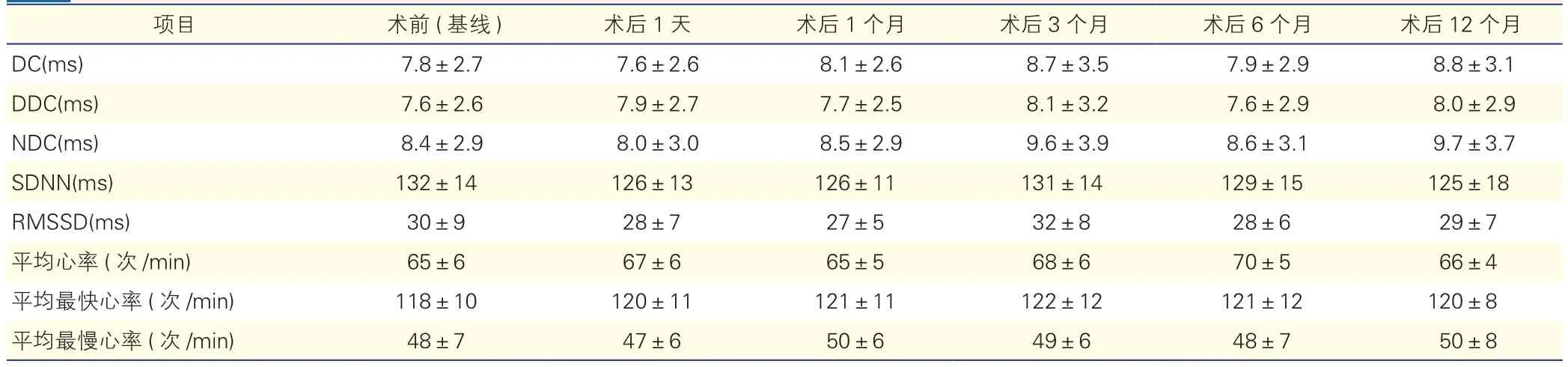
表3 复发晕厥组患者消融术前后DC值及心率变异性的变化(n=6)
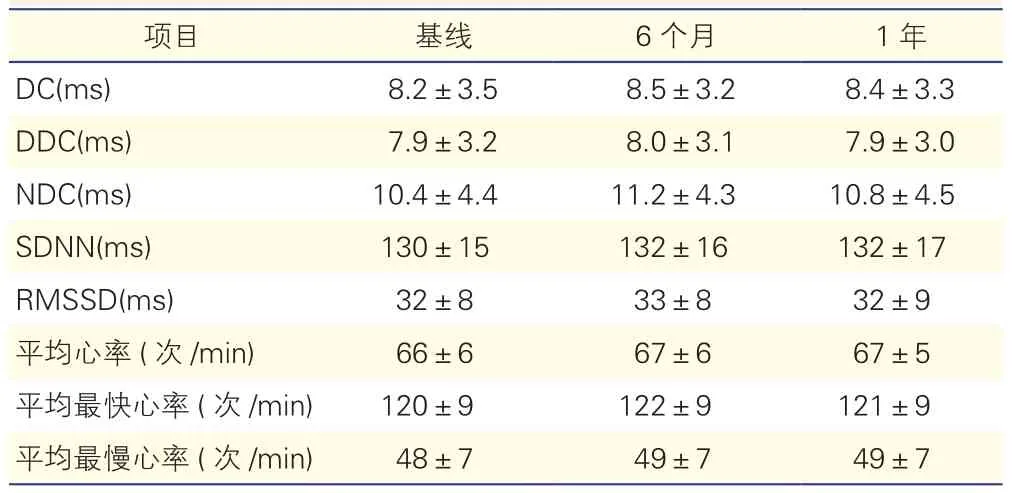
表4 对照组患者基线及随访期间DC值及心率变异性的变化(n=9)
3 讨论
本研究通过采用DC评价心脏的迷走神经功能,提示对左心房GP的导管消融能显著影响VVS患者的迷走神经功能,而且这一影响可持续至术后1年。消融术后, 未复发晕厥患者在术后1天的DC值迅速降低,在术后1、3、6及12个月随访期间DC值呈现缓慢增加趋势,但始终低于术前DC值。复发晕厥组患者导管消融后迷走神经功能未受到明显影响。这提示左心房GP的消融治疗VVS的疗效可能与对迷走神经张力的影响密切相关。
我们和其他的一些研究[2-6,13]发现,通过导管消融在左心房的GP放电能诱发出心率下降和(或)血压下降的迷走反应,并能改善晕厥发作,提示心脏迷走神经在VVS的发病机制中扮演重要角色。然而,由于缺乏有效的评价迷走神经功能的方法,导管消融对心脏迷走神经可产生何种程度的影响以及与晕厥复发的相关性目前尚不清楚。
有研究采用直立倾斜试验评估迷走神经功能,但近来发现直立倾斜试验仅代表了患者对低血压状态的易感性,试验结果阴性不能排除VVS的诊断[14,15]。另有部分研究以心率变异性作为心脏自主神经功能的评价指标,但评价价值有限。Pachon等[5]对21例VVS患者行去神经化治疗,平均随访9.2个月,晕厥症状均未再发作,迷走神经张力指标较之术前均明显减低。Scanavacca等[6]报道了1例VVS患者行去神经化治疗,术后9月再发晕厥,且心率变异性参数提示自主神经功能逐渐恢复,但患者生活质量与晕厥症状较之术前显著改善。Rebecchi等[13]报道了2例VVS患者,消融后心率变异性有所恢复,但1例患者术后8个月未再发作晕厥,1例术后5个月出现了虚弱、心悸等晕厥前兆症状。显然,导管消融能影响迷走神经的功能,然而消融对于迷走神经影响的程度对于VVS发作减少的意义仍需要客观、准确的指标进行评价。
通过PRSA技术计算DC值,能通过24小时窦性心率的整体趋向性分析,从复杂的时间序列信号中提取周期性信号,排除了混杂着的非固定信号、噪音、人工伪差以及周期性心电信号[7,11],因此能更可靠地定量评估迷走神经的作用强度,而且简单、易行,创伤小。DC值越低,代表迷走神经兴奋性降低,对心脏保护性作用下降,患者发生室性心动过速、心室颤动等恶性室性心律失常事件及猝死风险增加,其预测心脏性猝死的价值甚至优于左心室射血分数[7]。Bauer等[16]研究通过测量DC值评估肺静脉隔离术对心房颤动患者心脏迷走神经张力的影响,结果显示术后DC值明显降低,且降低趋势可持续至术后1年。
本组研究发现左心房去迷走化改良后患者的自主神经功能发生了改变,尤其是迷走神经的功能在术后1天即表现出明显下降,之后1年的随访期内迷走神经张力缓慢回升,但始终低于术前水平。而6例术后仍有晕厥发作的患者中,术后1天至1年的随访期间DC值并无明显变化,可能由于这几例患者的副交感神经节后神经元的分布远离心房壁[17];术中高频刺激及消融均无法诱发迷走反应,不能彻底破坏GP,因此无法通过消融影响迷走神经功能、发挥治疗晕厥的作用。这些结果提示左心房的去迷走改良很可能通过影响迷走神经功能、发挥预防晕厥的作用。
GP消融能影响迷走神经功能、治疗VVS的机制与自主神经的组织学分布密切相关。Armour等[18]发现自主神经主要分布于位于肺静脉附近的GP内。Tan等[19]发现,左心房内自主神经的肾上腺素能与胆碱能神经密度在以左心房-肺静脉连接处5 mm以内最高,高于肺静脉远段及左心房近端。Pachon等[20]研究发现,副交感神经的节后神经元细胞主要位于心脏神经节旁的心房壁内,对于心内膜消融较为敏感;而交感神经及感受器的神经元细胞分布远离心脏,消融仅能破坏外周神经纤维,易于形成神经纤维的再生。本研究中大部分患者在GP消融中激惹出现血压和心率下降的迷走反应,去神经化后DC下降,窦性心率增加,提示迷走神经张力下降。术后3个月及12个月随访显示大部分患者无晕厥发作,迷走神经张力维持于低于术前的水平,提示这种通过消融GP的治疗方法、能有效影响迷走神经功能,改善晕厥。
总之,本研究发现,对VVS患者通过对左心房的GP进行消融放电,能改善迷走神经功能,从而预防晕厥的发作。
