磁共振3D-T1WI序列在新生儿局灶性脑白质损伤病灶检出中的应用
2019-01-02孙亲利张育苗高洁宁宁王苗苗李彦彦李欢杨健
孙亲利,张育苗,高洁,宁宁,王苗苗,李彦彦,李欢,杨健*
作者单位:
1. 西安交通大学第一附属医院医学影像科,西安 710061
2. 西安交通大学生命科学与技术学院生物医学工程系,西安 7100540
随着新生儿重症监护水平的提高以及磁共振成像(magnetic resonance imaging,MRI)技术在新生儿领域的广泛应用,新生儿重度脑白质损伤类型如脑室周围白质软化(periventricular leukomalacia,PVL)等逐渐减少,而局灶性脑白质损伤(punctate white matter lesions,PWML)更为常见,发生率是PVL的10倍之多,高达20%以上[1]。PWML可导致儿童认知、运动功能障碍、弱视、脑瘫等不良发育结局[2-4],因此,对其早期精确诊断与预后评估至关重要。然而,PWML患儿临床表现缺乏特异性[4],超声对其敏感性低[5],其诊断及评估主要依靠磁共振检查。
PWML在常规MRI中表现为半卵圆中心、侧脑室周围脑白质点状T1加权成像(T1 weighted imaging,T1WI)高信号、T2加权成像(T2 weighted imaging,T2WI)低或等信号病灶,直径多小于5 mm,部分可融合成线状或簇状[6]。已有研究表明病灶数目与预后密切相关[2,7-8]。国内新生儿MRI扫描常规序列一般包括横轴位T1WI、矢状位T1WI及横轴位T2WI,层厚多为4 mm,而PWML病灶较小,存在漏检的可能。三维T1加权成像(threedimensional T1 weighted imaging,3D-T1WI)为三维容积扫描,层厚较薄,有可能提高PWML的检出率。本研究通过比较3D-T1WI序列与常规T1WI、T2WI及磁共振成像新技术(磁共振扩散成像及磁敏感加权成像)在新生儿PWML病灶检出中的差异,评价3D-T1WI序列在新生儿颅脑磁共振检查中的价值。
1 材料与方法
1.1 研究对象
本研究经我院伦理委员会批准,所纳入新生儿的父母均签署了MR检查知情同意书。
连续性搜集自2011年3月至2013年2月在我院行头颅MRI检查并诊断为PWML的新生儿(检查日龄≤28 d)。PWML诊断标准为半卵圆中心、侧脑室周围脑白质出现点、线或簇状T1WI高信号(3D-T1WI序列观察)、T2WI低或等信号病灶。排除标准:(1) MRI检查序列不全的病例;(2)因运动伪影影响图像质量无法分析的病例。
1.2 扫描设备及参数
应用3.0 T GE Signa HDxt磁共振扫描仪,8通道头部相控阵线圈进行头颅MRI扫描。为减少新生儿头动并顺利完成MRI检查,在扫描前30 min,由责任护士遵照临床主管医师医嘱,给予100 g/L水合氯醛0.5 ml/kg口服或苯巴比妥10~15 mg/kg肌内注射,患者的选择、生命体征监护以及后续跟踪观察严格按照指南要求执行[9]。待新生儿入睡后由主管医师和家属护送至MRI室,将新生儿包裹在襁褓中放置于MRI扫描床上,外耳道放置防噪声弹性耳塞以减小MRI设备噪声对听力的影响,并在头部两侧用海绵固定以减少运动伪影,扫描全程对新生儿实施心电监护,监测心率和呼吸情况,扫描结束后,由主管医师和家属将其护送回新生儿监护室。
扫描序列包括:(1)3D-T1WI:三维快速扰相梯度回波(fast spoiled gradient echo,FSPGR)序列;(2) T2WI:快速自旋回波(fast spin echo,FSE)序列;(3)磁共振扩散张量成像(diffusion tensor imaging,DTI):平面回波成像(echo planar imaging,EPI)序列;(4)3D磁敏感加权成像(3D-enhanced susceptibility-weighted angiography,ESWAN)。各序列参数见表1,均为轴位扫描。
1.3 图像后处理及分析方法
应用GE Healthcare advantage workstation release 4.4 (AW 4.4)工作站Functool 9.4.05a软件行图像后处理。将3D-T1WI图像重建为层厚4 mm轴位图像,并与T2WI图相匹配,类似常规T1WI图。DTI及ESWAN经图像后处理,分别得到相应表观扩散系数(apparent diffusion coefficient,ADC)图及磁敏感幅度(Magnitude)图。
所有图像均上传至医学影像存档与通讯系统(picture archive and communication system,PACS),在诊断工作站进行图像分析。第一步,由2名具有丰富儿科影像诊断经验的放射科医师共同观察所有病例3D-T1WI和T2WI图像,在半卵圆中心、侧脑室周围脑白质出现点、线或簇状3D-T1WI高信号、T2WI低或等信号病灶即诊断为PWML病例,后观察PWML病例各序列病灶对应信号表现。第二步,诊断为PWML病例的各序列图像,由另外2名具有丰富儿科影像诊断经验的放射科医师独立分别观察3D-T1WI (高信号)、重建T1WI (高信号)、常规T2WI (低信号)、ADC图(低信号)与Magnitude图(高或低信号),记录检出的PWML病例数及PWML病例在各序列图像观察到的病灶个数。
1.4 统计学方法
应用SPSS 17.0软件进行统计学分析。计量资料数据用均数±标准差(±s)表示,计数资料用人数(%)[例(%)]表示。采用MedCalc统计学软件对两位医师观察结果进行Bland-Altman一致性检验,图表中的计算差值的均数以及差值的点位于可信区间范围内95%,认为一致性较好。采用配对秩和检验(Wilcoxon signed ranks test)行序列间PWML病灶数检出的两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
2011年3月至2013年2月在我院行头颅MRI检查的新生儿362例(早产儿160例,足月儿202例),诊断为PWML的新生儿107例(早产儿60例,足月儿47例),排除图像序列不全病例21例(因新生儿苏醒未完成扫描方案全部序列)、因运动伪影影响图像质量无法分析病例2例。最后共纳入分析的PWML新生儿84例,早产儿47例,足月儿37例,基本临床资料见表2。
2.2 PWML病灶在各序列图像的信号表现
PWML病灶在3D-T1WI图像均呈高信号,观察PWML病灶对应在各序列图像上的信号表现,分别为:T2WI呈低信号(75/84,89.29%)或等信号(9/84,10.71%);ADC图呈低信号(76/84,90.48%)或等信号(9/84,10.71%);幅度图呈高信号(65/84,77.38%)、等信号(20/84,23.81%)或低信号(7/84,8.33%)(图1,2)。
2.3 各序列图像检出PWML病例及病灶数目的比较
84例PWML病例,3D-T1WI、重建T1WI、常规T2WI、ADC图和Magnitude图检出病例数分别为84 (100%)、69 (82.14%)、71 (84.52%)、73(86.90%)和70 (83.33%),重建T1WI、T2WI、ADC图和Magnitude图漏检率分别为17.86%、15.48%、13.10%和16.67%。
84例PWML病例中,31例因为病灶多发且相连呈线状、簇状或混合型无法明确计数,最终行序列检出病灶数计数比较的病例有53例,2名医师观察者间一致性检验如图3,图表中差值超出95%可信区间的数值为1~2个,即图表中的所计算差值的均数以及差值的点位于可信区间范围内的占到所有点的96.30%~98.15%,可认为2名观察者的一致性较好。取2名观察者间平均值进行比较。
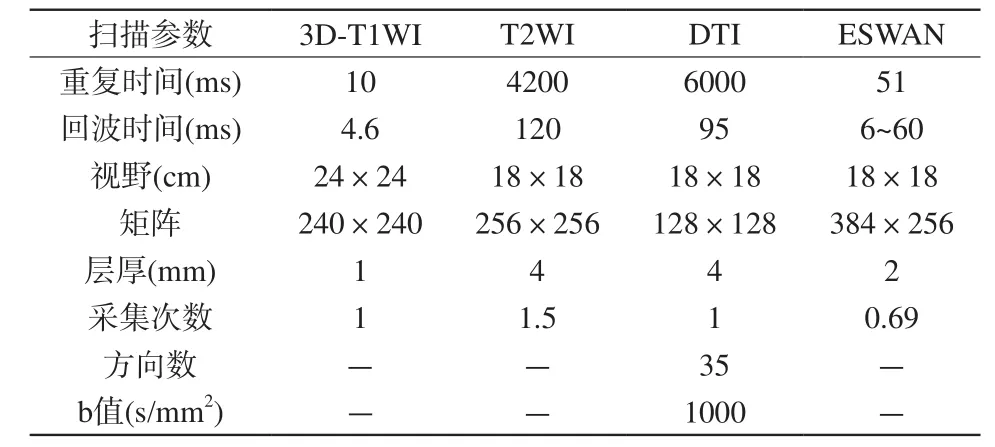
表1 磁共振成像扫描序列及参数Tab. 1 Magnetic resonance imaging protocols and scanning parameters

表2 研究对象的人口统计学资料Tab. 2 Demographics of subjects

图1,2 PWML病例。1A~E:男,胎龄40周,生后10 d;2A~E:男,胎龄31+6周,生后18 d。A:3D-T1WI,B:重建T1WI,C:T2WI,D:ADC图,E:Magnitude图Fig. 1, 2 PWML cases. 1A—E: A newborn boy of 40 weeks gestation, imaged on day 10. 2A—E: A newborn boy of 31+6 weeks gestation, imaged on day 18. A: 3D-T1WI, B: Reformatted T1WI, C: T2WI, D: ADC map, E: Magnitude map.

图3 2名观察者间五种序列图像检出病灶数Bland-Altman一致性检验 图4 各序列图像对可计数之53例PWML病例检出病灶数目的比较Fig. 3 Bland-Altman agreement test for the number of detected lesions between two observers in the five sequence images. Fig. 4 Comparision of the number of lesions detected by different sequence images in 53 countable PWML cases.
3D-T1WI、重建T1WI、常规T2WI、ADC图和Magnitude图对上述可计数之53例PWML病例所检出的病灶个数的中位数(范围)分别为4.5 (1~47)、1.5 (0~33)、2.0 (0~26)、2.0 (0~14)、1.0 (0~20),检出的病灶总数分别为422、151、185、142和152。行配对秩和检验,3D-T1WI与其他各序列两两比较有明显统计学差异(P<0.001,图4),其余各序列两两比较无统计学差异(P>0.05)。与3D-T1WI比较,重建T1WI、常规T2WI、ADC图及Magnitude图对PWML病灶的检出率分别为35.78% (151/422)、43.84% (185/422)、33.65%(142/422)、36.02% (152/422)。
3 讨论
本研究通过比较3D-T1WI、重建T1WI(作为常规T1WI)、常规T2WI、ADC图和Magnitude 图对PWML病例及病灶检出的差异,发现3D-T1WI对PWML的检出明显优于其他各序列。这与以往文献所及观点一致,但其均未进行比较研究。2010年Rutherford等[10]等在早产儿脑白质疾病磁共振成像的综述中提到,PWML病灶T1WI信号较T2WI明显,校正到足月时,T1WI较T2WI更易检测病灶。2011年Niwa等[11]在PWML磁敏感加权成像研究的讨论中提到,与T1WI相比,磁敏感加权成像对小的病灶显示困难。2015年Tortora等[7]通过比较3 mm自旋回波序列、3 mm反转恢复序列、1 mm 3D快速梯度回波序列及3D快速梯度回波序列3 mm重建等四个T1WI横轴位图像对T1高信号PWML病灶的检出,亦发现1 mm 3D快速梯度回波序列对PWML病灶检出数最高,但仅比较了T1WI相关序列,未进行其他序列的比较。
3.1 3D-T1WI序列的优点
3D-T1WI序列为三维容积扫描,空间分辨率高,具有良好的组织对比度。本研究3D-T1WI采用的FSPGR是运用180度预备反转脉冲和小角度激发梯度回波快速获得三维傅立叶数据采集的磁共振成像序列,与常规自旋回波序列相比,具有扫描时间短、信噪比高及组织对比明显的优点。本研究中3D-T1WI图像层厚薄,为1 mm,且是各向同性等体素扫描,信噪比高,因此对T1WI高信号病灶具有内在的高敏感性。Nossin-Manor等[12]通过对早产儿磁共振成像的研究认为高分辨T1、T2容积成像可应用于临床,提供诊断和形态信息。Wintersperger等[13]和Edelman等[14]的研究均证明3D-T1快速梯度回波序列较2D T1自旋回波序列信噪比高、图像质量好。
3.2 3D-T1WI序列检出率高于其它序列原因分析
3D-T1WI序列对PWML病例及病灶的检出率均高于常规T1WI、T2WI及磁共振新技术(ADC图、Magnitude图),其原因除了3D-T1WI序列自身优势外,还与以下因素有关:其一,与PWML病灶大小和序列层厚有关。常规T1WI、T2WI、ADC图层厚为4 mm,Magnitude 图层厚为2 mm,而PWML病灶多为点状,直径小于5 mm,在上述序列易因容积效应呈等信号或不明显而漏检;3D-T1WI层厚为1 mm,显示病灶清晰,容易检出病灶。Tortora等[7]通过比较3D快速梯度回波序列1 mm与3 mm重建图像对PWML病灶检出数目的差异,也证明降低层厚能明显提高PWML病灶的检出率。其二,与各序列特性及病灶呈现信号特点有关,PWML病灶在T1WI呈高信号,T2WI、ADC图呈低或等信号[15],Magnitude图呈低、等或高信号[11,16]。因此,T1WI高信号病灶均易检出,而其他序列上呈等信号的病灶是无法分辨被检出的。PWML病灶在T1WI高信号较T2WI低信号更亦被检出,这应该与新生儿脑实质含水较多有关,脑实质T1WI呈低信号,在低信号背景下T1WI高信号病灶对比更明显,呈现更清晰;而扩散成像,一周后检查ADC图存在假阴性[15,17];磁敏感加权成像上,低信号出血灶显示清晰,而胶质增生因为不同时期增生程度不同,明显增生可呈高、稍高信号,而部分过渡期呈等信号。本组病例中T2WI、ADC图等信号均有9例,占10.71%;幅度图等信号20例,占23.81%;这部分病例的等信号病灶是无法检出计数的。
3.3 3D-T1WI序列在新生儿PWML诊断中的意义
本研究结果显示,与3D-T1WI比较,重建T1WI、常规T2WI、ADC图及Magnitude图对PWML病灶数的检出率分别为35.78% (151/422)、43.84% (185/422)、33.65% (142/422)、36.02%(152/422),对PWML病例数漏检率分别为17.86%、15.48%、13.10%和16.67%。因此,应用3D T1WI不仅能提高PWML的检出率,更能精确反映病灶的范围,减少漏诊及漏检的发生。同时,3D等体素数据可以重建冠状及矢状图像,一次扫描即获得了良好的图像利于整体观察,也节省了时间,而且其吸收率低于SE序列,对体温调节能力尚不成熟的新生儿尤为重要,可以替代常规T1WI序列作为新生儿MR检查的常规扫描序列。本组数据中早产儿PWML发生率为37.50%(60/160),足月儿为23.27% (47/202),均高于以往文献报道的数值[6,10,18],应该与本研究应用3D-T1WI序列提高了PWML的检出有关。
3.4 本研究的不足
本研究不足之处在于考虑到新生儿MR检查时间不能太长,没有扫描常规T1WI序列,而是用3D-T1WI序列的重建图像作为常规T1WI图像进行比较,但在重建时参照了常规T2WI图像,重建层厚也用常规扫描4 mm层厚,尽可能与临床工作中常规T1WI一致。
综上所述,3D-T1WI序列不仅能提高PWML病灶的检出率,更能精确反映病灶的范围,减少漏诊的发生,推荐替代常规T1WI作为新生儿颅脑MR检查常规序列应用。
参考文献 [References]
[1] Wagenaar N, Chau V, Groenendaal F, et al. Clinical risk factors for punctate white matter lesions on early magnetic resonance imaging in preterm newborns. J Pediatr, 2017, 182(3): 34-40.
[2] Kersbergen KJ, Benders MJ, Groenendaal F, et al. Different patterns of punctate white matter lesions in serially scanned preterm infants .Plos One, 2014, 9(10): e108904.
[3] de Bruine FT, van den Berg-Huysmans AA, Leijser LM, et al.Clinical implications of MR imaging findings in the white matter in very preterm infants: a 2-year follow-up study. Radiology, 2011,261(3): 899-906.
[4] Gao J, Zhang YM, SUN QL, et al. White matter variations in preterm and full term neonates with punctate white matter lesions: a diffusion tensor study based on tract-based spatial statistics. Chin J Magn Reson Imaging, 2014, 5(1): 24-29.
高洁, 张育苗, 孙亲利, 等. 基于纤维束空间统计分析法研究早产及足月新生儿局灶性脑白质损伤的扩散张量成像特点. 磁共振成像, 2014, 5(1): 24-29.
[5] Childs AM, Cornette L, Ramenghi LA, et al. Magnetic resonance and cranial ultrasound characteristics of periventricular white matter abnormalities in newborn infants. Clin Radiol, 2001, 56(8): 647-655.
[6] Cornette L, Tanner S, Ramenghi L, et al. Magnetic resonance imaging of the infant brain: anatomical characteristics and clinical significance of punctate lesions. Arch Dis Child Fetal Neonatal Ed,2002, 86(3): 171-177.
[7] Tortora D, Panara V, Mattei PA, et al. Comparing 3T T1-weighted sequences in identifying hyperintense punctate lesions in preterm neonates. AJNR Am J Neuroradiol, 2015, 36(3): 581-586.
[8] Nanba Y, Matsui K, Aida N, et al. Magnetic resonance imaging regional T1 abnormalities at term accurately predict motor outcome in preterm infants. Pediatrics, 2007, 120(1): e10-19.
[9] Cote CJ, Wilson S. Guidelines for monitoring and management of pediatric patients during and after sedation for diagnostic and therapeutic procedures: an update. Pediatrics, 2006, 118(6):2587-2602.
[10] Rutherford MA, Supramaniam V, Ederies A, et al. Magnetic resonance imaging of white matter diseases of prematurity Neuroradiology, 2010, 52(6): 505-521.
[11] Niwa T, de Vries LS, Benders MJ, et al. Punctate white matter lesions in infants: new insights using susceptibility-weighted imaging .Neuroradiology, 2011, 53(9): 669-679.
[12] Nossin-Manor R, Chung AD, Morris D, et al. Optimized T1- and T2-weighted volumetric brain imaging as a diagnostic tool in very preterm neonates. Pediatric Radiology, 2011, 41(6): 702.
[13] Wintersperger BJ, Runge VM, Biswas J, et al. Brain tumor enhancement in MR imaging at 3 Tesla: comparison of SNR and CNR gain using TSE and GRE techniques. Invest Radiol, 2007,42(8): 558-563.
[14] Edelman RR, Dunkle EI. Rapid whole-brain magnetic resonance imaging with isotropic resolution at 3 Tesla. Invest Radiol, 2009,44(1): 54-59.
[15] Qi Y, Wang XM. Early Diagnostic and Prognostic Value of Diffusion Weighted Imaging In Premature Infants With Punctate White Matter Damage. J Clin Radio, 2010, 29(4): 515-518.
祁英, 王晓明. 扩散加权成像在早期诊断早产儿局灶性脑白质损伤及其预后的价值. 临床放射学杂志, 2010, 29(4): 515-518.
[16] Ren HP, Zhang L, Ren ZQ, et al. Value of contrast measurement of ESWAN-R2*value in diagnosis of neonatal punctate white matter lesions. Chin J Magn Reson Imaging, 2013, 4(3): 201-205.
任慧鹏, 张雷, 任转琴, 等. ESWAN-R2*值对比测量在新生儿局灶性脑白质损伤诊断中的价值. 磁共振成像, 2013, 4(3): 201-205.
[17] Mu L, Yang J, Yu BL. Neonatal hypoxic-ischemic encephalopathy:detection with diffusion-weighted and diffusion-tensor MR imaging.Chin J Magn Reson Imaging, 2010, 1(1): 60-64.
穆靓, 杨健, 鱼博浪. 磁共振弥散加权及张量技术在新生儿缺血缺氧性脑病中的应用. 磁共振成像, 2010, (1): 60-64.
[18] Wisnowski JL, Blüml S, Paquette L, et al. Altered glutamatergic metabolism associated with punctate white matter lesions in preterm infants. Plos One, 2013, 8(2): e56880.
