新型胰岛素增敏剂ZG02在大鼠肝微粒体中的代谢稳定性研究Δ
2019-01-02陈瑞张丽蔡进朱高峰1汤磊1黄静
陈瑞,张丽,蔡进,朱高峰1,,汤磊1,,黄静#
(1.贵州省化学合成药物研发利用工程技术研究中心,贵阳 550004;2.贵州医科大学药学院,贵阳 550004)
胰岛素增敏剂是一类针对胰岛素抵抗的2型糖尿病的治疗药物,也是目前降糖药研发的热点之一[1]。腺苷酸活化蛋白激酶(AMPK)是一种重要的代谢应激蛋白激酶,在调节代谢和能量平衡特别是在胰岛素抵抗发生过程中发挥着重要的作用[2-3]。本课题组在前期研究中发现一系列四氢咔唑类化合物具有明显的降糖作用,其中的代表性化合物ZG02[6-苄氧基-9-(4-氯甲苯酰基)-四氢化咔唑-3-羧酸,化学结构见图1]具有较好的胰岛素增敏活性,可通过激活AMPK途径来降低db/db小鼠的血糖和胰岛素水平[4];同时,ZG02在体内活性测试中并未表现出罗格列酮样体质量增加等不良反应[5],是一种极具开发价值和应用前景的化合物。

图1 ZG02的化学结构Fig 1 Chemical structure of ZG02
与体内代谢研究不同,体外代谢研究可在新药研发早期利用体外代谢参数合理预测候选化合物的体内药动学行为,指导其后期药效学、药动学研究以及安全性评价模型的选择,有助于缩小体内研究的筛选范围[6-7]。化合物代谢稳定性差意味着其在体内较易被代谢,往往导致不良的药动学性质,如体内生物利用度低、作用时间短等[8]。药物代谢可分为Ⅰ相和Ⅱ相:Ⅰ相代谢最重要的酶系为细胞色素P450(CYP),该酶系包含两个重要的蛋白组分,即含铁血红素蛋白和黄素蛋白,后者能将还原型烟酰胺腺嘌呤二核苷酸磷酸(即还原型辅酶Ⅱ,NADPH)的电子转移至CYP-底物复合体上,完成药物的氧化、还原反应[9-11];Ⅱ相代谢的结合代谢酶为尿苷二磷酸(UDP)-葡萄糖醛酸转移酶(UGT),其中UGT是一类位于内质网膜上的超家族代谢酶,也是Ⅱ相代谢过程中的主要酶系,可以将尿苷二磷酸葡萄糖醛酸(UDPGA)上的葡萄糖醛酸转移至内源性或外源性化合物上,完成药物的葡萄糖醛酸化结合反应[12-13]。为初步预测ZG02在大鼠体内的代谢情况,本研究以超高效液相色谱-串联质谱法(UPLC-MS/MS)为检测手段,对ZG02在大鼠肝微粒体孵育体系(包括Ⅰ相、Ⅱ相及两相孵育体系)中的体外代谢特征进行分析,以期为其体内消除规律研究、代谢产物确证以及药物应用等提供理论依据。
1 材料
1.1 仪器
Xevo G2-XS型超高效液相色谱-四级杆串联飞行时间质谱仪(UPLC-QTOF-MS),配有MassLynx V4.1质谱工作站、UNIFI 7.0数据库(美国Waters公司);JN300-2型氮气吹扫仪(苏州吉米诺仪器有限公司);X1型高速离心机(香港基因有限公司);KH-600E型超声波清洗器(昆山禾创超声仪器有限公司);FA805N型十万分之一电子天平(上海菁海仪器有限公司);DW-86L486型超低温冰箱(青岛海尔股份有限公司)。
1.2 药品与试剂
ZG02对照品[贵州医科大学药物化学重点实验室制备,纯度:>98%];吲哚美辛对照品(内标,批号:J0526A5,纯度:>98%)、雄性SD大鼠肝微粒体(批号:J0202A)均购自大连美仑生物技术有限公司;葡萄糖-6-磷酸二钠(G-6-P-Na2,批号:116B039)、葡萄糖-6-磷酸脱氢酶(G-6-P-DH,批号:20160725)、烟酰胺腺嘌呤二核苷酸磷酸二钠(NADP-Na2,批号:718B0225)均购自北京索莱宝科技有限公司;UDPGA(美国Sigma-Aldrich公司,批号:SLBT1945);1,4-单内酯(上海源叶生物科技有限公司,批号:S10M8I31074);丙甲菌素(加拿大Toronto Research Chemicals公司,批号:8-JIN-165-1;临用前用适量二甲基亚砜溶解,再用水稀释至相应浓度);甲酸、甲醇、乙腈均为色谱纯,氯化镁、柠檬酸钠等均为分析纯,水为蒸馏水。
2 方法与结果
2.1 溶液的制备
2.1.1 待测物和内标溶液 精密称取ZG02对照品适量,用甲醇溶解并定容,配制成质量浓度为20 mg/L的ZG02贮备液;同法配制质量浓度为10 mg/L的内标贮备液;上述溶液均置于4℃冰箱中保存,备用。临用前,将ZG02贮备液用适量甲醇稀释后,再以磷酸盐缓冲液(PBS,pH 7.4,下同)稀释至孵育浓度,并确保孵育体系中甲醇的含量不超过1%[14];将内标贮备液用甲醇稀释,得质量浓度为100 μg/L的内标溶液。
2.1.2 NADPH辅酶溶液 A液:依次取NADP-Na2200 mg、G-6-P-Na2200 mg、氯化镁133 mg,用水溶解并定容至10 mL,于-20℃保存。B液:依次取柠檬酸钠44 mg、G-6-P-DH 1 000 U,用水溶解并定容至25 mL,于-20℃保存。临用前,取A、B液按体积比5∶1混匀,得浓度为1 mmol/L(按反应产物NADPH计)的NADPH辅酶溶液[15]。
2.1.3 UDPGA辅酶溶液 精密称取UDPGA适量,临用前用水溶解并定容,配制成浓度为5 mmol/L的UDPGA辅酶溶液。
2.2 体外孵育体系的建立
2.2.1 由NADPH启动的Ⅰ相孵育体系 取大鼠肝微粒体适量,用PBS稀释至0.5 g/L,随后加入“2.1.1”项下经稀释的ZG02贮备液适量,使ZG02的最终质量浓度为100 μg/L。将上述溶液置于37℃水浴中静置5 min后,加入“2.1.2”项下NADPH辅酶溶液30 μL以启动反应。该体系总体积为200 μL,有机溶剂的含量不得超过5%。
2.2.2 由UDPGA启动的Ⅱ相孵育体系 取大鼠肝微粒体适量,用PBS稀释至0.5 g/L,加入丙甲菌素[0.025 g/L(最终质量浓度,下同)],混匀,于冰浴中孵育15 min;随后加入1,4-单内酯(5 mmol/L)、氯化镁(5 mmol/L)以及“2.1.1”项下经稀释的ZG02贮备液适量,使ZG02的最终质量浓度为100 μg/L。将上述溶液置于37℃水浴中静置5 min后,加入“2.1.3”项下UDPGA辅酶溶液30 μL以启动反应。该体系总体积为200 μL,有机溶剂的含量不得超过5%。
2.2.3 由NADPH和UDPGA联合启动的两相孵育体系 取大鼠肝微粒体适量,用PBS稀释至0.5 g/L,加入丙甲菌素(0.025 g/L),混匀,于冰浴中孵育15 min;随后加入1,4-单内酯(5 mmol/L)、氯化镁(5 mmol/L)以及“2.1.1”项下经稀释的ZG02贮备液适量,使ZG02的最终质量浓度为100 μg/L。将上述溶液置于37℃水浴中静置5 min后,加入“2.1.2”项下NADPH辅酶溶液和“2.1.3”项下UDPGA辅酶溶液30 μL以启动反应。该体系总体积为200 μL,有机溶剂的含量不得超过5%。
2.2.4 大鼠肝微粒体孵育及样品处理 取“2.2.1”“2.2.2”“2.2.3”项下经启动的孵育体系各适量,置于37 ℃水浴中,分别于孵育0、5、10、15、20、30、45 min时加入含内标100 μg/L的乙腈溶液400 μL终止反应,涡旋混匀30 s后,于4℃下以16 000×g离心10 min;取上清液以氮气流吹干,残渣用甲醇复溶,以16 000×g离心10 min;取上清液适量进行UPLC-MS/MS分析,考察各时间点孵育体系中ZG02的质量浓度。各孵育体系均平行操作3次。
2.3 UPLC-MS/MS方法学考察
2.3.1 色谱与质谱条件 色谱柱:Waters BEH C18(50 mm×2.1 mm,1.7 μm);保护柱:Waters VanGuard BEH C18(5 mm×2.1 mm,1.7 μm);流动相:水(含0.01%甲酸)-乙腈(含0.01%甲酸)(35∶65,V/V);流速:0.4 mL/min;柱温:35 ℃;进样量:2 μL;采集时间:3 min。离子源:电喷雾离子源(ESI);以多反应监测(MRM)模式进行负离子扫描;毛细管电压:1.5 kV;锥孔电压:30 V;离子源温度:100℃;脱溶剂气温度:300℃;锥孔气流速:50 L/h;脱溶剂气流速:600 L/h;扫描范围:m/z50~1 000;二级碰撞能量:16.5 eV;用于定量分析的离子对分别为m/z458.115 9→323.073 0(ZG02)、m/z356.069 0→312.080 4(内标)。ZG02和内标的二级质谱图见图2。
2.3.2 专属性 取空白孵育样品(即“2.2.3”项下不含ZG02的两相孵育体系)、ZG02对照样品(即“2.2.3”项下含ZG02的两相孵育体系)、肝微粒体孵育样品[即“2.2.3”项下含ZG02两相孵育体系按“2.2.4”项下方法处理后(孵育30 min时)所得样品]各适量,按“2.3.1”项下色谱与质谱条件进样分析,色谱图见图3。结果,内标和ZG02的峰形均良好,保留时间分别为0.70、1.57 min,孵育体系中的内源性物质并未干扰待测物的测定,提示本方法的专属性良好。
图2 ZG02和内标的二级质谱图Fig 2 Secondary mass spectrums of ZG02 and internal standard
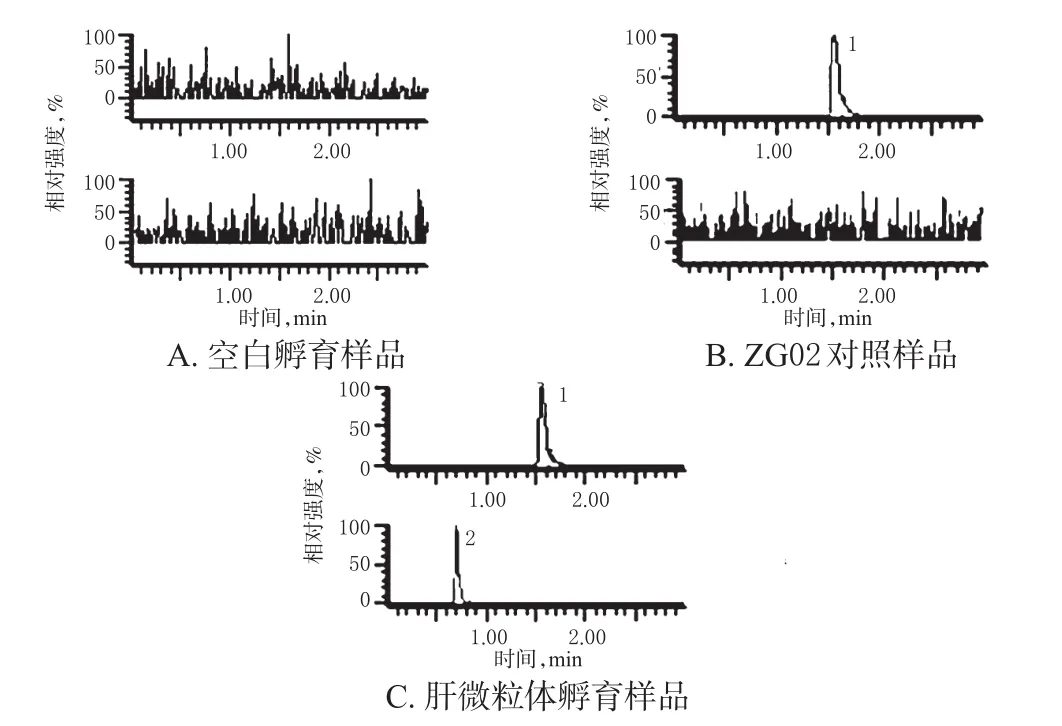
图3 典型MRM图Fig 3 Typical MRM chromatograms
2.3.3 标准曲线的绘制、定量下限及最低检测限的考察 取“2.1.1”项下ZG02贮备液适量,分别用PBS稀释成质量浓度为10、20、50、200、500、1 000、2 000、4 000 μg/L的系列对照品溶液。精密量取上述系列对照品溶液各适量,加至“2.2.3”项下经甲醇灭活的大鼠肝微粒体两相孵育体系(200 μL)中,配制成ZG02质量浓度分别为1、2、5、20、50、100、200、400 μg/L的系列样品溶液,按“2.2.4”项下方法孵育2 h后,再按“2.3.1”项下色谱与质谱条件进样分析,记录峰面积。以待测物与内标的峰面积比值(y)为纵坐标、待测物质量浓度(c,μg/L)为横坐标,采用加权最小二乘法(权重系数为1/c2)进行线性回归。另同法配制并处理得质量浓度分别为1、0.5、0.25 μg/L的样品溶液,考察定量下限(信噪比为10∶1)和最低检测限(信噪比为3∶1)。结果,回归方程为y=0.097 2c+0.002 7(r2=0.999 2),ZG02检测质量浓度线性范围为1~400 μg/L,定量下限为1 μg/L,最低检测限为0.25 μg/L。
2.3.4 精密度与准确度试验 按“2.3.3”项下方法配制ZG02低、中、高质量浓度(2、100、200 μg/L)的质控样品各5份,按“2.2.4”项下方法孵育2 h后,进样分析,考察日内精密度;连续测定3 d,考察日间精密度。将实测质量浓度与理论质量浓度进行比较,考察准确度。结果,各质控样品的日内、日间RSD均小于10%,准确度为87.26%~94.58%,详见表1。
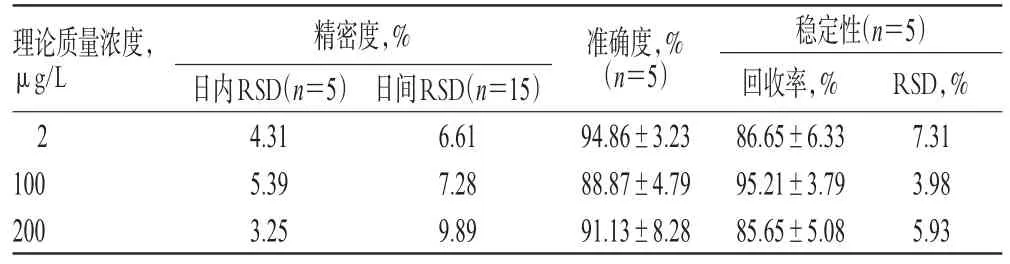
表1 精密度、准确度及稳定性试验结果Tab 1 Results of accuracy,precision and stability tests
2.3.5 提取回收率及基质效应考察 按“2.3.3”项下方法配制ZG02低、中、高质量浓度(2、100、200 μg/L)的质控样品各5份,按“2.2.4”项下方法孵育2 h后,进样分析,得色谱峰峰面积(A1)。取“2.2.3”项下两相孵育体系适量,按“2.2.4”项下方法孵育2 h后,加入ZG02对照品溶液适量,使最终质量浓度与质控样品对应,进样分析,得色谱峰峰面积(A2)。以甲醇配制对应质量浓度的ZG02样品,按“2.2.4”项下方法孵育2 h后,进样分析,得色谱峰峰面积(A3)。每个质量浓度平行操作5次。提取回收率=A1/A2×100%,基质效应=A2/A3×100%。结果,低、中、高质量浓度质控样品和内标的提取回收率分别为(82.86±3.23)%、(88.87±4.79)%、(81.13±8.28)%、(87.28±6.29)%,RSD分别为4.01%、5.39%、10.21%、7.16%(n=5);基质效应分别为(84.22±3.58)%、(88.72±5.22)%、(93.56±4.28)%、(93.81±5.06)%,RSD分别为4.25%、5.88%、4.57%、5.39%(n=5),表明提取方法和基质效应均不会影响ZG02质量浓度的测定。
2.3.6 稳定性试验 按“2.3.3”项下方法配制ZG02低、中、高质量浓度(2、100、200 μg/L)的质控样品各5份,按“2.2.4”项下孵育2 h后,考察其在室温下放置12 h的稳定性(以实测质量浓度与理论质量浓度的比值即回收率表示)。结果,各质控样品回收率的RSD均小于10%(n=5),表明其在室温下放置12 h稳定,详见表1。
2.4 ZG02体外代谢稳定性研究
按“2.2.4”项下方法进行体外代谢稳定性研究,采用底物消除法考察ZG02的代谢情况。以孵育0 min时ZG02的质量浓度为参照,其他时间点的质量浓度与之相比计算其药物剩余百分比,采用GraphPad Prism 7.0软件绘制ZG02在3种孵育体系中的药物剩余百分比-时间曲线,详见图4。由图4可见,ZG02在Ⅰ相孵育体系中代谢较慢,而在两相孵育体系中代谢较快。
将各时间点的药物剩余百分比的自然对数对孵育时间作线性回归,得斜率k,并以此计算ZG02的酶动力学参数[包括半衰期(t1/2)和清除率(CLint)]和各代谢酶的贡献率(F)。其中,t1/2=-0.693/k,CLint=[(0.693/t1/2)×孵育体系体积(μL)]/肝微粒体质量(mg)[14];FⅠ相=CLint(Ⅰ相)/CLint(两相)×100%,FⅡ相=CLint(Ⅱ相)/CLint(两相)×100%。以t1/2评估代谢稳定性:t1/2<30 min,为代谢不稳定;30 min≤t1/2≤90 min,为代谢稳定性中等;t1/2>90 min,为代谢稳定[15],结果详见表2。
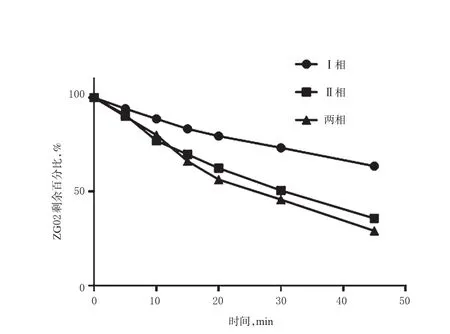
图4 ZG02在大鼠肝微粒体不同孵育体系中的药物剩余百分比-时间曲线Fig 4 Residual percentage-time curves of ZG02 in liver microsomes of rats in different incubation systems

表2 ZG02在大鼠肝微粒体不同孵育体系中的酶动力学参数Tab 2 Enzyme kinetic parameters of ZG02 in liver microsomes of rats in different incubation systems
由表2可见,孵育45 min时,在NADPH启动的Ⅰ相孵育体系和UDPGA启动的Ⅱ相孵育体系中,ZG02的剩余百分比分别为(73.33±1.53)%、(50.63±3.42)%,t1/2分别为67.28、30.26 min,表明其在单相孵育体系中的代谢稳定性中等,且在Ⅱ相中的代谢稳定性较Ⅰ相差;在NADPH和UDPGA联合启动的两相孵育体系中,ZG02的剩余百分比为(45.81±2.56)%,t1/2为25.57 min,提示其在两相孵育体系中的代谢稳定性差。
另外,F值的分析结果显示,CYP酶(Ⅰ相代谢酶)、UGT酶(Ⅱ相代谢酶)的F值分别为38.01%、84.50%,后者的F值更大,提示ZG02在大鼠肝微粒体中的代谢反应可能以UGT酶介导的葡萄糖醛酸化结合反应为主。
3 讨论
与体内代谢稳定性研究相比,药物体外代谢稳定性研究可排除体内诸多干扰因素(如磷脂、脂肪酸、尿素等)的影响,有助于更直接地观察药物的代谢特征,具有省时、稳定、高效的特点,适用于体内代谢转化率低且缺乏高灵敏度检测方法的药物,亦可用于候选化合物的高通量筛选[6-7,14]。但现有药物体外代谢稳定性研究多集中在CYP酶介导的Ⅰ相代谢上,而对UGT酶介导的Ⅱ相代谢相关研究较少[16]。为此,本研究分别以NADPH启动的Ⅰ相孵育体系、UDPGA启动的Ⅱ相孵育体系、二者共同启动的两相孵育体系为介质,借助UPLC-MS/MS法考察了新型胰岛素增敏剂ZG02的体外代谢稳定性。
3.1 Ⅱ相孵育体系的建立
经正常离心后得到的微粒体有部分为微粒体小囊泡,UGT酶的活性位点被封闭在其中,因此需要将其与适量的丙甲菌素混合,并通过在冰浴中孵育(15 min)来为内质网膜“打孔”,以释放肝微粒体中的UGT酶[14]。
3.2 UPLC-MS/MS法的条件筛选
本研究在前期预试验中考察了水-甲醇、水-乙腈、水(含甲酸)-甲醇、水(含甲酸)-乙腈、水(含甲酸)-甲醇(含甲酸)、水(含甲酸)-乙腈(含甲酸)等流动相体系对ZG02定量分析的影响。结果显示,当以水(含0.01%甲酸)-乙腈(含0.01%甲酸)(35∶65,V/V)为流动相进行洗脱时,ZG02和内标的色谱峰峰形均良好,且不受内源性物质的干扰,同时分析时间较短,故最终选择其作为定量分析的流动相体系。
3.3 孵育体系中药物质量浓度的确定
底物消除法是一种常用的检测药物代谢酶动力学参数的方法[17]。由于本课题组暂未能确证ZG02的代谢产物,故采用底物消除法来评估该化合物的体外代谢情况。为了能够排除系统误差的干扰以准确检测ZG02的代谢情况,本课题组在预试验中对孵育体系中的药物质量浓度(25、100、1 000 μg/L)进行了优化。结果发现,当ZG02的质量浓度为100 μg/L时,孵育后剩余药物质量浓度并不算太高,且至少有20%的药物被清除[15],故以此作为孵育体系中ZG02的质量浓度。
3.4 ZG02在大鼠肝微粒体中的代谢特征分析
本研究结果显示,在NADPH启动的Ⅰ相孵育体系、UDPGA启动的Ⅱ相孵育体系、二者共同启动的两相孵育体系中,ZG02 的t1/2分别为 67.28、30.26、25.57 min,CLint分别为20.60、45.80、54.20 μL/(mg·min)。这提示在3种孵育体系中,ZG02的代谢稳定性依次为Ⅰ相>Ⅱ相>两相。CYP酶及UGT酶的F值分别为38.01%、84.50%。这提示ZG02在大鼠肝微粒体中的代谢反应可能以UGT酶介导的葡萄糖醛酸化结合反应为主。
综上所述,本研究建立的UPLC-MS/MS法简便、快速、专属性强,可用于大鼠肝微粒体孵育体系中ZG02质量浓度的测定及其体外代谢稳定性的研究。新型胰岛素增敏剂ZG02在NADPH和UDPGA联合启动的两相孵育体系中的代谢稳定性较差,且代谢反应可能以UGT酶介导的葡萄糖醛酸化结合反应为主。后续本课题组将借助高分辨质谱、波谱等手段确证ZG02的代谢产物,并结合体内外研究进一步阐明其代谢过程及特征,以期为其开发利用提供更多的参考。
