紫荆叶提取物对酪氨酸酶活性抑制作用的谱效关系研究Δ
2019-01-02孙慧玲何楠史梦珺AdelFahmiAhmed李昌勤
孙慧玲,何楠,史梦珺,Adel FahmiAhmed,李昌勤
(1.河南大学药学院/河南省药食两用资源功能研究国际联合实验室,河南 开封 475004;2.开封市保健食品功效成分研究重点实验室,河南 开封 475004;3.埃及国家农业研究中心药用与芳香植物研究所,埃及 吉萨 12619)
紫荆(Cercis chinensis)为豆科紫荆属植物,是一种常见的栽培植物,在全国各地均有分布[1]。紫荆作为传统中药,其花可用于治疗鼻中疳疮、风湿骨痛,其果可用于治疗咳嗽,其树皮可用于治疗风湿寒痹、血气疼痛、痈肿等[2-3]。相关文献表明,紫荆属植物中的化学成分有黄酮类、木脂素类以及二苯乙烯类等,其中以黄酮类化合物为主[4]。
随着人们生活水平的提高,越来越多的女性对皮肤的白皙度十分关注。但是受紫外线照射、环境污染等因素的影响,会导致人体黑色素代谢异常、黑色素细胞分泌的黑色素增加并使局部皮肤变黑,从而发生雀斑和黄褐斑等色素沉着性疾病[5]。酪氨酸酶是一种含铜氧化酶,是黑色素细胞合成黑色素的关键性酶,而通过抑制酪氨酸酶活性,可减少黑色素的形成,从而发挥美白的功效[6-7]。因此,可通过考察药物对酪氨酸酶活性的抑制作用来评价其美白效果。研究表明,紫荆属植物中的黄酮类化合物对酪氨酸酶活性具有竞争性抑制作用[8-9],如紫荆叶中就含有此类酪氨酸酶活性抑制成分[10]。
中药成分复杂,要阐明某种成分与相应药效活性的关系较为困难,而中药谱效学能够将中药指纹图谱和药效学结合起来,既能标示出中药含有的多种成分,又能很好地揭示成分与药效的关系[11-13]。因此,中药谱效学常用于阐明中药中各成分对药效的贡献程度,其主要方法包括多元线性回归分析法、偏最小二乘回归分析法等[14]。本研究采用最小偏二乘回归分析法,根据紫荆叶提取物对酪氨酸酶活性的抑制作用,考察其特征图谱所代表的不同成分对该抑制作用的贡献程度,以期为筛选具有酪氨酸酶活性抑制作用的天然美白原料提供理论基础和试验依据。
1 材料
1.1 仪器
AB135-S型十万分之一电子天平(瑞士梅特勒-托利多仪器有限公司);LC-20A型高效液相色谱(HPLC)仪(包括DGU-20A5R在线脱气机、LC-20AT输液泵、SIL-20A自动进样器、CTO-20A柱温箱、SPD-M20A紫外检测器及LC-Solution色谱数据处理系统,日本岛津公司);Multiskan MK3型全波长酶标仪(美国Thermo Electron公司);分样筛(上虞市五四仪器厂);TGL-16型高速离心机(金坛市中大仪器厂);GRP-9270型隔水式恒温培养箱(上海森信实验仪器有限公司);HH-S型数显恒温水浴锅(常州翔天实验仪器厂)。
1.2 试剂
左旋多巴对照品(上海Alfa Aesar公司,批号:10102261,纯度:98%);酪氨酸酶(美国Worthingto Biochemical公司,批号:33K14431,活性:1 050 U/mg);冰醋酸(分析纯)、甲醇(色谱纯)均购自天津市大茂化学试剂厂;水为杭州娃哈哈集团有限公司纯净水。
1.3 药材
紫荆叶采集于河南大学金明校区,每隔半个月采收一批,共16个批次(分别采收于2016年4月21日、5月4日、5月19日、6月3日、6月18日、7月3日、7月18日、8月2日,2017年4月19日、5月4日、5月19日、6月4日、6月19日、7月4日、7月19日、8月4日,批次编号依次为S1~S16),经河南大学药学院李昌勤教授鉴定为紫荆属植物紫荆(C.chinensis)的叶。标本存放于河南省药食两用资源功能研究国际联合实验室。
2 方法
2.1 紫荆叶提取物供试品溶液的制备
取干燥紫荆叶,粉碎后过70目筛,精密称取粉末500 mg,置于10 mL EP管中,加入70%乙醇5 mL,在50℃水浴条件下加热提取2 h;3 000 r/min离心3 min,取上清液用70%乙醇稀释,依次得到100、50、25 mg/mL(按生药计)的紫荆叶提取物供试品溶液。
2.2 紫荆叶提取物量化特征色谱图的生成及共有峰的确定
采用HPLC法测定。色谱条件:色谱柱为InertSustain C18(150 mm×4.6 mm,5 μm);流动相为甲醇(A)-0.1%冰醋酸溶液(B),梯度洗脱(0→13 min,30%A→43%A;13→15 min,43%A→50%A;15→22 min,50%A;22→35 min,50%A→68%A);流速为0.8 mL/min;柱温为30 ℃;检测波长为254 nm;进样量为10 μL。
取16个批次紫荆叶,分别按“2.1”项下方法制备质量浓度为100 mg/mL(按生药计)的紫荆叶提取物供试品溶液,进样测定,得到相应色谱图。以各批次供试品溶液的色谱图为参照图谱,采用《中药色谱指纹图谱相似度评价系统2004(A版)》,设时间窗口为0.5,选择各批次样品中均含有的、含量相对较高且分离度较好的色谱峰位进行多点校正,采用峰面积平均数法生成量化特征色谱图,并匹配共有峰。
2.3 紫荆叶提取物对酪氨酸酶活性的抑制率测定
采用体外酪氨酸酶多巴速率氧化微量法[15]测定酪氨酸酶活性抑制率。(1)向96孔板中依次加入磷酸盐缓冲液(pH 6.8)45 μL、50%甲醇5 μL、0.2 U/mL酪氨酸酶溶液25 μL,30 ℃温育10 min;然后加入0.5 mg/mL左旋多巴对照品溶液25 μL,振荡混匀,30℃反应5 min。用酶标仪在492 nm波长处测定吸光度(A溶剂)。(2)用不同质量浓度的紫荆叶提取物供试品溶液(100、50、25 mg/mL)5 μL代替50%甲醇5 μL,按“(1)”项下方法操作,测定吸光度(A样品)。(3)不加入酪氨酸酶,分别按“(1)”“(2)”项下方法操作,测定不加酶的溶剂空白组、不加酶的样品空白组的吸光度(A溶剂空白、A样品空白)。(4)按公式计算酪氨酸酶活性抑制率:抑制率(%)=[(A样品-A样品空白)/(A溶剂-A溶剂空白)-1]×100%。
2.4 谱效关系的数据分析
采用偏最小二乘回归分析法进行谱效分析。以紫荆叶提取物的量化特征图谱中共有峰的峰面积为自变量(X)、紫荆叶提取物对酪氨酸酶活性的抑制率为因变量(Y),采用DPS 7.05分析软件建立偏最小二乘回归方程,分别筛选出与酪氨酸酶活性抑制作用有显著相关性的色谱峰。
3 结果
3.1 紫荆叶提取物特征色谱图中的共有峰
16个批次紫荆叶提取物的特征色谱图匹配出16个共有峰(分别命名为P1~P16)。其量化特征色谱图见图1。
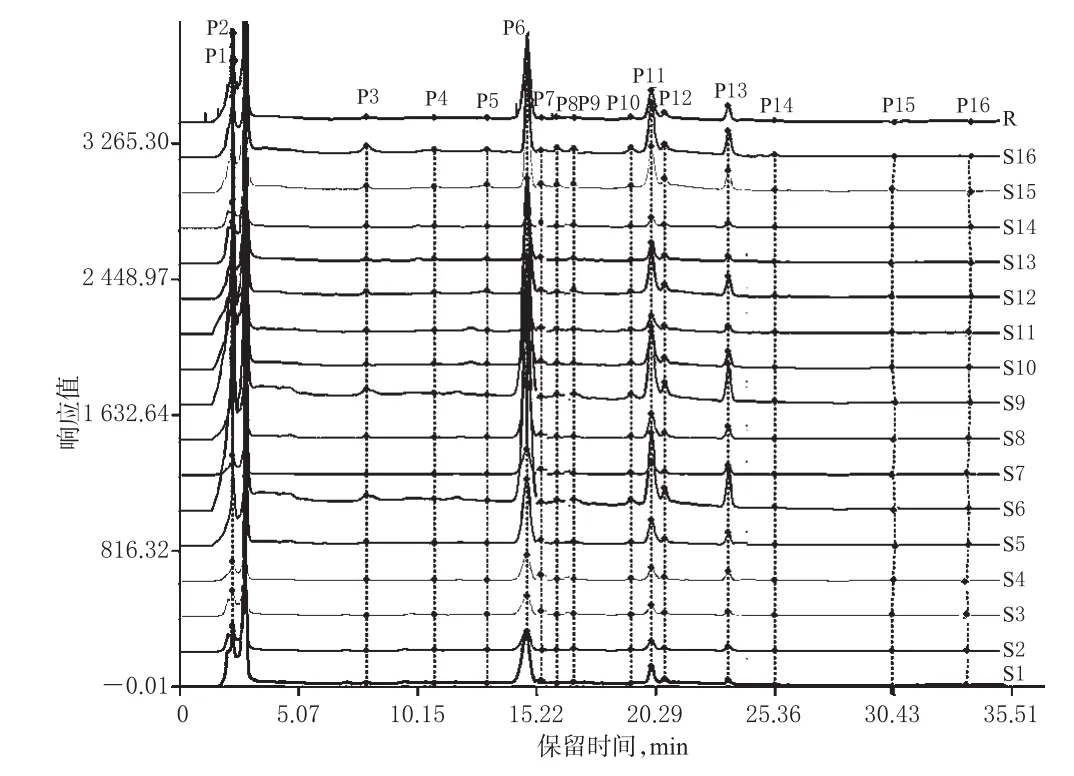
图1 16个批次紫荆叶提取物的量化特征色谱图Fig 1 Quantitative characteristic chromatogram of the extract of 16 batches of C.chinensis leaves
3.2 紫荆叶提取物对酪氨酸酶活性的抑制率
16个批次紫荆叶提取物对酪氨酸酶活性的抑制率测定结果见表1。由表1可见,不同批次紫荆叶提取物的酪氨酸酶活性抑制率存在明显差别;总体上看,其质量浓度越高,对酪氨酸酶活性的抑制作用越强,但其质量浓度与酶活性抑制率不呈线性相关性。
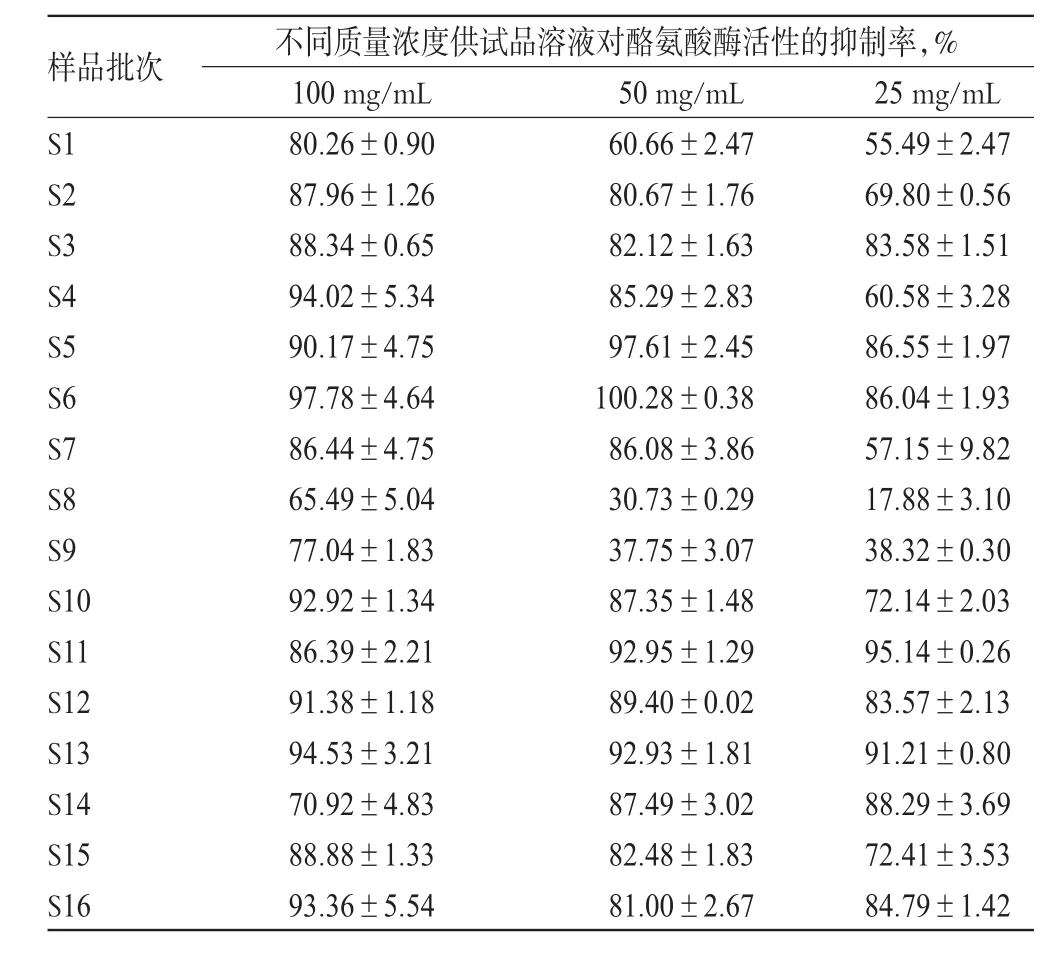
表1 16个批次紫荆叶提取物的酪氨酸酶活性抑制率Tab 1 Inhibition rate of 16 batches of the extract of C.chinensis leaves on tyrosinase activity
3.3 谱效关系分析结果
3.3.1 偏最小二乘回归方程的建立 由表1可见,紫荆叶提取物对酪氨酸酶活性抑制作用最强(即抑制率最高)的质量浓度为100 mg/mL,因此以该质量浓度紫荆叶提取物供试品溶液对应的酪氨酸酶活性抑制率作为因变量(Y)进行偏最小二乘回归分析。数据经标准化处理后模型误差平方和随着潜在因子的增加而逐渐增大,当潜在因子达到3时,误差平方和达到最大值,此时得到回归方程:Y=-0.047 423X1-0.150 273X2-0.056 010X3-0.236 157X4+0.173 663X5+0.045 081X6+0.071 250X7+0.139 081X8-0.056 328X9+0.216 580X10+0.082 024X11+0.160 168X12-0.032 678X13-0.038 361X14+0.344 516X15+0.103 491X1(6注:Y表示酪氨酸酶抑制率,Xi表示各共有峰峰面积)。特征共有峰-酪氨酸酶活性抑制率的偏最小二乘回归模型标准化回归系数图见图2。
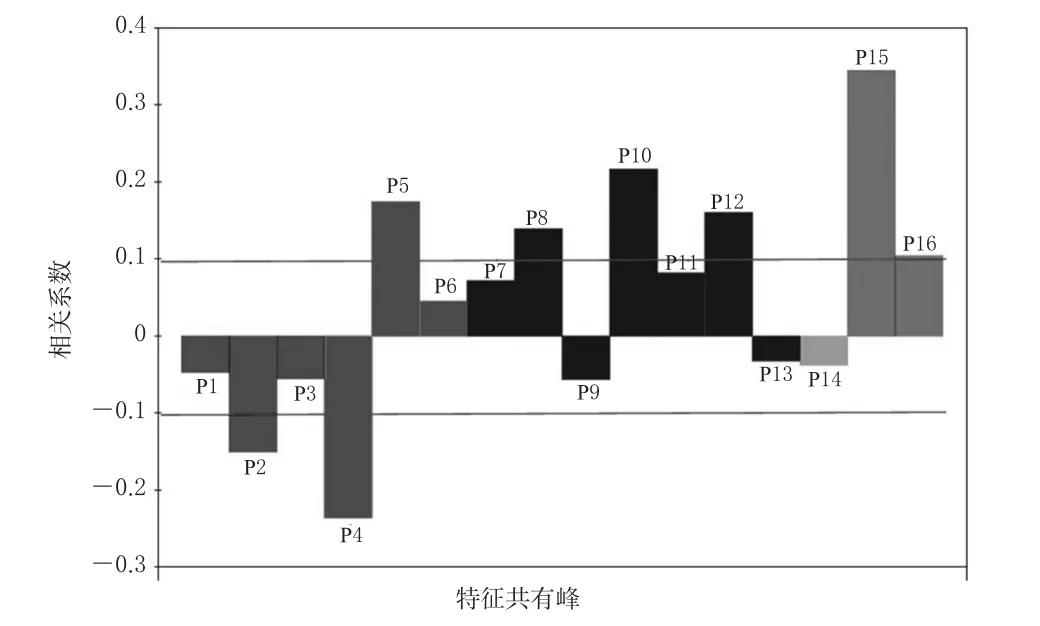
图2 特征共有峰-酪氨酸酶活性抑制率的偏最小二乘回归模型标准化回归系数图Fig 2 Standardization regression coefficient of PLSR model of characteristics common peak-tyrosinase inhibition activity
3.3.2 酶活性抑制作用相关的特征共有峰的确定 由图2可知,P5、P8、P10、P12、P15、P16号共有峰与紫荆叶提取物的酪氨酸酶活性抑制作用呈正相关,且相关系数较大(R>0.1)[16],这提示当这些峰代表的化合物含量增加时,紫荆叶提取物对酪氨酸酶活性的抑制作用增强;P2、P4号共有峰与紫荆叶提取物的酪氨酸酶活性抑制作用呈负相关,且相关系数的绝对值较大(│R│>0.1)[16],这提示当这些峰代表的化合物含量增加时,紫荆叶提取物对酪氨酸酶活性的抑制作用减弱。
4 讨论
中药成分复杂多样,在其物质基础研究过程中会得到大量数据,而计算机强大的编程和建模功能可为其复杂的物质基础研究提供可靠而有力的帮助。李戎等[17]在2002年正式提出了“谱效关系”的概念,指出将中药指纹图谱与药效联系起来,建立与中药疗效基本一致的成分控制质量标准。而用于谱效关系数据处理的偏最小二乘回归分析法,是一种包括了多因变量对多自变量的回归建模以及主成分分析在内的多元数据分析方法,具有计算量小、预测精度高、无需剔除样本点、易于定性解释等优点,能最大限度地利用有限的数据信息,并具有较好的预测性[18]。目前,中药谱效关系主要应用于控制不同产地、来源、采收期、批次中药饮片的质量[19-24]。
本研究对紫荆叶提取物的化学成分进行HPLC分析前,在预试验中曾采用二极管阵列检测器对紫荆叶提取物进行全波长扫描。结果显示,检测波长为254 nm时所获得的HPLC图谱信息比较丰富、基线较为平稳、整体吸收强度较为均衡,因此选择254 nm为检测波长。
本研究对紫荆叶提取物的酪氨酸酶活性抑制作用考察显示,不同采收时期的紫荆叶样品的提取物对酪氨酸酶活性的抑制率存在明显差别,且提取物浓度与其酶活性抑制率不呈线性相关性。这提示紫荆叶中存在多种可影响酪氨酸酶活性的化学成分,有的可抑制酪氨酸酶,有的可激活酪氨酸酶,有的可能具有双向调节作用。
本研究通过谱效关系分析证实,紫荆叶提取物质量浓度为100 mg/mL(以生药计)时,P5、P8、P10、P12、P15、P16号共有峰与其对酪氨酸酶活性的抑制作用呈正相关,P2、P4号共有峰与其对酪氨酸酶活性的抑制作用呈负相关。但上述共有峰面积(代表化合物的含量)与酪氨酸酶活性抑制作用的正/负相关性只能表示其作用趋势,并不表示这些化合物直接对酪氨酸酶活性起抑制或激活作用;且谱效关系分析是以各个峰作为独立样本为假设前提,而忽略了不同化合物之间的相互作用。因此,这些特征色谱峰所代表的化合物的结构仍需进一步鉴定,化合物之间的相互作用仍需进一步深入探索。
