Gd-EOB-DTPA增强MRI评价肝细胞肝癌分化程度
2018-12-28陈佳文利龚明福杨柳
陈佳, 文利, 龚明福, 杨柳
肝细胞肝癌(hepatocellular carcinoma,HCC)是我国最常见、致死率最高的恶性肿瘤之一,HCC的分化程度对治疗方案的选择以及患者的预后具有重要影响[1]。目前,确定HCC的分化程度主要依靠活检或手术病理检查,但均为侵入性方法,并存在取样偏差、易导致并发症等缺点,具有一定的局限性。前期的研究已表明,不同分化程度的HCC具有不同的血供方式[2],提示可以通过血供方式来判断肿瘤的病理分级。钆塞酸二钠(Gd-EOB-DTPA)是一种肝胆特异性MRI对比剂,一方面能快速自肝内毛细血管网渗透至细胞外间隙,缩短组织的T1弛豫时间,通过动态增强扫描可反映病灶的供血方式;另一方面Gd-EOB-DTPA分子结构中EOB基团可与血浆蛋白结合,通过肝细胞膜上的有机阴离子转运蛋白,被正常肝细胞选择性吸收,在肝胆特异期成像中可评估肝细胞的功能[3]。因此,基于Gd-EOB-DTPA对HCC病灶进行MR增强扫描,能同时观察HCC病灶的血供方式及肝胆期HCC的信号差异,为推测HCC的分化程度提供可能。笔者回顾性分析不同分化程度HCC的Gd-EOB-DTPA对比增强MRI表现,旨在为术前判断HCC分化程度探索一种无创性的准确的检查手段。
材料与方法
回顾性分析2014年11月-2017年4月经本院手术病理证实且有术前Gd-EOB-DTPA增强MRI资料的HCC患者的病例资料。排除标准:①MR图像上有明显伪影或图像质量不佳;②患者已行射频消融或介入栓塞治疗。共计61例HCC患者纳入本项研究,其中男49例、女12例,年龄30~73岁,平均50.7岁。主要临床表现:无明显症状、因体检发现肝脏占位而就诊者9例;以上腹部隐痛、食欲不振和消瘦等症状就诊者52例;合并肝硬化30例(高、中和低分化组分别有)。实验室检查AFP阳性25例、阴性36例。
使用GE Signa 3.0T磁共振扫描仪和呼吸门控技术。扫描前患者空腹4~6 h,检查前对患者进行平静呼吸和屏气训练,患者取仰卧位,扫描序列和参数:双回波T1WI(TR 200 ms、TE 2.1/4.7 ms)、呼吸触发压脂FRFSE-T2WI(TR 6000 ms、TE 85 ms)、LAVA技术蒙片扫描及三期动态增强扫描(动脉期、门静脉期和平衡期的延迟时间分别为25、60及180 s,TR 3.8 ms、TE 1.8 ms),层厚5 mm,层间距2.5 mm,矩阵256×224,视野38 cm×38 cm。注入对比剂20 min后采用LAVA序列采集肝胆期图像。增强扫描采用经肘静脉注射对比剂Gd-EOB-DTPA,剂量0.1 mL/kg,注射流率1.0 mL/s,随后以相同流率注射20 mL生理盐水冲管。
根据手术病理结果将HCC患者分为3组:低分化组(中-低分化和低分化)、中分化组(中分化)、高分化组(高分化和高-中分化)。所有图像均传输至图像后处理工作站,由两位经验丰富的放射科医师独立判读MR图像,记录有无肝硬化、病变的位置、大小、有无假包膜。根据病灶的强化表现将其分为3型,Ⅰ型(动脉供血型):动脉期病灶明显强化,门静脉期及延迟期病灶强化消退;Ⅱ型(动-静脉供血型):动脉期病灶轻度强化,门静脉期持续强化,延迟期强化消退;Ⅲ型(乏血供型):动脉期及门静脉期均无明显强化或仅为轻度强化。如诊断有分歧经两人讨论达成一致意见。
图像指标测量:在MR平扫及增强肝胆特异期图像上,在肝实质的相同位置分别勾画大小相同的感兴趣区(region of Interest,ROI),直径10~20 mm,ROI尽量大但不能超出病灶范围,同时尽量避开坏死、出血及伪影干扰区域,测量指标包括病灶的信号强度(signal intensity of lesions,SILes)、正常肝实质的信号强度(SILiv)及右侧竖脊肌的信号强度(SI竖脊肌)。所有数据均取2位测量者的平均值。分别计算肿瘤的相对信号强度(relative SI,rSI)、强化率(enhancement ratio,ER)和相对强化率(relative enhancement ratio,rER),计算公式如下:

(1)

(2)
(3)
采用SPSS 13.0软件进行数据的统计学分析,计量数据以均数±标准差的形式表示。不同分化程度HCC患者ER和rER的比较采用Kruskal-Wallis秩和检验, 不同分化程度HCC病灶在肝胆特异期图像上的信号差异及其与增强扫描表现的相关性采用卡方检验。以P<0.05为差异有统计学意义。
结 果
61例HCC患者中,低分化组14例,中分化组26例,高分化组21例。合并肝硬化30例,其中低、中和高分化组分别有12、10和8例。肝胆特异期图像上,三组中病灶内可见高信号(图1~2)或病灶周边有等/稍低信号者(图3)分别为0、5(2+3)和8例(5+3),三组间此征象出现率的差异有统计学意义(P=0.025)。
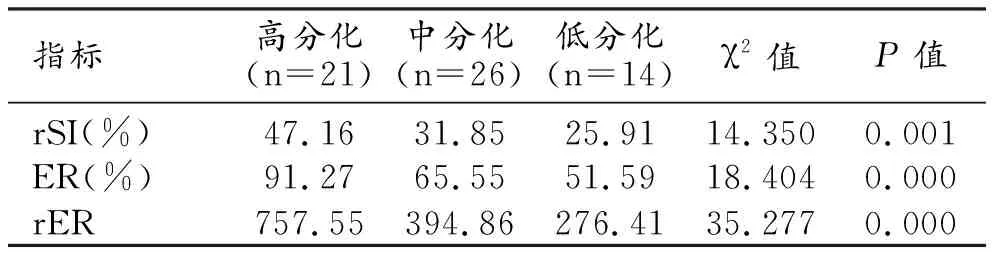
不同分化程度HCC在肝胆特异期图像上信号特征的定量分析数据见表1。随着分化程度的增高,HCC病灶的rSI、ER和rER值均逐渐增高,三组间的差异均有统计学意义(P<0.05)。

图1 男,52岁,高分化HCC患者。肝胆期图像上病灶内可见斑片状高信号影(箭)。 图2 男,55岁,高分化组患者。肝胆期图像上病灶内可见斑片状高信号影(箭)。 图3 男,59岁,中分化HCC患者。肝胆期图像上病灶周围可见环状等或稍低信号影(箭)。
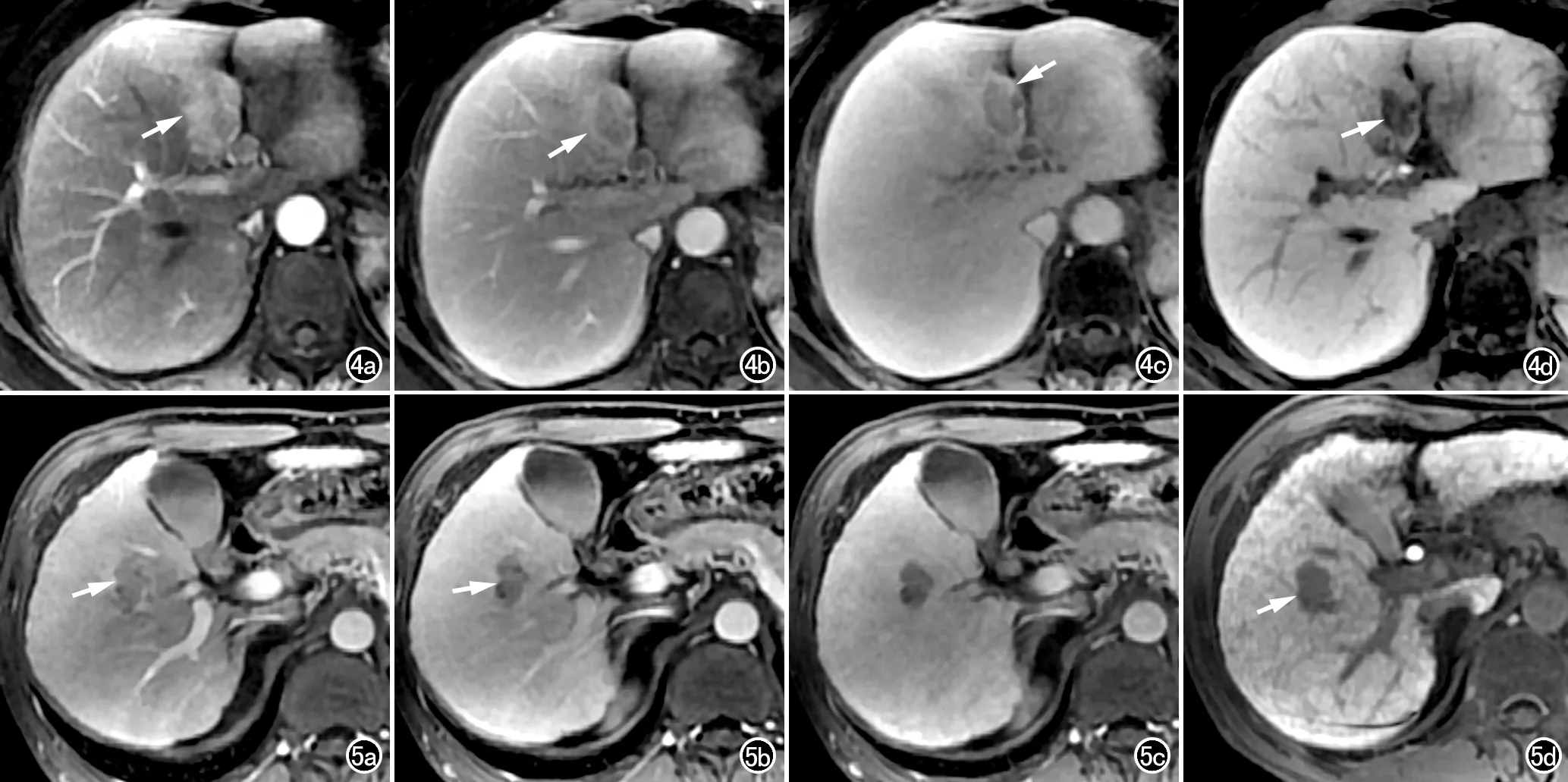
图4 女,62岁,低分化HCC患者。a) 动态增强扫描动脉期,显示肝左叶内侧段类圆形病灶有明显强化(箭); b) 门静脉期显示病灶强化消退,病灶边缘可见假包膜影(箭); c) 延迟期显示病灶强化进一步消退,假包膜仍有较明显强化(箭); d) 肝胆期图像,显示病灶内呈明显低信号(箭)。 图5 男,48岁,高分化HCC患者。a) 动态增强扫描动脉期,显示肝右叶前下段内不规则形病灶有轻度强化(箭); b) 门静脉期显示病灶强化消退(箭); c) 延迟期显示病灶强化进一步消退; d) 肝胆期图像,显示病灶内呈明显低信号(箭)。
指标高分化(n=21)中分化(n=26)低分化(n=14)χ2值P值rSI(%)47.1631.8525.9114.3500.001ER(%)91.2765.5551.5918.4040.000rER757.55394.86276.4135.2770.000
不同分化HCC病灶在DCE-MRI上的强化表现见表2。强化表现为动脉供血型(Ⅰ型)共36例,动-静脉供血型(Ⅱ型)17例,乏血供型(Ⅲ型)8例。低分化组中Ⅰ型表现(图4)的占比最高(79%),中分化和高分化组中Ⅱ型表现(图3)的占比相对高于低分化组。三组间动态增强扫描表现的差异无统计学意义(P=0.263)。
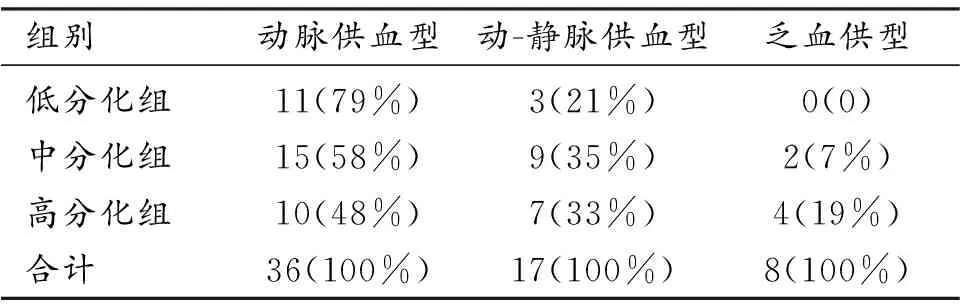
表2 不同分化程度HCC增强扫描强化类型 (例)
讨 论
HCC是临床常见的恶性肿瘤,其分化程度对治疗方式的选择及预后判断具有重要影响[4]。目前,对肝细胞肝癌分化程度的评估依赖于组织病理学检查,但容易受到采样误差及出血、感染等相关因素的限制,急需寻找一种能早期、无创性进行评估的方法。MRI具有较高的空间分辨率和软组织对比度,且无辐射损伤,已成为临床上肝脏检查最常用的方法之一。基于肝胆特异性对比剂Gd-EOB-DTPA,MRI既能通过动态增强扫描评估HCC病灶的供血方式,又能通过肝胆特异期病灶的信号改变来评估肝细胞的功能。
HCC的发生多与肝硬化有密切关系,其形成是一个连续、进展的过程,即由再生结节(regenerative nodule,RN)、异型增生结节(dysplastic nodule,DN)、DN癌变或早期HCC、小HCC而发展至进展期HCC[5]。进展过程中结节的血供方式会逐渐发生变化,从正常肝动脉及门静脉双重供血逐渐发展成以肿瘤动脉供血为主[6]。大量研究证实,低分化肿瘤较高分化肿瘤具有更为密集和粗大的肿瘤血管[7],而高分化肿瘤具有更丰富的肝内血窦[8]。上述病理生理学特点,共同决定了低分化肿瘤在动态增强扫描时多表现为“快进快出”的特点,而高分化肿瘤则早期强化不明显、强化持续时间更长[9]。本研究中我们发现,低分化组中呈Ⅰ型强化的HCC病灶占79%,明显高于中分化和高分化组(分别为58%和48%),提示低分化HCC病灶内动脉血管的密度更高。此外,中分化和高分化组中分别有12%和20%的病灶表现为Ⅲ型强化,低分化组中则未发现有此种强化方式,这主要是因为中高分化HCC病灶中正常肝动脉和门静脉的血供逐渐减少,且新生肿瘤血管不及低分化肿瘤内丰富所致。但本研究中三组间动态增强扫描表现无统计学差异,可能与样本量不同有关。
由于Gd-EOB-DTPA分子内具有亲脂基团EOB,因此,功能正常的肝细胞在其首过肝脏时即持续对其进行摄取[10],使得正常肝脏组织的T1弛豫时间缩短,在T1WI上呈现高信号;相反,肝癌细胞由于转运肽的表达水平降低,不能特异性地摄取Gd-EOB-DTPA,导致其在T1WI上信号强度不增高,与正常肝细胞形成鲜明对比[11-12]。本研究中得到了类似的结果,随着分化程度的增高,HCC病灶的rSI、ER和rER值均逐渐增高,各参数在不同分化组间的差异均有统计学意义(P<0.05)。而且,在肝胆特异期图像上部分病灶(7/61)内可直接观察到片絮状高信号影,此表现在本研究中的出现率与文献报道的比例(5%~10%)类似[13],且仅见于中、高分化组中,低分化组中未见此征象。中、高分化组中部分病例(5/22)在肿瘤周边可以观察到等或稍低信号,而低分化组中病灶呈明显低信号,与肝实质分界清楚,提示分化程度高的肿瘤细胞可能仍保留了一部分肝细胞的功能[14]。也有学者认为不同分化程度HCC病灶在肝胆特异期强化率的差异与肿瘤细胞膜上OATP8的表达水平有关[15]。此外,由于Gd-EOB-DTPA可经胆道系统排泄,而高分化HCC中仍存留了一部分小胆管结构,推测肝胆特异期中肿瘤内高信号与小胆管内存留的对比剂有关。
既往已有研究已经证实HCC的强化特点与肿瘤分化程度之间具有相关性,肝胆特异性对比剂Gd-EOB-DTPA的临床应用,进一步提高了MRI对HCC诊断的敏感度及阴性预测值。根据本组研究结果并结合其它文献[16],我们认为在Gd-EOB-DTPA增强扫描肝胆特异期图像上病灶内可见高信号影结合常规动三期增强扫描无典型的“快进快出”表现,可以提示HCC的分化程度较高。因此,Gd-EOB-DTPA增强扫描将为HCC治疗方式的选择及其预后判断提供一种完全无创的方法。