Ku70对HTLV-1阳性T细胞中HTLV-1病毒蛋白表达的影响*
2018-12-28马玲玲郭志祥崔钰晗关宇鹤
宋 迪, 马玲玲, 郭志祥, 刘 月, 崔钰晗, 关宇鹤, 杨 波, 王 洁
(新乡医学院河南省免疫与靶向药物重点实验室, 医学检验学院科研创新班, 河南省分子诊断与医学检验技术协同创新中心, 河南 新乡 453003)
人嗜T淋巴细胞病毒1(human T-lymphotrophic virus 1,HTLV-1)是一种与人类疾病相关的逆转录病毒,由其感染引发的成人T细胞白血病(adult T-cell leukemia,ATL)和HTLV-1相关性脊髓病/热带痉挛性轻截瘫(HTLV-1-associated myelopathy/tropical spastic paraparesis,HAM/TSP)目前还没有有效的治疗手段[1]。HTLV-1在人体内潜伏期很长,可达20年以上,约有5%的携带者可发展成ATL患者。ATL是一种CD4+T淋巴细胞恶性增殖性肿瘤,急性ATL患者的平均存活期一般不超过 1 年,然而目前对于该病毒如何逃逸宿主的免疫监视并引发疾病的病理机制还所知甚少[2-3]。研究表明,在固有免疫细胞中,Ku70可由HTLV-1感染诱导表达,Ku70可识别HTLV-1的反转中间体并通过激活固有免疫应答反应来抑制HTLV-1的复制[4]。值得注意的是,HTLV-1主要感染的是T淋巴细胞,而Ku70在T淋巴细胞中的功能并不清楚。本研究通过在HTLV-1阳性的T淋巴细胞系中沉默Ku70的表达,观察细胞中HTLV-1病毒蛋白表达及干扰素(interferon, IFN)和促炎因子的产生情况。
材 料 和 方 法
1 细胞培养
Jurkat、MT2、 MT4及C8166细胞均使用RPMI-1640培养液,含10%的胎牛血清、4 mmol/L的L-谷氨酰胺、1×105U/L的青霉素及100 mg/L的链霉素,在37 ℃的细胞培养箱中通入5%的CO2悬浮培养。
2 主要试剂
抗β-actin抗体购自Proteintech,货号为60008-1;抗HTLV-1病毒蛋白Tax抗体购自Santa Cruz Biotechnology,货号为sc-57872;抗Ku70和抗HTLV-1病毒蛋白p19抗体购自Abcam,货号分别为ab83501和ab9080;HRP标记的山羊抗兔 II 抗和HRP标记的山羊抗小鼠 II 抗均购自Proteintech,货号分别为SA00001-2和SA00001-1;转染试剂Lipofectamine 2000 购自Invitrogen;细胞培养液和胎牛血清均购自Gibco;其它常用生化试剂均为进口分装。所用引物由金唯智生物科技有限公司根据设计合成,见表1。
3 主要方法
3.1RNA干扰 靶向Ku70的siRNA(siRNA-Ku70, SK)购自Invitrogen,正义链的序列为5’-GACAUAUCCUUGUUCUACATT-3’,反义链的序列为5’-UGUAGAACAAGGAUAUGUCAA-3’; 阴性对照siRNA(siRNA-control, SC)同样购自Invitrogen,货号为No. 4390843。SK和SC均采用Lipofectamine 2000分别转染入MT2细胞和MT4细胞中:将5×105的MT2细胞和MT4细胞铺于无血清无双抗的Opti-MEM培养液中,转染入2 μg的SK和SC,6 h后补充新鲜含10%胎牛血清的RPMI-1640培养液,24 h后收获细胞进行real-time PCR和Western blot检测。

表1 引物序列
3.2Real-time PCR 细胞中总RNA的抽提使用Invitrogen的TRIzol试剂,并严格按照配套的操作手册进行。基因转录本的扩增使用Applied Biosystems的7500 Fast Real-Time PCR System, PCR程序为: 95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 40个循环; 72 ℃ 5 min。基因相对表达量采用2-ΔΔCt法计算。
3.3Western blot实验 收集细胞后,提取各组细胞总蛋白,BCA法测定蛋白浓度,行SDS-PAGE,电泳后转膜将蛋白样品转移到硝酸纤维素膜上。转膜结束后用TBST洗膜1次,用5%脱脂奶粉封闭膜1 h,用TBST洗膜1次,将稀释后的I抗与膜室温杂交2 h或4 ℃过夜。用TBST洗涤3次后将稀释后的II抗与膜室温杂交1 h,用TBST洗涤后加入底物显色,曝光。
4 统计学处理
采用SPSS 19.0软件进行统计学分析,实验结果用3次独立实验的均数±标准差(mean±SD)表示,用独立样品t检验比较两组间的差异,以P<0.05为差异有统计学意义。
结 果
1 HTLV-1阳性T细胞中Ku70表达上升
HTLV-1阳性T细胞系(C8166、MT2及MT4)和HTLV-1阴性T细胞系Jurkat计取相同的细胞数,裂解后进行Western blot检测,结果显示,与HTLV-1阴性T细胞系Jurkat相比,HTLV-1阳性T细胞系不管是C8166、MT2还是MT4,Ku70蛋白的表达均明显上调(P<0.05或P<0.01),见图1。
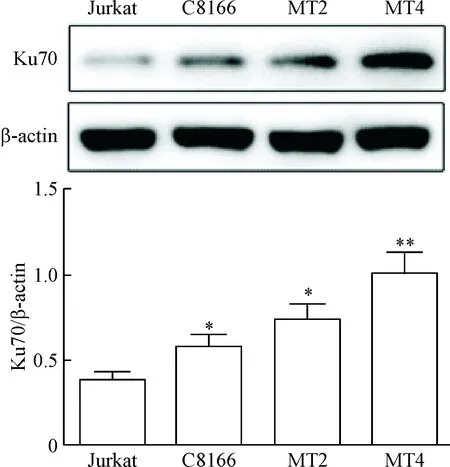
Figure 1.The expression of Ku70 in HTLV-1 positive T cells. Mean±SD. n=3. *P<0.05, **P<0.01 vs Jurkat.
2 针对Ku70的siRNA可以有效抑制Ku70的表达
Western blot检测发现,SK可明显抑制MT2细胞中Ku70的表达(P<0.05),见图2。
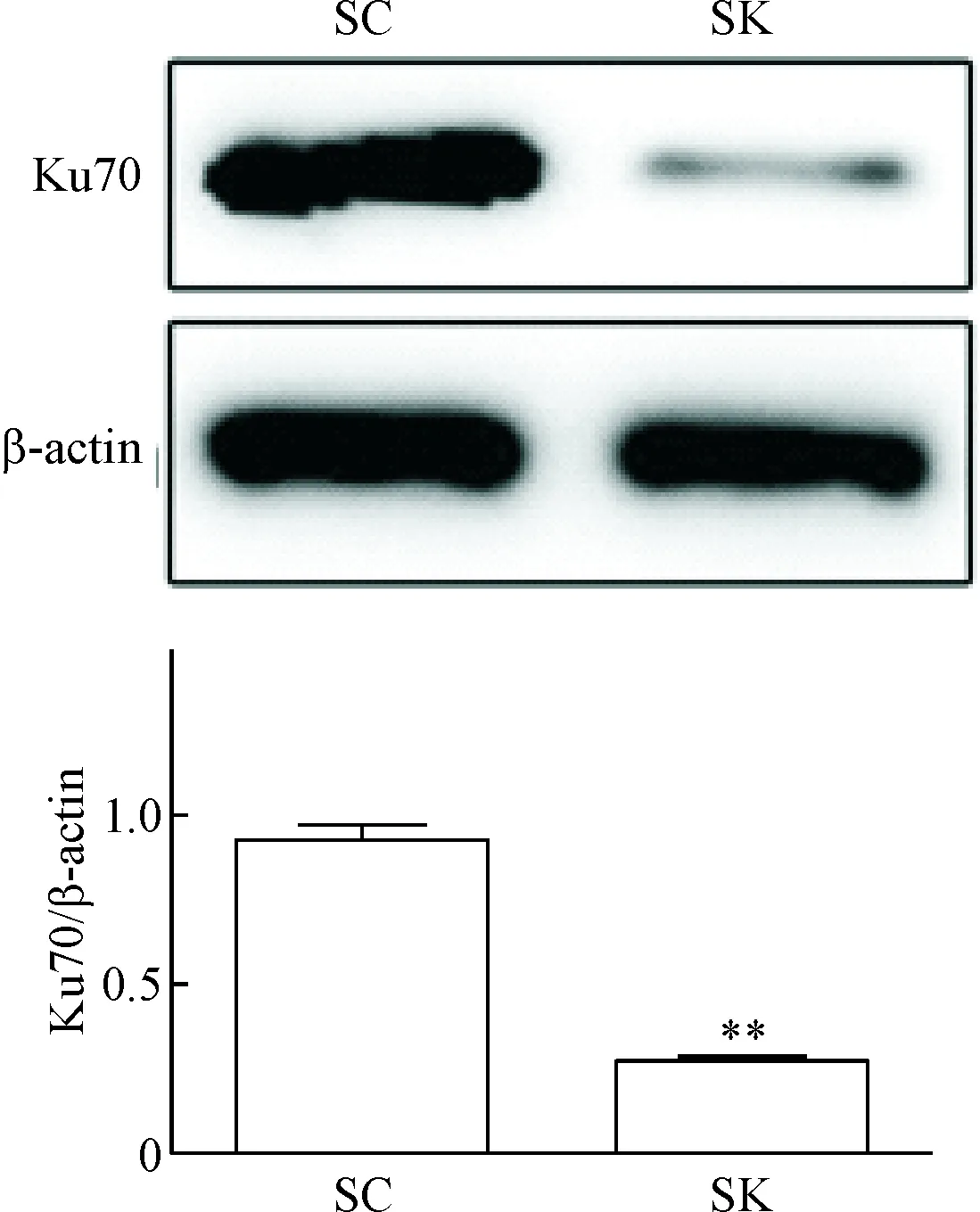
Figure 2.The effect of Ku70-specific siRNA on Ku70 expression in MT2 cells. SC: control siRNA; SK: Ku70-specific siRNA. Mean±SD. n=3. **P<0.01 vs SC group.
3 MT2细胞中基因沉默Ku70后HTLV-1相关蛋白的表达升高
在MT2细胞中,与对照组(转染SC组)相比,沉默Ku70组(转染SK组)HTLV-1相关蛋白Tax、p19和Env的mRNA和蛋白水平均明显升高(P<0.01),见图3、4。

Figure 3.The effect of Ku70 knockdown on HTLV-1-related protein expression at mRNA levels in the MT2 cells. Mean±SD. n=3. **P<0.01 vs SC group.
4 MT4细胞中基因沉默Ku70后HTLV-1相关蛋白的表达升高
在MT4细胞中,与对照组(转染SC组)相比,沉默Ku70组(转染SK组)HTLV-1相关蛋白在mRNA和蛋白水平上的表达均明显升高(P<0.01),见图5、6。
5 MT2细胞中基因沉默Ku70后抗病毒细胞因子表达降低
在MT2细胞中,与对照组(转染SC组)相比,沉默Ku70组(转染SK组)中抗病毒感染细胞因子IFN-α、IFN-γ及TNF-α的量明显降低(P<0.01),见图7。
6 MT4细胞中基因沉默Ku70后抗病毒细胞因子表达降低
在MT4细胞中,与对照组(转染SC组)相比,沉默Ku70组(转染SK组)中抗病毒感染细胞因子IFN-α、IFN-γ及TNF-α的量明显降低(P<0.01),见图8。
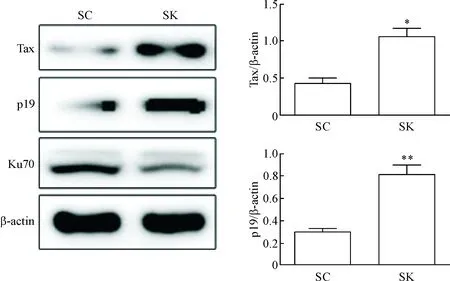
Figure 4.The effect of Ku70 knockdown on HTLV-1-related protein expression in the MT2 cells. Mean±SD. n=3. *P<0.05, **P<0.01 vs SC group.
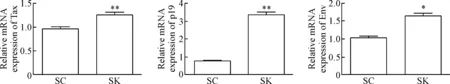
Figure 5.The effect of Ku70 knockdown on HTLV-1-related protein expression at mRNA levels in the MT4 cells. Mean±SD. n=3. *P<0.05, **P<0.01 vs SC group.
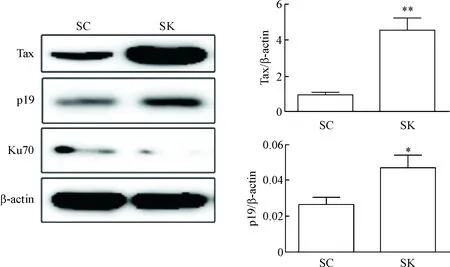
Figure 6.The effect of Ku70 knockdown on HTLV-1-related protein expression at protein levels in MT4 cells. Mean±SD. n=3. *P<0.05, **P<0.01 vs SC group.
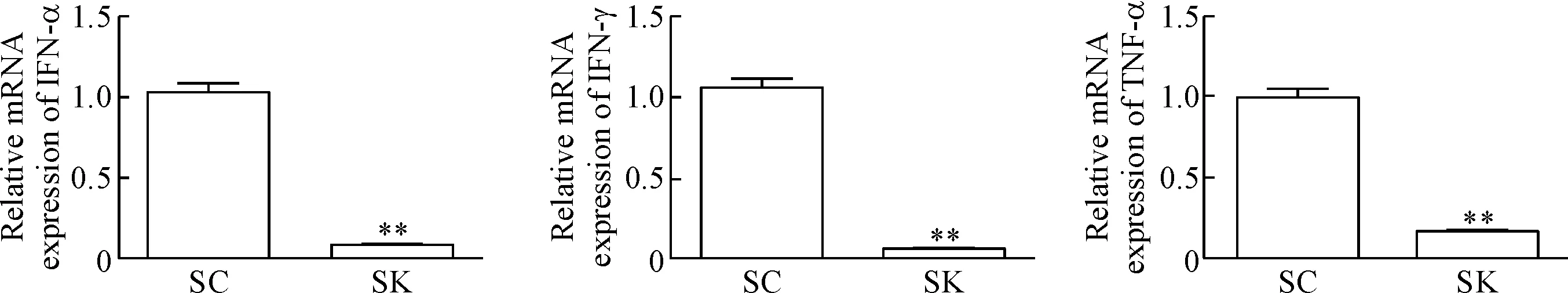
Figure 7.The effect of Ku70 knockdown on anti-viral responses in MT2 cells. Mean±SD. n=3. **P<0.01 vs SC group.

Figure 8.The effect of Ku70 knockdown on anti-viral responses in the MT4 cells. Mean±SD. n=3. **P<0.01 vs SC group.
讨 论
1 Ku70在HTLV-1复制中的功能
Ku70在进化上相对保守,在真核生物中普遍存在。Ku70可与Ku80以及催化亚基DNA-PKcs形成复合物DNA-PK,在双链DNA缺口修复中发挥重要功能[5-6]。值得注意的是,细胞内Ku70的表达量比DNA-PKcs高很多[7],提示Ku70很可能还具有其它的功能。在逆转录病毒感染过程中,Ku70的功能存在争议。有报道称Ku70可以与HIV-1的整合酶结合并保护其不受降解,从而有利于HIV-1的复制[8];然而也有研究者发现Ku复合物抑制HIV-1的转录表达[9]。而我们之前的研究表明Ku70可识别HTLV-1的反转中间体,通过激活抗病毒固有免疫应答反应来抑制HTLV-1的复制[4]。这些报道提示我们在逆转录病毒感染过程中,Ku70的角色复杂,可能跟病毒类型、细胞类型以及感染阶段等多种因素相关,需要在不同病毒不同细胞中具体研究。
我们首先确认了Ku70在HTLV-1阳性T细胞中的表达水平,结果发现在MT2、MT4以及C8166等多种HTLV-1阳性T细胞系中Ku70均有表达,且表达水平高于HTLV-1阴性T细胞系Jurkat,这提示我们Ku70与HTLV-1感染具有一定的相关性。那么在HTLV-1感染的T细胞中,这种上调的Ku70的表达究竟具有什么功能呢?据此本研究采用RNA干扰技术在HTLV-1阳性T细胞中基因沉默Ku70,研究在HTLV-1阳性T细胞中的功能。为了排除细胞特异性的影响,我们在MT2和MT4这两种不同的HTLV-1阳性T细胞系中研究了Ku70的功能。利用siRNA沉默Ku70后,我们发现不管是在MT2还是MT4细胞中,不管是在蛋白水平还是在mRNA水平, HTLV-1病毒蛋白的表达都有明显提高,提示我们Ku70可能具有抑制HTLV-1病毒复制的功能。
2 Ku70与抗病毒细胞因子的表达
病毒感染宿主细胞后,可激活一系列的抗病毒免疫应答反应,包括干扰素和促炎因子等多种细胞因子的表达,这些细胞因子的表达在适应性免疫应答反应中具有重要作用,有利于机体对抗病毒感染,并达到清除病毒的目的[10-11]。关于Ku70在T细胞中的角色,之前的报道多是从DNA修复的角度研究,那么在HTLV-1阳性T细胞中,Ku70是否有其它作用机制呢?HTLV-1阳性T细胞源自Th细胞,与Th细胞,尤其是Th1细胞具有相似的细胞因子表达谱,如TNF-α以及IFN-γ等[12]。另外,在HTLV-1阳性T细胞中,IFN-α也是表达的[13]。有研究显示,在固有免疫应答反应中,Ku70可以作为DNA识别受体来激活干扰素和促炎因子的表达[14-15],但是在T细胞中,Ku70对细胞因子的表达是否有调控作用,目前并不清楚。
据此本研究关注了Ku70对HTLV-1阳性T细胞中细胞因子的表达的影响。我们采用RNA干扰技术在MT2细胞和MT4细胞中沉默Ku70的表达,检测相关细胞因子的表达。我们发现在MT2细胞和MT4细胞中IFN-α和TNF-α均有高表达,而沉默Ku70后,这些细胞因子的表达均有明显的降低,提示我们Ku70可能具有促进IFN-α和TNF-α等细胞因子表达的功能。值得注意的是,沉默Ku70后,主要由T细胞分泌产生的细胞因子IFN-γ也有明显降低,而以前并没有关于Ku70对IFN-γ表达调控的报道。在 HTLV-1 阳性 T 细胞中, Ku70 本身是通过什么机制上调的,又是如何调控这些细胞因子的表达的,目前还不清楚,值得进一步深入研究。另外,HTLV-1病毒在人体内可长期稳定存在,说明HTLV-1病毒已建立起一套逃逸免疫监视的机制,在HTLV-1阳性T细胞中,病毒如何逃逸Ku70的抗病毒作用,是又一值得关注的问题。
综上所述,本研究利用RNA干扰技术在HTLV-1阳性T细胞中沉默Ku70的表达,揭示沉默Ku70促进了HTLV-1病毒蛋白的表达且抑制了IFN-α、IFN-γ及TNF-α的产生,提示Ku70在HTLV-1阳性T细胞系中可能具有通过促进抗病毒细胞因子表达来调控HTLV-1复制的功能。
