幼龄与成年沙鼠短暂性脑缺血再灌注后海马8-羟基脱氧鸟苷含量的比较
2018-12-27颜丙春
郁 省, 王 杰, 颜丙春
(1. 江苏省扬州市妇幼保健院, 江苏 扬州, 225002; 2. 扬州大学医学院, 江苏 扬州, 225001)
脑卒中具有高发病率、高死亡率和高致残率等特点,严重危害人类的健康[1-3]。氧化应激在脑缺血损伤中发挥着重要的作用[4]。8-羟基脱氧鸟苷(8-OHdG)是DNA氧化损伤的标志物,它能触发多种细胞内信号传导通路,导致神经细胞的损伤及凋亡[5-7]。近年来,儿童缺血性脑卒中的发病比例也逐年上升,已成为儿童期重要的致残性疾病之一[8]。研究[9-10]表明幼龄沙鼠具有抗脑缺血的能力。本研究通过短暂性双侧颈总动脉夹闭、再灌注模型,观察短暂性脑缺血再灌注后不同时间点幼龄沙鼠海马CA1与DG区8-OHdG免疫活性的变化,现将结果报告如下。
1 材料与方法
1.1 实验动物
选取清洁级雄性蒙古沙土鼠,幼年鼠体质量25~30 g, 1月龄; 成年鼠体质量65~75 g, 6月龄,由韩国江原大学实验动物中心提供。所有动物适应环境1周后开始实验,模型建立过程中尽可能减少动物的痛苦和动物使用的数量,整个实验程序都符合当前国际动物实验使用指南标准。
1.2 实验仪器与试剂
冰冻切片机CM1950(莱卡,德国); 异氟烷(瑞沃德,中国); 小动物麻醉机(Midmark, 美国); 电子显微镜(尼康,日本); 甲酚紫(Sigma); 8-OHdG抗体(Abcam公司); Fluoro-Jade B (Histochem, Jefferson, AR); ELISA试剂盒(科能生物技术有限公司)。
1.3 方法
1.3.1 实验分组、短暂性脑缺血模型的制备: 以清洁级蒙古沙土鼠短暂性双侧颈总动脉夹闭、再灌注模型(夹闭时间为5 min)制作缺血后再灌注模型(模型制备方法参考文献[10])。实验设有幼年组(1个月龄沙鼠,n=60)和成年组(6个月龄沙鼠,n=60), 幼年组和成年组又随机分为假手术组(n=30)和手术组(n=30)。缺血再灌注手术后,实验动物按照术后6 h、1 d、7 d依次处死,每次处死10只; 一部分沙鼠经10%水合氯醛麻醉后进行心脏灌流并固定,脑取出后利用低温恒温组织切片机连续切取厚度为30 μm的脑组织并将其储存在PBS溶液中备用; 另外一部分沙鼠经10%水合氯醛麻醉后断头取脑,将分离的海马置于EP管内,存放于-80 ℃备用。
1.3.2 组织处理及染色: ① 甲酚紫染色: 选出备好的脑组织切片(海马部分)并将其贴附在用明胶处理过的玻片上,然后按照甲酚紫的步骤进行染色,最后脱水并用松脂溶液盖玻(具体参考文献[11])。② Fluoro-Jade B(F-JB)组织荧光染色: 首先,将选好的脑组织切片放入高锰酸钾溶液中处理20 min,再放入0.000 4% Fluoro-Jade B的溶液中染色30 min, 最后干燥后利用显微镜照相。注意全过程要进行避光处理。③ 免疫组化染色: 将选好的脑组织切片在0.3%过氧化氢溶液处理30 min,然后分别在goat anti-8-OHdG(1︰500)的溶液中培养过夜; 再将组织切片进行二抗及ABC处理,通过DAB进行显色。将组织贴片、脱水后,用加拿大香脂胶盖片。为了确认染色的特异性,对照染色用免疫血清来代替一抗,其他步骤一致。④ 脑组织8-OHdG含量测定: 将-80 ℃中的脑组织取出,分别加入1 mL PBS液充分匀浆; 3 000转/min离心20 min, 收集上清液。采用双抗体夹心法[酶联免疫吸附试验(ELISA)], 在小鼠8-OHdG抗体包被的微孔板中加入含8-OHdG的标准品和样品,与辣根过氧化物酶(HRP)标记的8-OHdG抗体结合形成抗体-抗原-酶标抗体复合物,彻底洗涤后甲基联苯胺(TMB)显色,用酶标仪在450 nm波长下测量各孔吸光度(A)。结果以标准品浓度为横坐标, A为纵坐标绘制标准曲线。根据样品A由标准曲线查得相应浓度,再乘以稀释倍数即为样品的实际浓度。
1.4 成像和统计学分析

2 结 果
2.1 缺血再灌注后沙鼠海马CA1区神经元的死亡情况
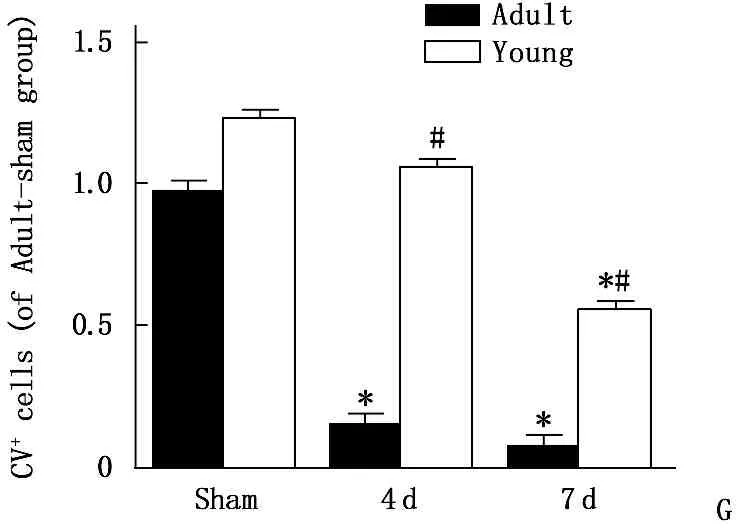
幼年沙鼠具有抗脑缺血损伤的能力。甲酚紫染色用于标记脑组织中的尼氏小体, F-JB染色主要用于标记死亡的神经元。结果显示,成年沙鼠CA1区迟发性神经元的死亡主要发生于缺血再灌注4 d。幼龄沙鼠CA1区迟发性神经元的死亡主要发生于缺血再灌注7 d, 且死亡的神经元较成年沙鼠少。见图1、2。

A、B、C: 甲酚紫染色,分别显示成年沙鼠对照组、缺血再灌注4 d、缺血再灌注7 d 海马CA1区尼氏小体(200倍);D、E、F: 甲酚紫染色,分别显示幼龄沙鼠对照组、缺血再灌注4 d、缺血再灌注7 d 海马CA1区尼氏小体(200倍);A1、B1、C1: F-JB染色,分别显示成年沙鼠对照组、缺血再灌注4 d、缺血再灌注7 d 海马CA1区死亡的神经元(200倍);D1、E1、F1: F-JB染色,分别显示幼龄沙鼠对照组、缺血再灌注4 d、缺血再灌注7 d海马CA1区死亡的神经元(200倍)图1 成年与幼龄沙鼠缺血再灌注后海马CA1区甲酚紫染色及F-JB染色的免疫组织化学法结果比较
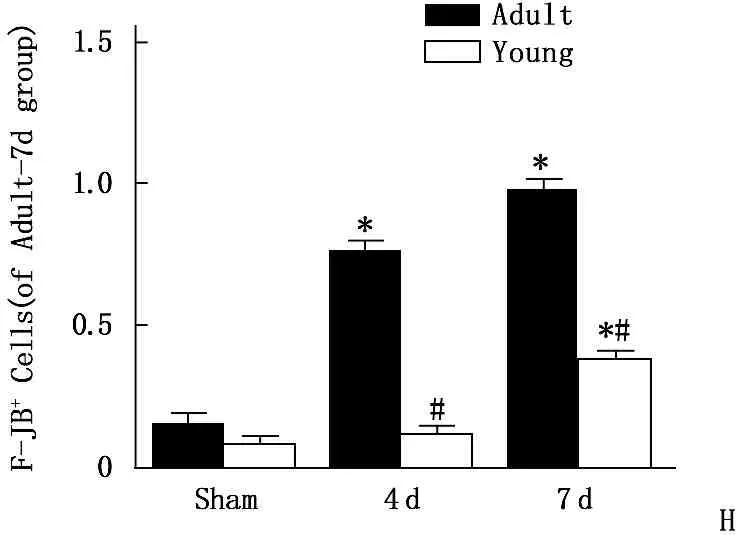
G: 甲酚紫染色柱状图; H: F-JB染色柱状图。与Sham组比较, *P<0.05; 与成年组比较, #P<0.05。
图2成年与幼龄沙鼠缺血再灌注后海马CA1区甲酚紫染色及F-JB染色表达比较(n=5)
2.2 缺血再灌注后沙鼠海马CA1及DG区8-OHdG免疫活化的情况
结果显示,成年沙鼠海马CA1及DG区8-OHdG免疫活性于缺血再灌注后6 h增至最高,之后逐渐下降。幼龄沙鼠海马CA1及DG区的8-OHdG免疫活性变化趋势与成年沙鼠相同,但整体水平较成年沙鼠低,且变化差异不明显。见图3、4、5、6。
2.3 缺血再灌注后沙鼠海马8-OHdG含量的变化
成年沙鼠海马8-OHdG的含量于缺血再灌注后6 h升至最高,随后逐渐下降,于第7天时恢复至正常水平。另外,幼龄沙鼠缺血损伤后海马8-OHdG的含量变化趋势与成年沙鼠相同,但整体水平明显较成年沙鼠低。见图7。
3 讨 论
本课题组前期研究[11-12]表明,幼龄沙鼠海马CA1区约60%的神经元在缺血再灌注7 d后死亡。本研究再次确认缺血再灌注损伤后神经元死亡情况,结果与既往研究一致,并进一步阐明脑缺血再灌注后幼龄沙鼠DNA损伤标记物8-OHdG免疫活性的变化。


A、B、C、D: 8-OHdG染色,分别显示成年沙鼠对照组、缺血再灌注6 h、缺血再灌注4 d、缺血再灌注7 d 海马CA1区8-OHdG免疫活性(200倍); E、F、G、H: 8-OHdG染色,分别显示幼龄沙鼠对照组、缺血再灌注6 h、缺血再灌注4 d、缺血再灌注7 d 海马CA1区8-OHdG免疫活性(200倍)图3 成年与幼龄沙鼠缺血再灌注后海马CA1区8-OHdG表达的免疫组织化学结果(n=5)
在脑缺血再灌注损伤发生发展过程中,有众多病理机制参与其中,如兴奋性氨基酸的过度释放、体内离子水平失衡、能量耗竭、炎症反应、氧化应激和细胞凋亡,这些因素相互作用,最终导致脑组织的不可逆损害[13-15]。氧化应激在脑缺血的病理生理机制中起着至关重要的作用。脑缺血再灌注后可以激活多途径而产生大量自由基。脑内形成的自由基会直接攻击细胞、脂质、蛋白、DNA、核苷酸或碱基,进而导致氧化损伤[16]。研究[17]表明与脂质及蛋白的氧化相比,缺血再灌注诱导产生的DNA损伤标记物通过调节多种细胞内信号转导通路直接损伤神经元DNA片段,进而导致神经元的凋亡或功能缺失。
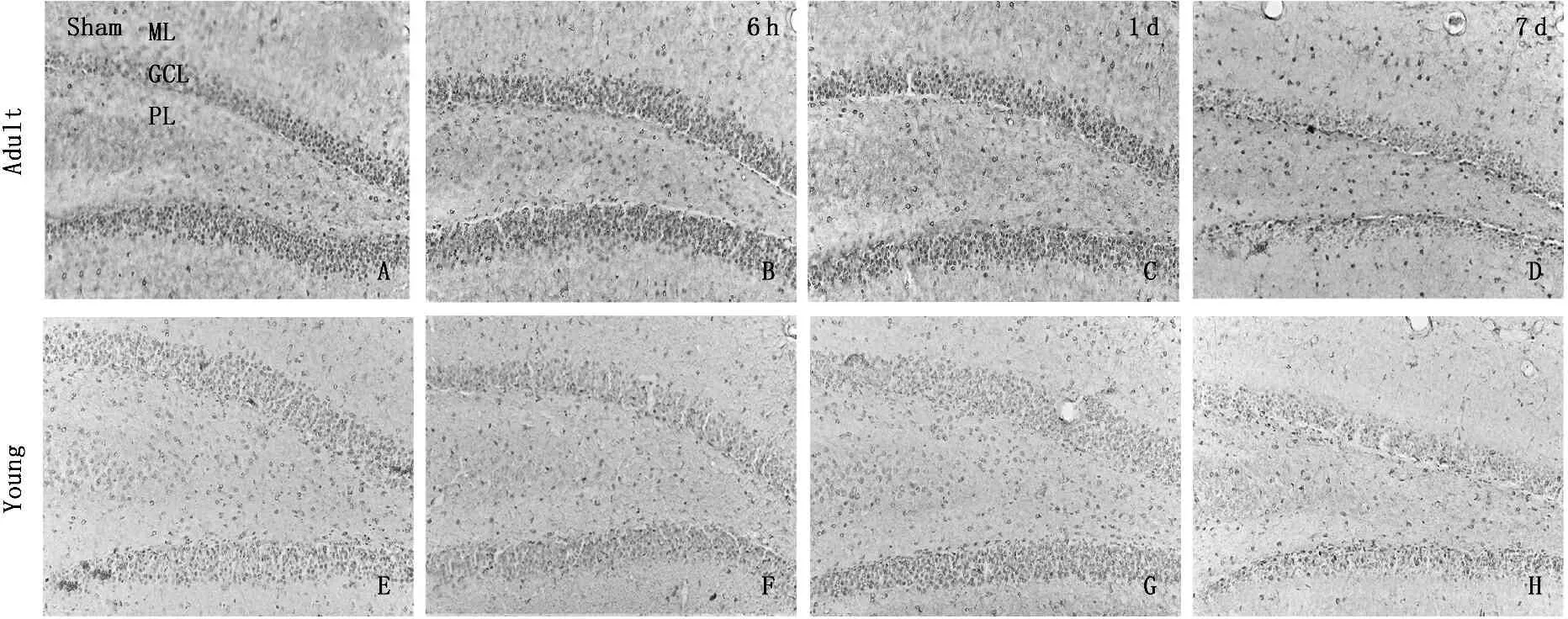
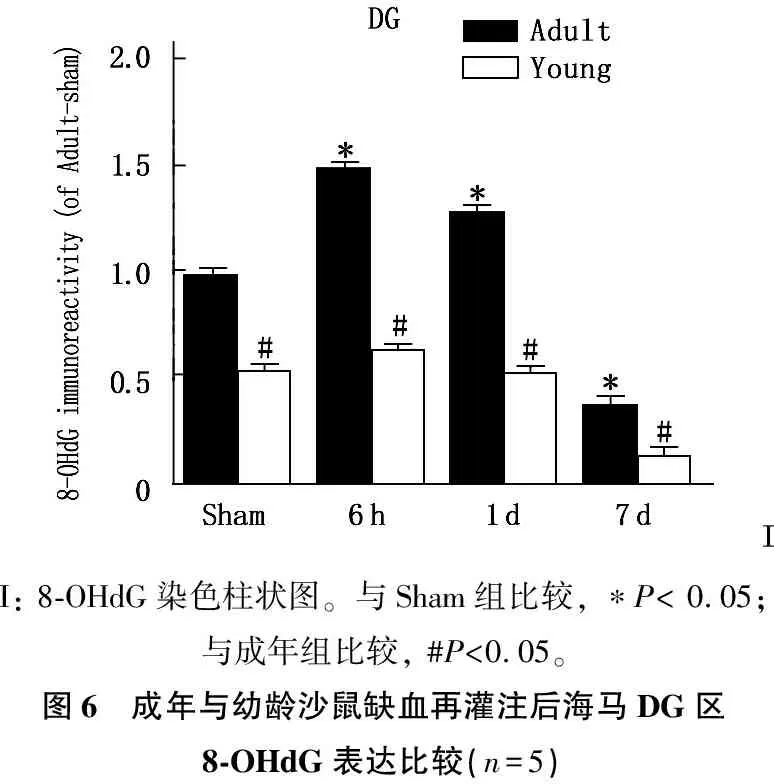
A、B、C、D: 8-OHdG染色,分别显示成年沙鼠对照组、缺血再灌注6 h、缺血再灌注4 d、缺血再灌注7 d海马DG区8-OHdG免疫活性(200倍, ML表示分子层, GCL表示颗粒细胞层,PL表示锥体细胞层); E、F、G、H: 8-OHdG染色,分别显示幼年沙鼠对照组、缺血再灌注6 h、缺血再灌注4 d、缺血再灌注7 d海马DG区8-OHdG免疫活性(200倍)图5 成年与幼龄沙鼠缺血再灌注后海马DG区8-OHdG表达的免疫组织化学结果(n=5)

与Sham组比较, ∗P< 0.05; 与成年组比较, #P<0.05图7 成年与幼龄沙鼠缺血再灌注后海马中8-OHdG的含量比较(n=5)
海马CA1区是缺血性脑卒中时最易损伤的区域,迟发性神经细胞死亡也往往发生于此。实验结果表明,成年沙鼠海马CA1区域 8-OHdG免疫活性在缺血后6 h和1 d时较前升高且成年沙鼠8-OHdG整体水平较幼龄沙鼠高。沙鼠海马CA1区8-OHdG的活性表达与神经细胞的损伤呈正相关,幼龄沙鼠低水平的8-OHdG会改善脑损伤区域神经细胞的死亡。研究[18-19]证实成年哺乳动物大脑中的海马齿状回颗粒下层(SGZ)是内源性神经干细胞再生的主要区域之一。脑缺血损伤可以引起SGZ区的内源性神经干细胞代偿性增殖,进而迁移至脑损伤周边区域以维持脑的功能。本研究中幼龄沙鼠海马DG区8-OHdG低表达状态,预示幼年沙鼠不仅具有抵抗脑缺血损伤的能力,而且在脑卒中后将有较好的预后。
综上所述,本研究表明脑缺血再灌注后幼年沙鼠海马CA1和DG区相对低表达状态与其抗脑缺血有着密切的联系。
