壳聚糖包覆纳米铁镍双金属的迁移性能及其降解地下水中三氯乙烯的研究
2018-12-27周轩亦陈家玮
周轩亦,李 哲,陈家玮
(1.中国地质大学(北京) 生物地质与环境地质国家重点实验室,北京 100083;2.中国地质大学(北京) 地球科学与资源学院,北京 100083)
0 引 言
工业化和城市化发展带来的地下水污染问题日益严重,对人体健康和生态环境有较大危害。地下水中的污染物种类多、面积广、危害大,主要包括氯代有机化合物、三氮、硝基芳香化合物、铬、砷等[1]。其中,三氯乙烯(Trichloroethylene, TCE)是常见的氯代有机污染物。在我国地下水调查中发现TCE污染是不容忽视的[2]。TCE是一种重非水相液体,具有强毒性和潜在致癌性,且降解困难,生成的中间产物二氯乙烯(Dichloroethylene, DCE)和氯乙烯(Vinyl Chloride, VC)也是毒性物质。处理地下水中TCE的方法有异位修复法和原位修复法,异位修复法是将污染地下水抽出后再处理,原位修复法可以通过原位微生物、可渗透反应格栅以及纳米铁原位注射技术等来实现[3-5]。
近10年新发展的纳米零价铁原位注射技术可以有效去除地下水中的TCE[6]。但是,在实际应用中,纳米零价铁存在易团聚、迁移性差、易氧化失活等问题,学者们通过不同手段对纳米零价铁进行改性,如纳米铁双金属、负载型纳米零价铁、包覆型纳米零价铁等,来提高其分散稳定性并延长或增加其反应活性[7]。
纳米铁双金属是利用还原沉积作用使得另外一种金属分散在纳米零价铁的表面,如Fe/Pd、Fe/Cu、Fe/Ag和Fe/Ni等[8-10],这些过渡金属掺杂在零价铁的表面可以充当催化剂增强反应活性。负载型纳米零价铁是将纳米铁负载于膨润土、活性炭、石墨烯、沸石、浮石等载体上[11-15],能够提高其分散稳定性,从而增强反应活性,但对迁移性改善不大。包覆型纳米零价铁能有效改变零价铁表面电荷,增加静电斥力;减少团聚沉降增强迁移性;同时还可以减少纳米零价铁与环境中氧或水的接触,防止其过快氧化失活。包覆剂多采用可降解材料如羧甲基纤维素、聚丙烯酸、壳聚糖、淀粉等[16-20]。壳聚糖是一种使用范围较广的天然有机高分子材料,可以自然分解,有研究表明壳聚糖包覆纳米铁钯双金属对三氯苯污染物降解效果较好[21]。Kustov等尝试用3种改性的壳聚糖包覆纳米铁钯双金属降解四氯乙烯(PCE),在180 min内成功降解了0.05 mmol的PCE[22]。
在前期研究中,本课题组采用比钯更经济的镍以及负载物膨润土,合成的膨润土负载纳米铁镍双金属(B-Fe/Ni)[23],实现了对水中TCE的高效降解,B-Fe/Ni降解TCE的速率比普通纳米零价铁提高了近40倍[14]。为了进一步提高纳米铁的迁移性,本文通过液相还原法制备壳聚糖包覆的纳米铁镍双金属(CS-Fe-Ni),将壳聚糖作为包覆剂增加纳米零价铁的分散稳定性和迁移性,将镍作为催化剂增强反应活性。探究CS-Fe-Ni对典型污染物TCE的修复效果,系统研究CS-Fe-Ni的颗粒团聚性以及迁移性能。相关结果能为纳米铁原位注射技术的实际应用提供重要的理论和实验依据。
1 实验与方法
1.1 材料与试剂
实验研究中用到如下试剂材料:所有试剂除三氯乙烯(C2HCl3,Alladin公司)和六水合硫酸镍(NiSO4·6H2O,北京化工厂)外,七水合硫酸亚铁(FeSO4·7H2O)、硼氢化钠(NaBH4),碳酸氢钠(NaHCO3)、氢氧化钠(NaOH)、壳聚糖(高黏度>400 mPa·s,脱乙酰度为95%)、石英砂(0.25~0.35目)均购买于国药集团化学试剂有限公司,若无特别说明,试剂级别均为分析纯。
1.2 样品CS-Fe-Ni的制备与表征
加入0.1 g壳聚糖粉末在50 mL 5%(v/v)硝酸溶液中,充分搅拌混匀后用高纯氮气曝气除氧保存,制备得到0.2%壳聚糖溶液。称取4.964 3 g FeSO4·7H2O以及0.248 2 g NiSO4·6H2O溶于100 mL除氧去离子水中,超声混合后加入三颈烧瓶中(提前通入氮气保持无氧环境),接着加入50 mL质量分数0.2%的壳聚糖溶液搅拌30 min。将2.889 6 g NaBH4溶于20 mL除氧去离子水中,超声溶解后加入到恒压漏斗中,以2滴/s的速度滴加到三颈烧瓶中,有黑色固体生成。滴加完毕后再搅拌60 min,利用外部磁铁进行固液分离,将固体样品用除氧去离子水冲洗3遍,装入西林瓶中,冷冻干燥24 h后,获得壳聚糖包覆纳米铁镍双金属(CS-Fe-Ni)。上述过程中不加入壳聚糖溶液,即获得纳米铁镍双金属Fe-Ni。
利用扫描电子显微镜(SEM-EDS, Zeiss Supra, 55-VP型)对合成的样品CS-Fe-Ni进行表征,获得其形貌和表面元素含量,扫描条件为:放大倍数(Mag)为100.00 kX, 信号(Signal)为SE2, 加速电压(EHT)为15.00 kV;通过X射线光电子能谱分析(XPS, ESCALAB 250Xi型,Thermo Fisher),获得样品表面元素价态,射线源类型:Al Kα。
1.3 CS-Fe-Ni 分散稳定性实验和迁移性
CS-Fe-Ni的分散稳定性实验通过不同种类纳米铁的光谱沉降曲线进行对比分析。将一定量的CS-Fe-Ni放入除氧NaHCO3(10 mmol/L)溶液中配置成1 g/L的CS-Fe-Ni悬浮液,超声30 min后放入石英比色皿。通过紫外可见分光光度计(UV1750型,Shimadzu, Kyoto,Japan)监测获得CS-Fe-Ni沉降光谱曲线。扫描波长为508 nm,扫描时间为5 000 s。利用激光粒度/Zeta电位分析仪(Omni型,BIC,USA)获得CS-Fe-Ni(20 mg/L)的Zeta电位值[24]。
CS-Fe-Ni的迁移性实验通过石英砂填充柱实验进行对比观察分析,如图1所示,石英砂使用前经酸洗并在丙酮溶液中超声1 h,去离子水清洗3次后在70 ℃烘箱中干燥,填充柱内径1.25 cm,高15 cm,孔隙体积1 PV=8 mL,孔隙度:0.435。背景溶液NaHCO3(10 mmol/L,DO值<0.2 mg/L)自下而上缓慢泵入,蠕动泵流速为1 mL/min,待柱内饱水状态后,然后以30 mL/min速度注入1 mL CS-Fe-Ni悬浮液(ρB=10 g/L)后再次以1 mL/min泵入NaHCO3溶液,直接观察CS-Fe-Ni在石英柱中的迁移情况。
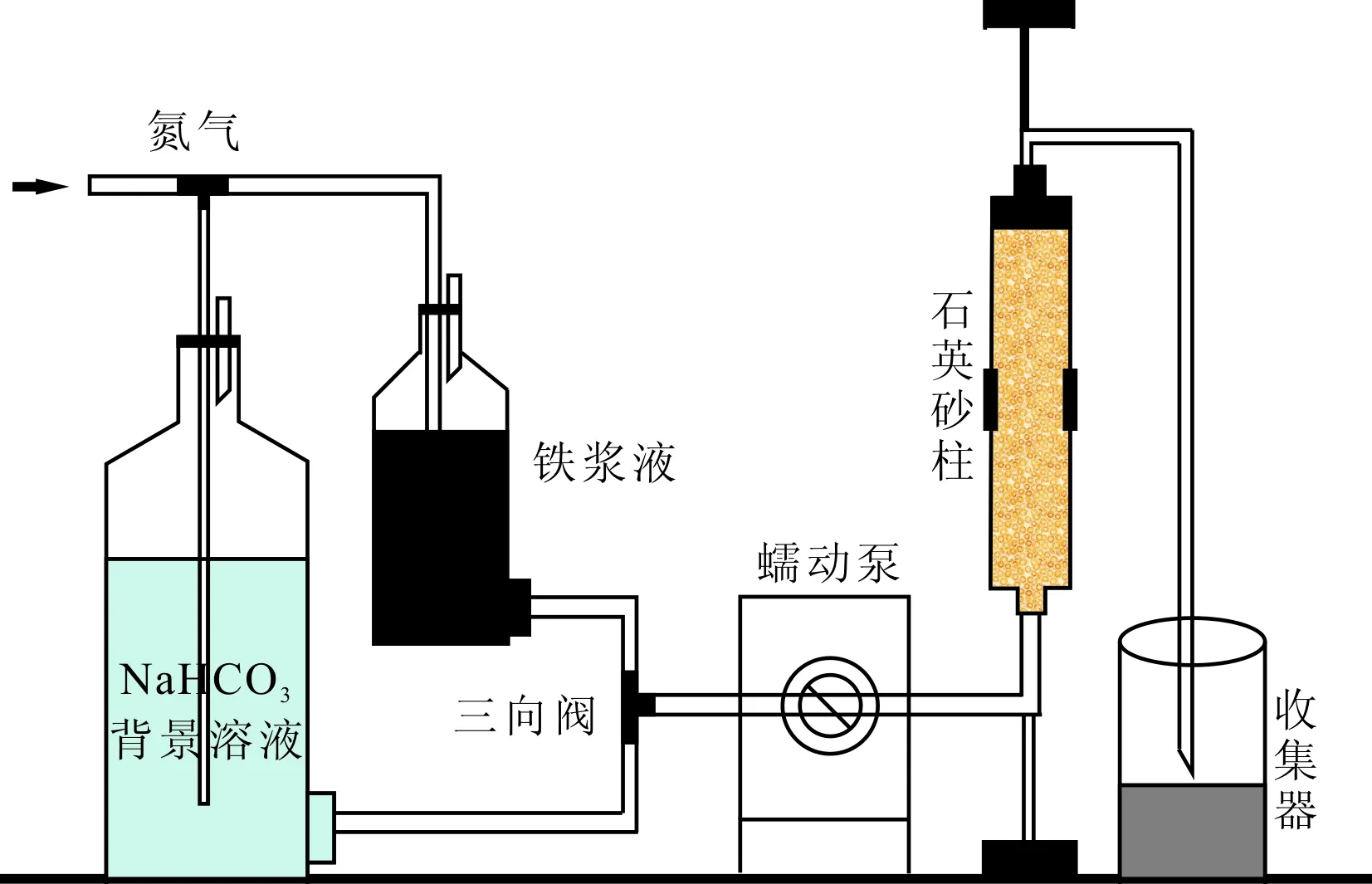
图1 柱实验装置示意图Fig.1 Sketch map of column experiment apparatus
1.4 CS-Fe-Ni对水中TCE降解实验
取100 mL 10 mmol/L NaHCO3缓冲溶液模拟地下水(pH为8.3±0.1),除氧后加入一定量的TCE储备液,配成浓度为13 mg/L,用聚四氟乙烯膜密封后超声10 min,以使体系中的TCE达到气液平衡状态。在TCE达到气液平衡状态后,快速加入CS-Fe-Ni(ρB=2 g/L),Fe-Ni(ρB=1 g/L)/CS (ρB=1 g/L),放入摇床震荡,震荡速度为150 r/min,反应温度为25 ℃,并按照预定的时间间隔取样。所有实验一式3份,用空白样来确定三氯乙烯的挥发损失。
通过溶液中氯离子的生成情况,判断TCE是否被完全降解。将40 mL 10 mmol/L NaHCO3缓冲溶液(pH=8.3±0.1)除氧气后配置成13 mg/L的TCE反应溶液,快速加入CS-Fe-Ni(ρB=2.5 g/L),按照预定的时间间隔取样。
溶液中TCE的测定通过顶空法取样,利用气相色谱仪GC-FID(GC-2010,Shimadzu,Japan)分析测试:顶空法采样后进样50 μL,柱流量1 mL/min,分流比1∶40,进样口温度150 ℃,FID检测器温度300 ℃。升温程序:柱温90 ℃,以10 ℃/min升至150 ℃保留1 min,再以30 ℃/min升至 180 ℃。溶液中氯离子浓度由离子色谱仪(Dinoex ICS-900)测定。
2 结果与讨论
2.1 CS-Fe-Ni形貌和组成
合成的CS-Fe-Ni扫描电镜表征如图2所示,CS-Fe-Ni球状颗粒表面包裹了一层包覆剂壳聚糖。颗粒粒径50 nm左右,堆积较为疏松。能谱图显示大量C是由壳聚糖高分子材料贡献,Fe和Ni的存在说明成功合成Fe-Ni双金属。

图2 CS-Fe-Ni样品扫描电镜及SEM-EDS图像分析Fig.2 SEM-EDS analysis of CS-Fe-Ni sample
通过对样品CS-Fe-Ni表面进一步做XPS分析,可以获得纳米颗粒表面的元素成分和价态(图3)。CS-Fe-Ni的表面有Fe(0)、Fe(Ⅱ)、Fe(Ⅲ)的峰,分别对应的峰值为706.5 eV、710.3 eV、711.4 eV,并且在852.4 eV和855.5 eV处看到Ni(0)和Ni(Ⅱ)的峰[25],说明零价铁在制备和表征过程中部分被氧化成Fe(Ⅱ)、Fe(Ⅲ),同时Ni(0)也会部分氧化成Ni(Ⅱ)。
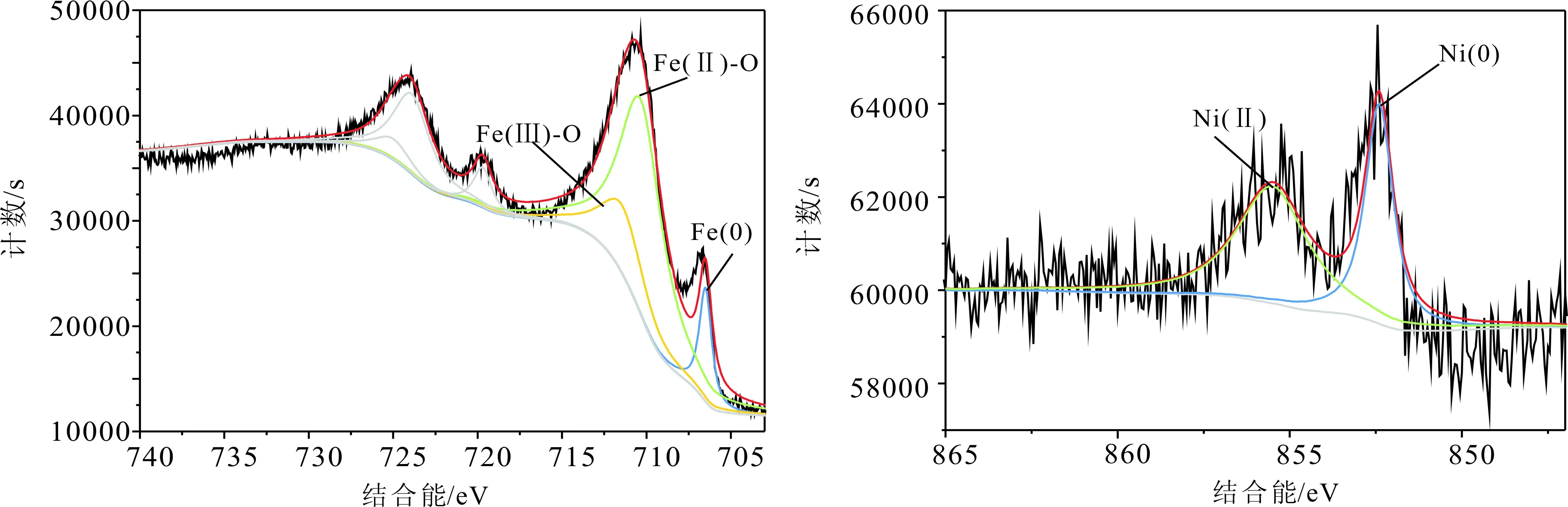
图3 CS-Fe-Ni样品X射线光电子能谱分析Fig.3 XPS analysis of CS-Fe-Ni sample
2.2 CS-Fe-Ni分散稳定性及迁移性能
通过沉降光谱曲线可以判断纳米颗粒的分散稳定性,通过柱迁移实验可以判断纳米颗粒的迁移能力。

图4 CS-Fe-Ni沉降光谱曲线Fig.4 UV-Vis spectrum of CS-Fe-Ni sedimentation

图5 CS-Fe-Ni的Zeta电位Fig.5 Zeta potential measurements of CS-Fe-Ni
由裸露的Fe-Ni和CS-Fe-Ni两种纳米颗粒的沉降光谱曲线(图4)可以看出,Fe-Ni的分散稳定性较差,而CS-Fe-Ni的悬浮分散稳定性在壳聚糖的作用下得到了增强。为此,进一步通过纳米颗粒的Zeta电位进行监测分析,如图5所示,Fe-Ni和CS-Fe-Ni的Zeta电位值均为负值,且随着时间基本没有变化,较为稳定。当包覆有壳聚糖后,使得纳米颗粒的负电荷进一步增加,约有5 mV(负值),使得纳米颗粒之间的静电排斥能力增强,从而CS-Fe-Ni的分散性得到进一步的改善[26]。

图6 Fe-Ni与CS-Fe-Ni在石英砂柱中的迁移效果Fig.6 Transport of Fe-Ni and CS-Fe-Ni in quartz sand column
图6是裸露的Fe-Ni和CS-Fe-Ni两种纳米颗粒的柱迁移实验对比照片,容易观察到,Fe-Ni在起初4 min有缓慢迁移,但在64 min即注入8 PV NaHCO3溶液后,迁移近乎停止,集中团聚在柱底部,说明Fe-Ni纳米颗粒在地下水环境中的迁移能力很差。
从对比实验可以看出,随着背景溶液的缓慢注入,CS-Fe-Ni向上不断迁移,在流入1 PV背景溶液后,部分纳米颗粒迁移到一半柱高位置,在2 PV后,基本能迁移至柱顶部。在8 PV背景溶液注入后,大部分纳米颗粒从柱内迁移到柱外,柱子会有少许部分残余物,由此证明经过壳聚糖包覆后,极大提高了纳米颗粒的迁移能力,为CS-Fe-Ni实际应用提供重要的实验参考基础。
2.3 CS-Fe-Ni对TCE的降解

图7 CS-Fe-Ni与Fe-Ni对TCE的降解效果Fig.7 Comparison of CS-Fe-Ni and Fe-Ni reactivity on TCE degradation (TCE: 13 mg/L, CS-Fe-Ni: 2 g/L, Fe-Ni: 1 g/L, CS: 1g/L,pH: 8.3)
前文CS-Fe-Ni表征中以C含量估算壳聚糖质量百分比,从而估算出CS-Fe-Ni样品中的实际铁含量约为理论值的47%。因此以实际铁投加量1 g/L计算,选取CS-Fe-Ni(ρB=2 g/L)、 Fe-Ni(ρB=1 g/L)开展降解TCE的效果对比研究。如图7所示,独立组分壳聚糖对TCE不具有吸附或降解效果。而相同铁投加量的CS-Fe-Ni(ρB=2 g/L)和Fe-Ni(ρB=1 g/L)在18 h内,能够完全降解TCE,说明CS-Fe-Ni的化学活性与Fe-Ni的能力基本持平,不过CS-Fe-Ni具有更良好的迁移能力。
本文除了运用气相色谱分析TCE浓度的变化,同时对反应过程中溶液的Cl-浓度进行监测,通过质量平衡计算评估TCE的降解是否进行完全。如图8所示,溶液中Cl-浓度随着TCE的不断降解而增多,最终溶液中Cl-浓度达到10.67 mg/L,与TCE完全脱氯理论值10.65 mg/L相符。说明TCE降解的最终结果是完全脱氯。
究其原因,纳米零价铁对氯代烷烃的脱氯还原作用实际上是一个表面控制的电化学过程[27-28]。如图9所示,少量镍在纳米零价铁表面,周围包覆有壳聚糖高分子,形成CS-Fe-Ni,Fe/Ni构成原电池体系,从而加速了Fe的腐蚀,而铁腐蚀产生的氢被吸附到铁表面的镍金属上,经镍金属催化容易形成活性氢,该形态具有较高的还原性,从而提高了还原脱氯的效率[29-30]。

图8 CS-Fe-Ni降解TCE溶液中Cl-浓度变化Fig.8 Concentration of Cl- in solution during TCE degradation by CS-Fe-Ni(TCE:13 mg/L, CS-Fe-Ni: 2.5 g/L, pH:8.3)

图9 CS-Fe-Ni降解TCE机理示意图Fig.9 Mechanism of TCE degradation by CS-Fe-Ni
3 结论与建议
纳米零价铁原位注射技术用于地下水污染修复是一种有效手段,但是纳米铁颗粒易团聚,迁移性较差。本文成功合成了壳聚糖包覆的纳米铁镍双金属颗粒(CS-Fe-Ni),提高了纳米铁分散稳定性以及迁移性。通过降解水中三氯乙烯实验研究,证实了镍的存在极大提高了TCE完全脱氯的降解速度。本文实验研究结果为纳米铁原位注射技术的实际应用提供了重要的理论和实验参考。
