宫颈癌组织中性别基因框蛋白9的表达及临床意义
2018-12-27鹿先梅印永祥陆晓红詹惠英
鹿先梅,张 晔,印永祥,徐 锋,陆晓红,季 静,詹惠英
(1.南京医科大学附属无锡妇幼保健院宫颈科,江苏 无锡 214002;2.南京医科大学附属无锡妇幼保健院病理科,江苏 无锡 214002)
宫颈癌是女性最常见的恶性肿瘤,确诊时多已为晚期,患者5 a生存率约60%[1]。由于各种因素的影响,我国宫颈癌发病人数逐年增加,并有低龄化趋势[2]。人乳头状瘤病毒(human papillomavirus,HPV)持续感染是导致宫颈癌发生的主要因素,宫颈癌的发生与发展是多阶段、多因素持续影响的过程[3]。宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)是与宫颈癌密切相关的癌前病变,是宫颈癌的前期过程,约30%的CIN可发展为宫颈癌[4-5]。目前,基于HPV检测的宫颈癌与癌前病变的筛查方法容易出现漏诊,阻碍了宫颈癌与癌前病变防治工作的进程,为此,临床上需要寻找一种有效的宫颈病变分子标志物对宫颈癌与癌前病变的筛查进行补充检测[4,6]。性别基因框蛋白(sex determining region Y box protein,SOX)是由具有高迁移率族盒 (high mobility group-box,HMG-box)的基序保守区的基因编码的蛋白质,在该保守区内其与性别决定基因(sex determining region Y,SRY)编码的蛋白质有60%以上氨基酸序列相似。SOX9作为SOX家族成员之一,可参与调节胚胎发育、干细胞活性、中枢神经系统发育等[7-9]。研究表明,SOX9是一种重要的转录因子,其异常表达或突变与多种病变有关,在胶质瘤、胃癌等多种恶性肿瘤组织中表达[10-11],SOX9过度表达多提示恶性肿瘤的预后不良[12],但SOX9在宫颈癌及癌前病变组织中的表达情况及作用机制尚不清楚。本研究通过观察宫颈癌、癌前病变及正常宫颈组织中SOX9蛋白表达的差异,探讨SOX9与宫颈癌病变的关系,为宫颈癌的基因靶向治疗提供新思路。
1 资料与方法
1.1一般资料选择2014年9月至2018年2月南京医科大学附属无锡妇幼保健院收治并经术后病理检查确诊的宫颈癌患者70例为宫颈癌组,年龄41~73(56.05±7.13)岁,体质量指数(body mass index,BMI) 18~25(22.48±1.48)kg·m-2;临床分期:Ⅰ期38例,Ⅱ期22例,Ⅲ期10例;组织学分级:高分化31例,中分化31例,低分化8例;有转移者21例,无转移者49例;病理类型:鳞状细胞癌65例,腺癌5例。选择同期宫颈癌前病变患者70例为宫颈癌前病变组,年龄39~74(41.85±8.09)岁,BMI 18~27(21.94±2.19)kg·m-2;CINⅠ级30例,CINⅡ级20例,CIN Ⅲ级20例。另选择同期因子宫肌瘤、异常子宫出血、子宫腺肌症等妇科良性疾病行子宫全切者50例为对照组,年龄43~78(35.11±8.93)岁,BMI 17~30(21.44±2.32)kg·m-2。所有患者术前未进行放射治疗、化学治疗及免疫抑制治疗,宫颈组织标本均由2名以上临床经验丰富的病理医师确诊。3组患者的年龄、BMI比较差异无统计学意义(P>0.05),具有可比性。本研究通过医院伦理委员会批准,患者均知情同意并签署知情同意书。
1.2主要试剂与仪器一抗鼠抗人SOX9单克隆抗体、二抗山羊抗小鼠IgG(英国Abcam公司),免疫组织化学试剂盒、浓缩型二氨基联苯胺(diamino benzidine,DAB)显色剂试剂盒(北京中杉金桥生物技术有限公司);Eclipse E100显微镜(日本尼康公司),免疫组织化学分析系统和图像采集系统均为NIS-Elements软件。
1.3免疫组织化学法检测宫颈组织标本中SOX9蛋白表达采集各组患者手术切除的宫颈组织标本0.5 cm×0.5 cm×0.5 cm,置于40 g·L-1多聚甲醛中固定24 h,乙醇脱水,常规石蜡包埋,制成厚约 2 μm 切片。过氧化氢孵育10 min,蒸馏水冲洗,磷酸盐缓冲液(phosphate buffered solation,PBS)浸泡;一抗孵育4 ℃过夜,PBS洗涤3次,每次5 min;二抗孵育37 ℃,30 min;PBS洗涤3次,每次5 min;辣根过氧化物酶标记,室温孵育30 min,PBS漂洗3次,每次5 min;DAB显色、苏木精复染;乙醇脱水,封片镜检。以PBS代替一抗做阴性对照,以已知的SOX9染色阳性的宫颈癌组织切片作阳性对照。每张切片随机选取4个高倍视野,计数200个细胞,根据细胞着色强度、阳性细胞率分别记分。SOX9蛋白阳性细胞表现为细胞质呈棕黄色颗粒,细胞不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞率≤5%为0分,6%~25%为1分,26%~50%为2分,>50%为3分;根据细胞着色强度、阳性细胞率得分的乘积判定SOX9阳性表达结果:0~1分为阴性(-),2~5分为弱阳性(+),6~8分为阳性(++),9分为强阳性;阳性表达率=总阳性例数/总例数×100%。

2 结果
2.1各组患者宫颈组织中SOX9蛋白阳性表达率比较宫颈癌组、癌前病变组、对照组患者宫颈组织中SOX9蛋白阳性表达率分别为 77.1%(54/70)、32.9%(23/70)、8.0%(4/50);宫颈癌组患者宫颈组织中SOX9蛋白阳性表达率显著高于癌前病变组和对照组,差异有统计学意义(χ2=27.734、55.837,P<0.05);癌前病变组患者宫颈组织中SOX9蛋白阳性表达率显著高于对照组,差异有统计学意义(χ2=10.335,P<0.05)。癌前病变组患者中,CINⅠ、Ⅱ、Ⅲ级患者宫颈组织中SOX9蛋白阳性表达率分别为13.3%(4/30)、30.0%(6/20)、65.0%(13/20);CIN Ⅱ、Ⅲ 级患者宫颈组织中SOX9蛋白阳性表达率显著高于CIN Ⅰ 级患者,差异有统计学意义(χ2=2.083、14.275,P<0.05);CIN Ⅲ级患者宫颈组织中SOX9蛋白阳性表达率显著高于CIN Ⅱ 级患者,差异有统计学意义(χ2=4.912,P<0.05)。见图1。
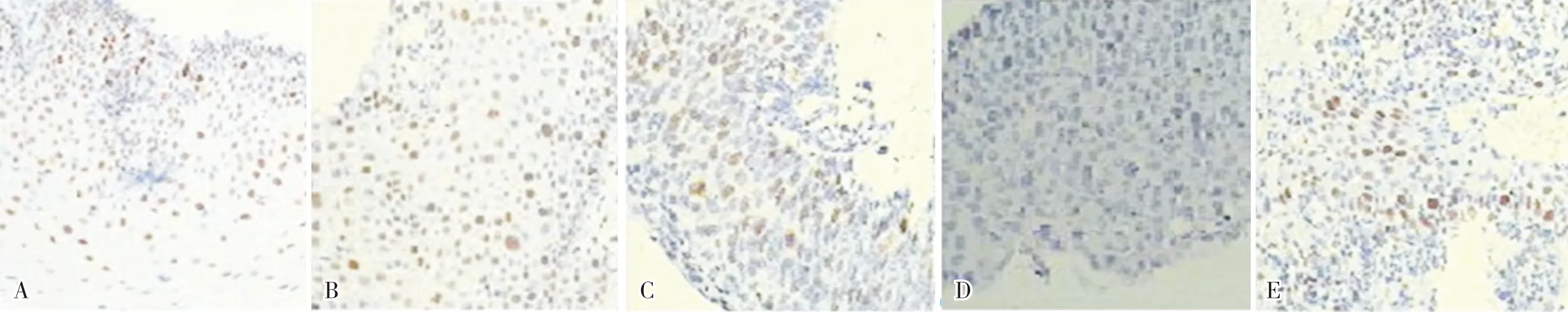
A:对照组;B:癌前病变组CINⅠ级;C:癌前病变组CINⅡ级;D:癌前病变组CINⅢ级;E:宫颈鳞癌。
图1不同宫颈组织中SOX9蛋白表达情况(免疫组织化学染色,×200)
Fig.1ExpressionofSOX9indifferentcervicaltissues(immunohistochemicalstaining,×200)
2.2宫颈癌组织中SOX9蛋白表达与临床特征的关系结果见表1。宫颈癌组织中SOX9蛋白表达与宫颈癌临床分期、组织学分级、淋巴结转移有关(P<0.05),与年龄、BMI、病理类型无关 (P<0.05)。
表1宫颈癌组织中SOX9蛋白表达与临床特征的关系
Tab.1RelationshipbetweenSOX9expressionandclinicopathologicalfeaturesincervicalcancer
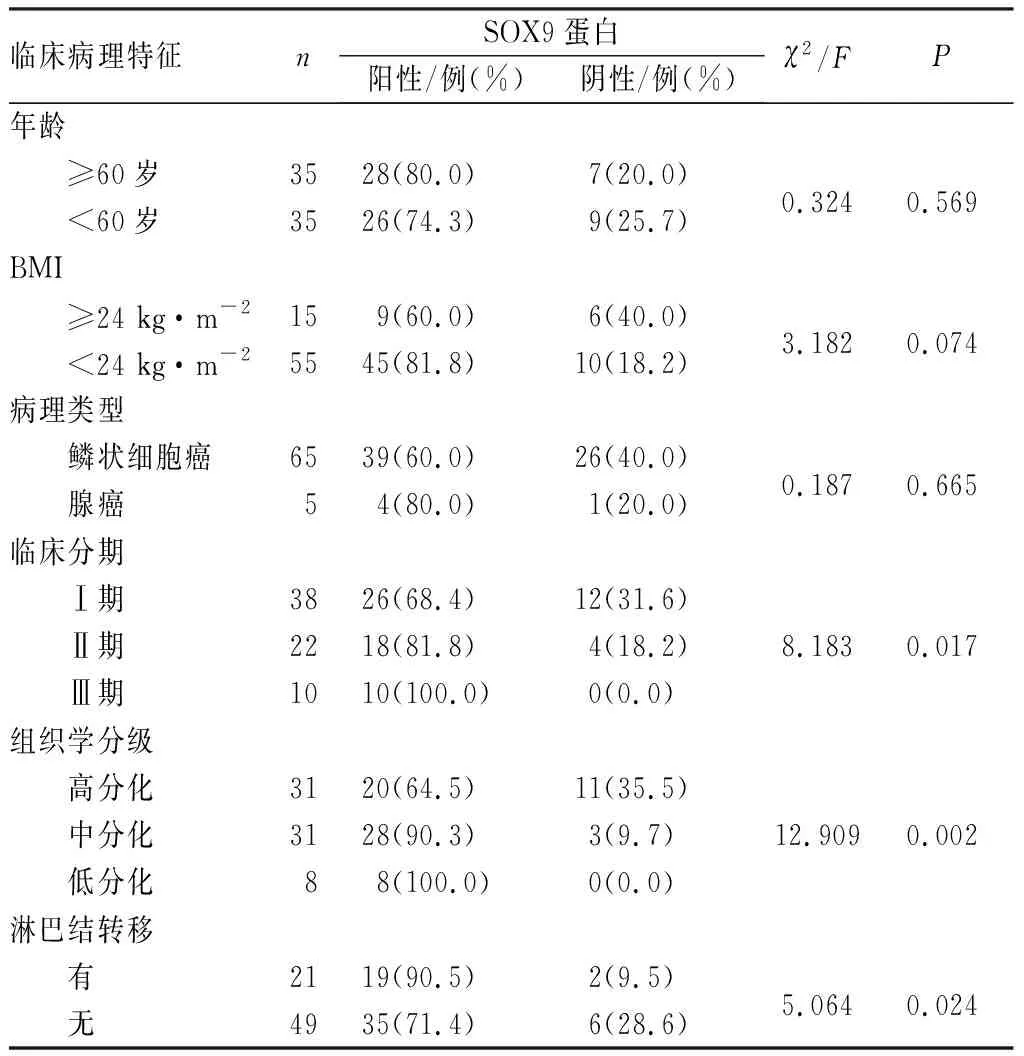
临床病理特征nSOX9蛋白阳性/例(%)阴性/例(%)χ2/FP年龄 ≥60岁3528(80.0)7(20.0)0.3240.569 <60岁3526(74.3)9(25.7)BMI ≥24 kg·m-2159(60.0)6(40.0)3.1820.074 <24 kg·m-25545(81.8)10(18.2)病理类型 鳞状细胞癌6539(60.0)26(40.0)0.1870.665 腺癌54(80.0)1(20.0)临床分期 Ⅰ期3826(68.4)12(31.6) Ⅱ期2218(81.8)4(18.2)8.1830.017 Ⅲ期1010(100.0)0(0.0)组织学分级 高分化3120(64.5)11(35.5) 中分化3128(90.3)3(9.7)12.9090.002 低分化88(100.0)0(0.0)淋巴结转移 有2119(90.5)2(9.5)5.0640.024 无4935(71.4)6(28.6)
3 讨论
宫颈癌在女性恶性肿瘤中的发病率仅次于乳腺癌,我国每年有2~3万名妇女死于该病[13]。HPV持续感染是宫颈癌及癌前病变的主要因素,研究显示,信号转导途径异常可引起某些基因异常扩增,是导致宫颈癌及癌前病变形成的原因之一[14]。宫颈癌及癌前病变的发生与发展是一个多因素、多阶段的过程,且可防可治,因此,早期诊治尤其重要。近年来,传统诊疗技术治疗下患者的5 a生存率较低,因此,探索宫颈癌早期诊断及靶向治疗具有重要的意义。
SOX家族是一类与早期胚胎发育有关的核转录因子,属于HMG-box基序保守区的基因,SOX与转录因子可相互作用形成复合体,调控靶基因的表达[15]。SOX家族E亚族中的SOX9是目前研究最多、最明确的基因。SOX9是与位于Y染色体上的SRY基因同源的基因,编码509个氨基酸多肽。SOX9可与其他转录因子或配体蛋白形成复合体,也可构成一个多层次、多环节的网络调控系统[16]。SOX9的异常表达可能促进人类多种肿瘤的形成和发展[17-19],对肿瘤细胞的增殖、分化、凋亡、浸润和转移等均有一定的调控作用。研究表明,SOX9在大肠癌中呈高表达,降低SOX9表达水平后,细胞增殖和与细胞分裂有关的磷酸化组蛋白均显著减少,表明SOX9可促进大肠肿瘤细胞的增殖[20]。还有研究发现,在宫颈癌细胞HeLa中SOX9表达与 ki-67 表达呈负相关,增加细胞中SOX9的表达能够阻止宫颈癌细胞G1/S的过渡,抑制细胞增殖[21],推测SOX9表达阳性可促进宫颈癌细胞增殖,且在癌变周期中发挥促进作用。本研究结果显示,宫颈癌组患者宫颈组织中SOX9阳性表达率显著高于癌前病变组与对照组,且癌前病变组宫颈组织中SOX9阳性表达率与对照组比较也显著增高;另外,在癌前病变组织中,随着CIN分级的增加,SOX9阳性表达率显著增加,提示SOX9表达与宫颈癌发展存在密切关系。
宫颈癌的转移、低分化等是宫颈癌患者死亡的主要原因,也是恶性肿瘤的主要特征[22]。有研究发现,SOX9在乳腺癌组织中高表达,并与肿瘤的转移和浸润密切有关,且高表达患者预后差[23]。本研究结果显示,在宫颈癌组织中,SOX9表达与临床分期、淋巴结转移及分化程度有关。上皮间质转化与肿瘤的转移密切相关,E-钙黏蛋白向N-钙黏蛋白的转化是肿瘤上皮细胞向间质细胞转变的关键步骤[24-25]。有研究表明,高表达的SOX9可通过增强Wnt/β-catenin信号来促进细胞的迁移、侵袭和上皮间质转化,也可以负向调节E-钙黏蛋白来促进细胞的迁移和侵袭[26-27]。还有研究显示,宫颈癌组织中SOX9的表达与分化程度、浸润深度、淋巴结转移、TNM分期以及患者5 a生存率、中位生存时间均有显著相关性[28-29]。研究显示,具有侵袭性的胰腺癌干细胞中SOX9表达显著高于无侵袭性的干细胞[30-31]。这些研究同本研究结果一致,但关于SOX9影响癌变的信号通路尚不明确,在下一步工作中,本研究将继续寻找SOX9分子的上游信号、下游调控靶点及不同转录因子之间的交互作用,以期为宫颈癌与癌前病变的治疗提供新途径。
综上所述,相对于正常组织及癌前病变组织,SOX9在宫颈癌组织中呈高表达,且与肿瘤的临床分期、转移与分化程度有关,在宫颈癌的发生、发展过程中起一定的作用。
