黄芪甲苷通过调控miR-33a及ABCA1信号发挥抗动脉粥样硬化作用*
2018-12-27秦合伟李彦杰张志鑫李斯锦卢永保
秦合伟, 李彦杰, 张志鑫, 任 锟, 李斯锦, 卢永保
(1河南省中医院, 河南中医药大学第二附属医院, 2河南中医药大学, 河南 郑州 450002)
动脉粥样硬化(atherosclerosis,AS)是心脑血管疾病最主要的基础病理改变,目前认为AS与内皮细胞损伤、脂质紊乱、免疫应答和与其相关的慢性炎症反应有密切关系。AS发病机制和病理的复杂性给临床的治疗和预防带来一定的困难。微小RNAs(microRNAs,miRNAs,miR)是一类高度保守的非编码小RNA,它通过与靶标基因的3’非翻译区(3’-untranslated region,3’-UTR)靶向结合,从而降解靶基因的mRNA,或靶向结合后抑制蛋白质翻译,最终达到调控基因表达的目的。miR-33a位于固醇调节元件结合蛋白2(sterol regulatory element binding protein2,SREBP2)基因的第16位内含子中,在哺乳动物的体内具有高度保守性。miR-33a的主要靶基因是三磷酸腺苷结合盒转运体A1(ATP binding cassette transporter A1,ABCA1)。ABCA1是介导细胞胆固醇流出的主要膜转运体。既往有研究表明,miR-33a通过抑制ABCA1的表达,减少细胞内胆固醇的流出,导致泡沫细胞的形成[1-2]。
黄芪是传统中药的一种,在心血管疾病的治疗中应用广泛,其主要化学成分包括苷类、多糖和氨基酸等,是一种天然的抗氧化剂;黄芪甲苷(astragaloside IV,AS-IV)是一种提取分离自中药黄芪的单体化合物。本课题组前期研究发现,黄芪甲苷具有改善脂质代谢紊乱,调控基质细胞衍生因子1(stromal cell-derived factor-1,SDF-1)与其受体(C-X-C chemokine receptor 4,CXCR4)的生物信号,抑制主动脉粥样斑块SDF-1和CXCR4的mRNA和蛋白表达,以及调控骨髓源性内皮祖细胞CXCR4的mRNA和蛋白表达的作用[3];能够通过调控磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)/哺乳动物雷帕霉素靶蛋白(the mammalian target of rapamycin,mTOR)信号通路,抑制炎症反应,抑制动脉粥样硬化斑块的形成[4]。本研究旨在观察黄芪甲苷调节血脂抑制动脉粥样硬化的作用机制是否与调控miR-33a,进而影响ABCA1的信号表达,促进巨噬细胞内胆固醇流出有关。
材 料 和 方 法
1 实验动物、药物与试剂
人单核巨噬细胞系THP-1购自中国科学院上海生科院细胞资源中心;本实验所用C57BL/6J小鼠购自中国科学院上海生命科学研究所,12只作为正常(normal)组;ApoE-/-小鼠购自南京大学模式动物研究所,动物许可证号为SCXK(苏)2010-0001,共24只,SPF级,8周龄,体质量(18±2)g,雄性;SD大鼠来源于上海斯莱克实验动物有限公司,动物许可证号为SCXK(沪)2003-0003,20只,雄性,体质量(300±20)g。所有动物饲养于河南中医药大学SPF级动物实验中心。
黄芪甲苷原料药(纯度>98%,批号 84687-43-4购自南京春秋生物工程有限公司);miR-33a模拟物(miR-33a mimic)购自广州锐博公司;兔抗人ABCA1 I抗以及佛波酯(phorbol myristate acetate,PMA)购自Sigma;抗GAPDH抗体和辣根过氧化物酶标记的羊抗兔 II 抗购自杭州贤致公司;总RNA抽提试剂盒、总RNA逆转录试剂盒、ABCA1蛋白定量试剂盒和RT-PCR试剂盒购自TaKaRa;RNA逆转录试剂盒购自Fermentas;蛋白提取试剂盒购自碧云天公司;氧化低密度脂蛋白(oxidized low-density lipoprotein, oxLDL)购自广州瑞博生物科技有限公司;其余试剂为国产或进口分析纯。
2 实验方法
2.1黄芪甲苷含药血清的制备 将20只SD大鼠随机分为2组,即空白(blank)组和黄芪甲苷(AS-IV)组,空白组给予蒸馏水灌胃,黄芪甲苷组给予黄芪甲苷(40 mg/kg)灌胃,每日1次,连续1周。1周后,腹主动脉取血,12 000×g高速离心10 min,取上清液,56 ℃灭活, -80 ℃保存备用[4]。
2.2细胞培养及分组 THP-1细胞用160 nmol/L的PMA处理24 h,使其诱导分化为巨噬细胞,再用50 mg/L oxLDL孵育使其变成泡沫细胞作为实验模型。THP-1巨噬细胞源性泡沫细胞换无血清培养基培养,按照实验设计,分为空白血清(blank serum)组、黄芪甲苷含药血清(AS-IV-containing serum)组及黄芪甲苷含药血清+miR-33a mimic联合处理(combined)组。miR-33a mimic转染方法:在无菌条件下,用含有10% FBS的DMEM细胞培养基,将巨噬细胞(1×108/L)接种于6孔板,每孔含有2 mL培养基;在37 ℃、5% CO2细胞培养箱中孵育片刻,备用;取miR-33a mimi (20 μmol/L) 0.6 μL和HiPerFect转染试剂12 μL滴加入300 μL的不含FBS和抗生素的DMEM细胞培养基,混合均匀,使其终浓度为5 nmol/L;在室温条件下(15~25 ℃),放置 5~10 min,直至形成转染复合物;将转染复合物分别均匀滴入上述接种巨噬细胞的培养基中,混合均匀;在37 ℃、 5% CO2细胞培养箱中孵育24 h后,更换含ox-LDL (5 mg/L)的低糖DMEM细胞培养基,在37 ℃、 5% CO2细胞培养箱中孵育,备用,等到巨噬细胞的融合度约达到80%时,终止细胞的培养。
2.3体内实验
2.3.1造模与给药 所有小鼠进行适应性饲养1周后,ApoE-/-小鼠给予高脂饲料(含脂肪21%和胆固醇0.15%),C57BL/6J小鼠12只作为正常(normal)组,各组均予以自由饮水。于饲养4周(主动脉壁可见明显的斑块形成为造模成功)后将24只ApoE-/-小鼠按照随机分组方法分为2组:模型(model)组和黄芪甲苷(AS-IV)组,每组12只。于12周龄起,黄芪甲苷组给予黄芪甲苷(40 mg/kg,按中等剂量,1 倍成人临床等效量)灌胃;正常组和模型组给予等体积生理盐水灌胃[4]。
2.3.2样品采集与处理 各组动物连续给药12周后取材,取材前小鼠禁食12 h,无菌条件下,迅速打开胸腔和腹腔,沿主动脉瓣至髂动脉分支处剥离全长主动脉。
2.3.3病理形态学观察 主动脉经过乙醇梯度脱水、透明、浸蜡包埋后切片,厚度设定为4 μm,采用常规HE染色法进行切片染色,应用光学显微镜进行观察。
2.3.4Real-time PCR检测主动脉中miR-33a和ABCA1 mRNA的表达 将小鼠主动脉组织称取质量后,加入适量的TRIzol,按试剂盒说明书提取总RNA。取10 μL总RNA,加入4 μL 5×RT缓冲液、1 μL随机引物d(N)6、2 μL 10 mmol/L dNTP、1 μL 无RNase的DNase I和1 μL(40 U) RNase抑制剂,置于金属浴锅上,37 ℃ 30 min、 75 ℃ 10 min,去除残余的基因组DNA,立即冰浴,随后加入0.25 μL RNasin和1 μL ReverTra Ace再行逆转录(25 ℃ 10 min、42 ℃ 1 h、 75 ℃ 10 min、 4 ℃保存)得到cDNA。 PCR条件为:95 ℃ 5 min; 95 ℃ 15 s、55 ℃ 20 s、72 ℃ 20 s, 3个循环;95 ℃ 15 s、55 ℃ 20 s、72 ℃ 20 s、79 ℃ 10 s,40个循环,79 ℃测荧光;55 ℃~95 ℃,每个循环加0.5 ℃,检测熔解曲线[4-5]。PCR结果定量用2-ΔΔCt法,ΔCt=目的基因Ct-内参照基因Ct,以正常组作为对照样本,ΔΔCt=观察样本ΔCt-对照样本ΔCt。样本的相对表达量=2-ΔΔCt。ABCA1的上游引物序列为5’-GTCAACCTCTACAGCAGCGT-3’,下游引物序列为5’-CTATCGGGGTAAAGGCGGTC-3’;GAPDH的上游引物序列为5’-AGCTCGCCTCTAGCTGCTGAC-3’, 下游引物序列为5’-TGTACACAGGTAAACACGTCTG-3’。
2.3.5Western blot检测各组小鼠主动脉ABCA1的蛋白表达 取小鼠主动脉,用PBS冲洗3次,洗去残血,磨碎匀浆后加入蛋白裂解液裂解蛋白,于4 ℃、 1 000×g离心10 min,小心吸取上清液,用BCA法进行蛋白质定量。采用G250-Bradford蛋白浓度测定法对蛋白进行定量。提取的蛋白质样品经定量后,加入适量上样缓冲液,95 ℃加热10 min使蛋白质变性,于SDS-PAGE分离蛋白,用恒定电流转移至PVDF膜上,5%脱脂牛奶室温封闭,加入相应浓度的 I 抗,4 ℃孵育过夜,TBST洗涤3次;加入 II 抗,室温孵育,TBST洗涤3次。用碱磷酶化学发光进行显色,观察ABCA1蛋白质表达的变化,以β-actin为内参照,目的蛋白表达条带密度与β-actin条带密度的比值即为相对表达量[4-5]。
2.4体外实验
2.4.1Real-time PCR检测细胞miR-33a的表达 用空白血清和不同浓度(3、10和30 mg/L)黄芪甲苷含药血清处理THP-1巨噬细胞源性泡沫细胞24 h,或用10 mg/L黄芪甲苷含药血清处理THP-1巨噬细胞源性泡沫细胞不同时间(0、6、12和24 h),提取细胞RNA。miR-33a上游引物为5’-GUUGUUGCUAGUUGCGUUG-3’,下游引物为5’-GUGUGUAGUUGUUGCAUUG-3’;U6的上游引物序列为5’-AGCTCGCTGTGAGCTGCTGC-3’,下游引物序列为5’-CAGTTGCCAGTCGTCGAGGT-3’。PCR参数为:95 ℃ 30 s; 95 ℃ 5 s、55 ℃ 10 s,40个循环。设U6 为内参照,其相对表达量采用2-ΔΔCt法计算。
2.4.2Real-time PCR和Werstern blot检测细胞ABCA1的表达 用空白血清和高、中、低3个浓度的含药血清处理THP-1巨噬细胞源性泡沫细胞24 h后收集细胞,real-time PCR检测方法同上。Werstern blot检测方法:用各组血清处理THP-1巨噬细胞源性泡沫细胞24 h后收集细胞,PBS洗涤3次,用蛋白裂解液裂解总蛋白,提取蛋白,经定量后,加入缓冲液,加热使蛋白质变性,电泳分离蛋白,转膜至PVDF膜上。5%脱脂牛奶室温封闭,加入相应浓度的 I 抗,4 ℃孵育过夜,TBST洗涤3次;加入II抗,室温孵育,TBST洗涤3次;用碱性磷酸酶化学发光进行显色。使用ImageJ 的软件分析条带灰度值[4, 6]。
科学技术的飞速发展使移动短视频平台更加方便地融入到了大众的生活之中,降低了内容生产的门槛,增加了用户对短视频平台的使用率,使用户可以随时随地分享生活,让更多的消费者有选择的空间。
2.4.3油红O染色检测细胞内脂质含量 将细胞接种于48孔板,诱导分化和BPA处理,隔日应用PBS液洗涤3次,采用4%多聚甲醛固定10 min,后吸弃培养液,加入固定液;PBS液洗涤3次,加入油红O染色液15 min后,用苏木精染色5 min,10 mL/L HCl分化,水冲洗至变蓝,双蒸水冲洗后甘油明胶封片。倒置显微镜下观察,可见细胞内脂质呈红染,细胞核呈蓝染,显微镜拍照[2]。
2.4.4高效液相色谱法检测细胞内胆固醇含量 参照文献方法[2]收集细胞,加入氯化钠200 μL,采用冰浴中超声使细胞破碎,用BCA法测定蛋白含量后,使用三氯乙酸(6%)沉淀,去除蛋白,取上清液进行胆固醇检测。取100 μL上清液,加入氢氧化钾溶液(8.9 mol/L)200 μL,水解胆固醇酯后作为细胞内总胆固醇待测样品。将样品分别与内标液(豆甾醇)混匀,用正己烷和异丙醇(3 ∶2,V/V)溶液和无水乙醇抽提后真空干燥。上样前用100 μL乙腈和异丙醇(70∶30,V/V)溶解样品,采用C-18柱,温度为室温,流速1 mL/min,检测波长为250 nm,以峰面积定量胆固醇,内标校准,以mg/(g protein)为单位。
2.4.5[3H]法检测细胞内胆固醇流出 细胞先在正常培养液中和7.4 MBq/L [3H]胆固醇共同孵育24 h,用PBS液洗涤细胞后置含脂蛋白的无血清培养液中再培养24 h。PBS液漂洗细胞3次,加入闪烁液裂解细胞,用液闪计数法检测培养液和细胞中的[3H]胆固醇的含量[2]。胆固醇流出率(%)=培养液闪烁计数/总闪烁计数(培养液闪烁计数+细胞闪烁计数)×100%。
3 统计学处理
采用SPSS 19.0统计学软件进行数据分析。数据以均数±标准差(mean±SD)表示。实验数据经正态性、方差齐性检验,符合条件后,多组样本间比较采用单因素方差分析,各组间均数比较采用LSD-t检验和q检验;当实验数据不符合正态性、方差齐性时, 采用秩和检验进行组间两两比较。以P<0.05为差异有统计学意义。
结 果
1 体内实验
1.1一般情况 饲养和灌胃过程中ApoE-/-小鼠死亡1只,剔除离群值,最后进入统计的各组小鼠数量各为10只。
1.2各组小鼠主动脉病理形态观察 光学显微镜观察可见正常组小鼠主动脉壁厚薄均匀,主动脉内膜光滑平整,内膜各层结构正常,未发现明显的动脉粥样硬化病灶;模型组光镜下可见动脉管腔不平,管腔内膜显著增厚,管壁厚度和斑块截面积显著大于正常组;黄芪甲苷组的主动脉壁各层结构正常,局部可见小灶性的钙化颗粒物沉积,可见较小斑块,病变程度明显较轻,见图1。
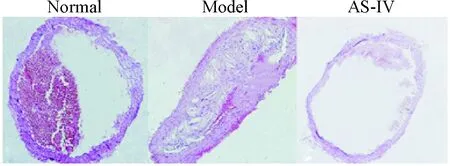
Figure 1.Pathological changes in the aorta of mice in each group (HE staining, ×200).
1.3黄芪甲苷对小鼠主动脉miR-33a及ABCA1 mRNA和蛋白表达水平的影响 药物干预后,黄芪甲苷组小鼠主动脉的miR-33a表达量降低, ABCA1的mRNA和蛋白相对表达量均升高(P<0.05),表明随着黄芪甲苷对miR-33a的抑制,ABCA1水平逐渐上升,见表1、图2。

表1 黄芪甲苷对小鼠主动脉miR-33a及ABCA1 mRNA和蛋白表达水平的影响
*P<0.05vsnormal group;#P<0.05vsmodel group.
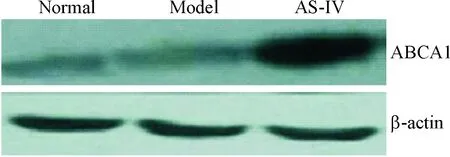
Figure 2.The protein expression of ABCA1 in mouse aorta of each group determined by Western blot.
2 体外实验
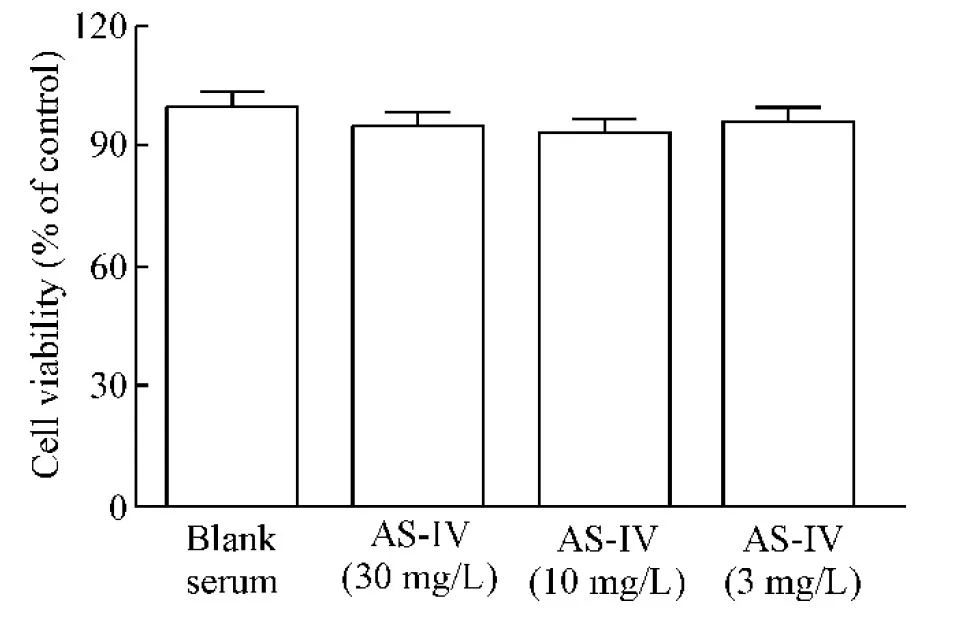
Figure 3.Observation of the toxicity effects of astragaloside-containing serum on the viability of THP-1 macrophages. Mean±SD. n=6.
2.2黄芪甲苷含药血清对THP-1巨噬细胞源性泡沫细胞miR-33a表达的影响 分别用空白血清和不同浓度的黄芪甲苷含药血清处理THP-1巨噬细胞24 h,real-time PCR检测结果显示,不同浓度的黄芪甲苷含药血清处理后,细胞中miR-33a表达均较空白血清组下调(P<0.05或P<0.01),见图4。用黄芪甲苷含药血清处理THP-1巨噬细胞源性泡沫细胞不同时间,real-time PCR检测结果显示,与0 h组相比,处理12 h组细胞的miR-33a 表达出现下调,处理24 h组细胞的miR-33a 表达下调更为明显(P<0.01),见图5。
2.3miR-33a在黄芪甲苷含药血清上调THP-1巨噬细胞源性泡沫细胞ABCA1表达中的作用 与空白血清组相比,黄芪甲苷含药血清组细胞ABCA1的mRNA和蛋白水平均明显上调(P<0.05);而与含药血清单独处理组相比,联合处理组细胞ABCA1的mRNA和蛋白水平均明显下调(P<0.05),见表2、图6,提示THP-1巨噬细胞源性泡沫细胞miR-33a的过表达可明显抑制黄芪甲苷上调细胞ABCA1表达的作用。
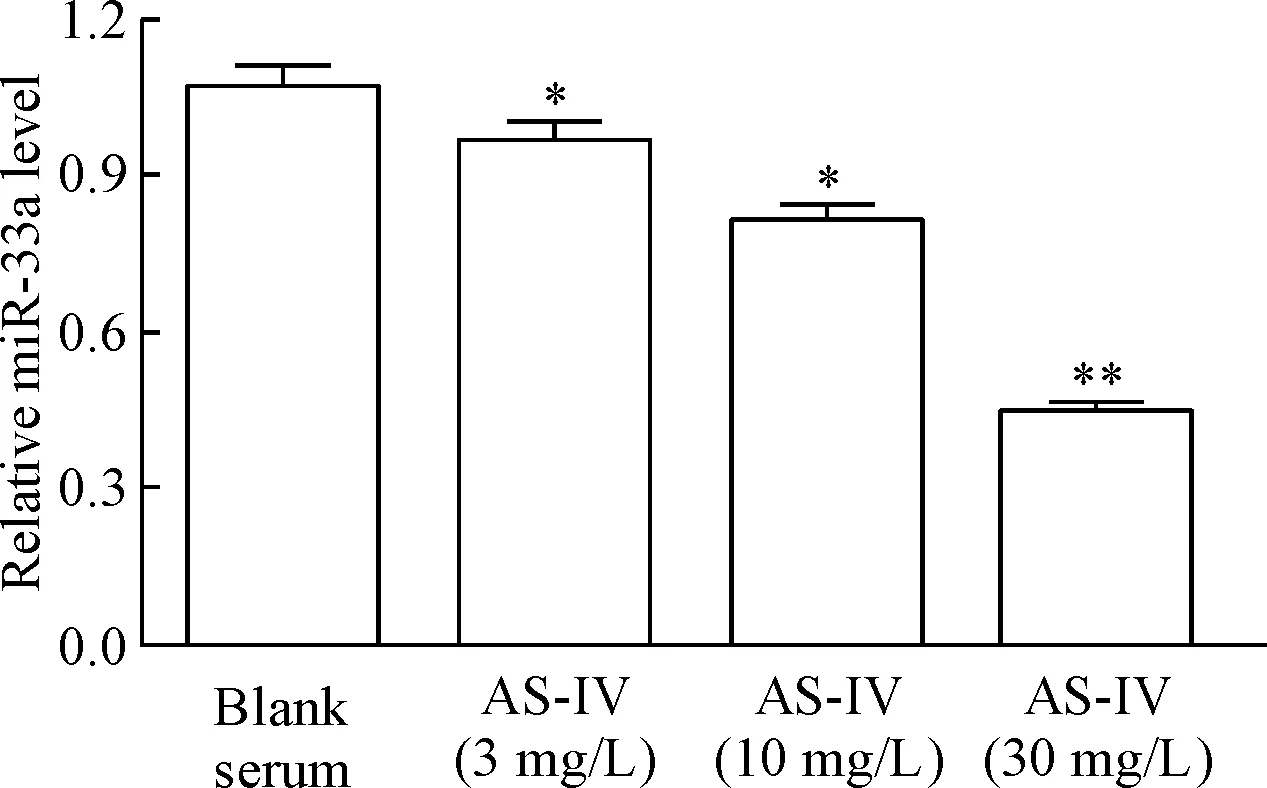
Figure 4.The effect of different concentrations of AS-IV-containing serum on the expression of miR-33a in THP-1 macrophage-derived foam cells. Mean±SD. n=6. *P<0.05,**P<0.01 vs blank serum group.
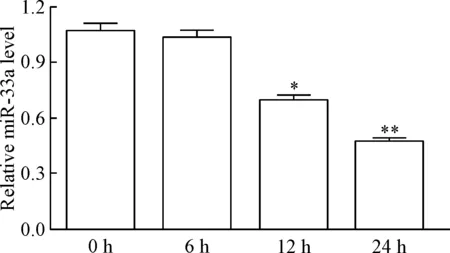
Figure 5.The effect of astragaloside-containing serum on the expression of miR-33a in THP-1 macrophage-derived foam cells for different times. Mean±SD. n=6. *P<0.05, **P<0.01 vs 0 h group.
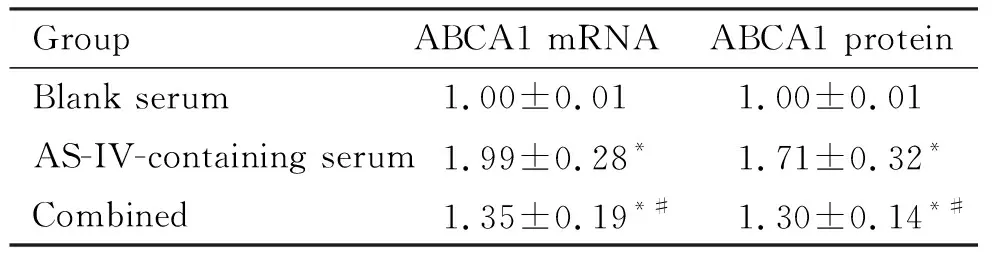
表2 各组THP-1巨噬细胞源性泡沫细胞ABCA1表达水平的比较
*P<0.05vsblank serum group;#P<0.05vsAS-IV-containing serum group.
2.4miR-33a在黄芪甲苷含药血清减少THP-1巨噬细胞源性泡沫细胞脂质蓄积中的作用 油红O结果显示,与空白血清组相比,黄芪甲苷含药血清单独处理组细胞内红色脂滴明显减少,而加入80 nmol/L miR-33a mimic共同处理后,细胞内的红色脂滴又明显增多,见图7。HPLC检测结果显示,与空白血清组比较,黄芪甲苷含药血清处理组细胞内总胆固醇、游离胆固醇和胆固醇酯均明显减少;而联合处理组与黄芪甲苷含药血清处理组相比,细胞内总胆固醇、游离胆固醇和胆固醇酯的含量则明显增加(P<0.05),见表3。
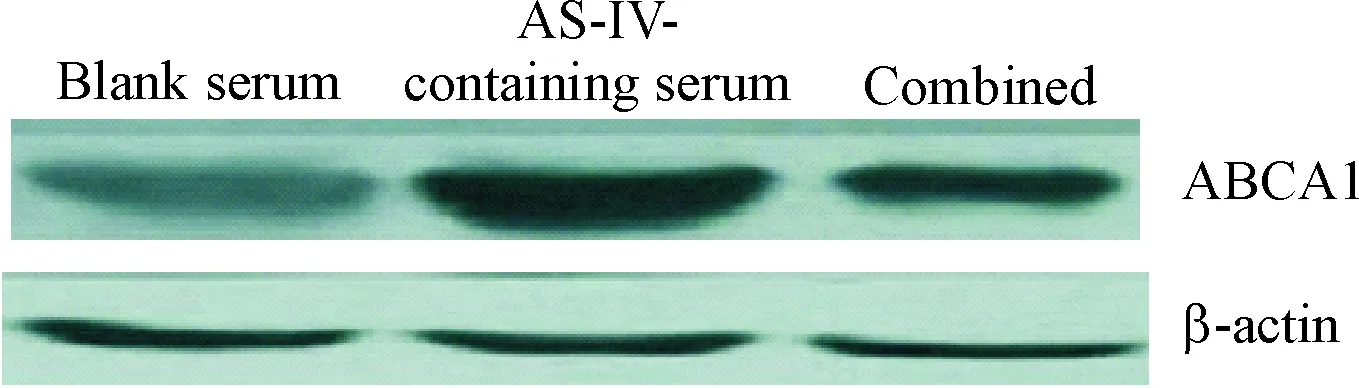
Figure 6.The protein expression levels of ABCA1 in the THP-1 macrophage-derived foam cells of each group determined by Western blot.
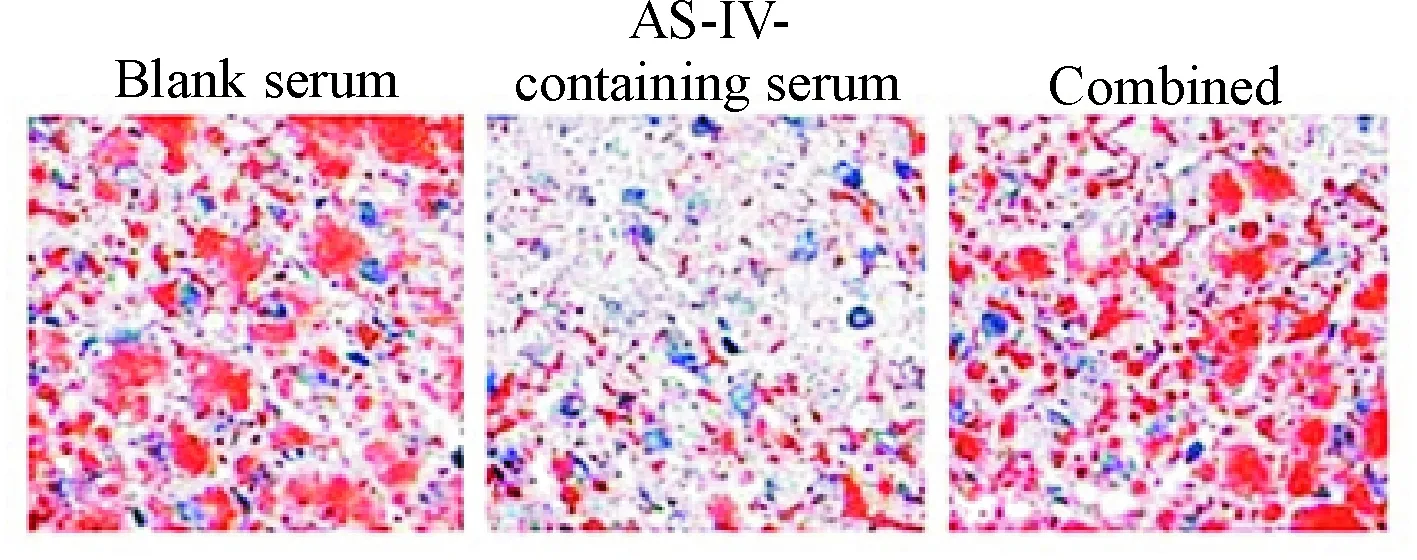
Figure 7.The lipid accumulation of THP-1 macrophage-derived foam cells in different groups (Oil O red staining, ×200).

表3 miR-33a在黄芪甲苷含药血清减少THP-1巨噬细胞源性泡沫细胞脂质蓄积中的作用
*P<0.05vsblank serum group;#P<0.05vsAS-IV-containing serum group.
2.5miR-33a在黄芪甲苷含药血清促THP-1巨噬细胞源性泡沫胆固醇流出中的作用 与空白血清组相比,黄芪甲苷含药血清处理使细胞胆固醇流出明显增加(P<0.05),而加入80 nmol/L miR-33a mimic共同处理细胞后,黄芪甲苷含药血清促胆固醇流出作用被明显抑制(P<0.05),见图8。
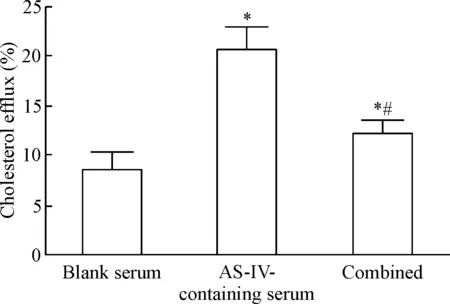
Figure 8.The role of miR-33a in cholesterol efflux in AS-IV-containing serum-induced THP-1 macrophage-derived foam cells. Mean±SD. n=10. *P<0.05 vs blank serum group; #P<0.05 vs AS-IV-containing serum group.
讨 论
动脉粥样硬化是心脑血管疾病最常见病理基础改变,随着AS的病理生理机制研究的深入和化学药物的不断研发与应用,其相关疾病的发病率与死亡率有所下降,然而由于其病理机制的复杂性,临床防治特别是其早期的防治,更需要继续研究,具有深远意义。目前,miRNAs在脂质代谢中的调节作用日益得到重视, miRNAs是一类高度保守的非编码小RNA,它介导的基因表达是机体内一个广泛存在的基因表达调控方式,miRNA通过与靶标基因的3’UTR靶向结合而降解靶基因的mRNA,或靶向结合后抑制蛋白质翻译,最终达到调控基因表达的目的。研究显示,miRNA在心血管系统中高度表达,尤其在AS中起重要的作用[7]。研究表明,参与AS 脂质代谢的miRNA,包括miR-122、miR-370、miR-378/378*、miR-335、miR-27、miR-125a-5p 和miR-33 等[8],靶基因包括ABCA1、NPC1、ABCG1、SREBP和PPARγ等[9],其中miR-33通过调控ABCA1表达,影响胆固醇逆向转运在脂质代谢中发挥重要作用。研究表明,在胆固醇平衡的调节中,miR-33通过靶向ABCA1、ABCG1和NPC1发挥作用[1, 10-11]。
在人体中存在2种miR-33,miR-33b位于第17号染色体SREBP1基因的17号内含子区域,其宿主基因可选择性调控脂肪酸和三酰甘油的合成;miR-33a则位于SREBP2基因的第16位内含子中,其宿主基因控制着细胞内的胆固醇合成和摄取,在哺乳动物体内高度保守,其主要靶基因是ABCA1。ABCA1是介导细胞胆固醇流出的主要膜转运体,研究表明,miR-33a可抑制ABCA1表达,减少细胞内胆固醇流出,导致泡沫细胞的形成[3]。
随着对动脉粥样硬化的研究日渐广泛和深入,中医药的疗效和优势逐渐受到重视,学术界将热点指向如何揭示AS的发展演变及中药防治AS的具体作用机制。黄芪在中国传统医学中应用广泛,尤其是在心血管疾病,黄芪甲苷是自黄芪中提取分离的单体化合物[12],目前,对黄芪甲苷在治疗心血管疾病方面进行了多项研究并取得了一定的进展。本课题组前期研究表明,黄芪甲苷具有改善脂质代谢紊乱,抑制主动脉粥样斑块SDF-1和CXCR4表达含量,抑制主动脉粥样斑块SDF-1和CXCR4 mRNA和蛋白表达,以及抑制骨髓源性内皮祖细胞CXCR4基因和蛋白表达的作用[3]。能够通过调控PI3K/Akt/mTOR信号通路,抑制炎症反应,抑制动脉粥样硬化斑块的形成[4]。
本实验的创新点在于通过观察黄芪甲苷对miR-33a和ABCA1信号表达的调控,促进巨噬细胞内胆固醇流出的作用,从分子、细胞、组织以及动物水平等多层次揭示黄芪甲苷防治AS的分子机制,为AS相关疾病的防治提供新思路。研究结果显示:在不影响细胞活性状况下,黄芪甲苷含药血清呈时间依赖性下调miR-33a表达;黄芪甲苷含药血清能明显上调ABCA1的mRNA和蛋白的表达,但能被转染miR-33 mimic抑制;黄芪甲苷含药血清可减少THP-1巨噬细胞源性泡沫细胞中的脂质蓄积,但能被细胞中转染miR-33 mimic所弱化;黄芪甲苷减少细胞内胆固醇蓄积与其促进细胞内胆固醇流出有关,细胞中转入过量miR-33a可以抑制胆固醇流出。病理观察发现各中药组血管各层结构正常,排列整齐,局部有小灶性的钙化颗粒物沉积,病变轻,斑块小,泡沫细胞和脂质减少,弹力板基本完整,病变程度明显轻于模型组。与模型组相比,黄芪甲苷组小鼠主动脉的miR-33a表达量降低、ABCA1 mRNA和蛋白相对表达量均升高。以上研究结果表明,黄芪甲苷可通过减少miR-33a的生成,进而上调ABCA1表达,促进巨噬细胞中胆固醇流出,这可能是黄芪甲苷抗动脉粥样硬化作用的分子机制之一。
