微波处理对果胶构象的影响
2018-12-26,,,,*
,,, ,*
(1.江西旅游商贸职业学院经济管理学院,江西南昌 330100; 2.南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
果胶是一种广泛存在于高等植物初生细胞壁和中胞层的重要酸性杂多糖,在食品、医药、日化等行业作为添加剂(如凝胶剂、增稠剂、乳化剂等)和功能因子(如预防和减少癌症、抗氧化和促进肠道健康等)被广泛应用[1]。然而日常食品加工过程中的高温、酸碱、酶解及各种机械作用(如高压均质、剪切、静高压、超声等)常导致果胶降解和功能性质下降,进而制约其更大规模的工业化应用[2-3]。另一方面,果胶降解是解析其复杂大分子结构和研究结构与性质间相互关系的重要手段[4]。由果胶降解制备得到的果胶低聚糖也具有更多生理活性[5]。因此,果胶的降解规律和机理备受研究人员的关注。
近年来,微波在各个行业的应用越来越广泛。微波辅助提取技术也已成功用于果胶的提取[6],然而研究发现,微波处理会造成果胶的降解,如Guo等[7]发现,采用超静压提取的果胶分子量为3.06×105Da,而采用微波提取的果胶分子量仅为1.23×105Da。然而,关于果胶微波降解的研究很少探讨微波对果胶分子链构象的影响。果胶为阴离子多糖,其分子链在溶液中会呈现不同的构象(如柔性任意卷曲、紧凑球形和刚性棒状)[8]。多糖的分子链构象除了受到其本身性质如分子质量、分子修饰等的影响,溶剂、金属离子、温度、pH及物理场等外界条件都会对多糖大分子链构象产生影响。Antoniou等[9]研究了多糖在不同溶剂中的构象,结果表明在不同的溶剂中,多糖和溶剂的交联作用不同,从而导致多糖在不同溶剂中有不同的构象。Foschiatti等[10]研究表明,不同阳离子的存在导致了多糖链局部构象的改变。Wang等[11]研究发现,高温可以诱导香菇多糖在NaCl溶液中的构象由三螺旋变为单螺旋,从伸展的链构象变为缠结的链构象。Nilsson等[12]发现,高压均质造成带支链的改性淀粉显著的降解和构象改变。本课题组先前研究发现,微波处理造成果胶分子量的降低和粘度的降低[13]。本文主要通过测定特征粘度,SEC-MALLS法和动静态光散射法测定果胶构象,进一步对微波处理前后果胶构象的变化进行研究和表征,以期为微波处理造成果胶理化、功能性质变化提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
苹果果胶 中国上海Sigma Aldrich公司,半乳糖醛酸含量 71.68%;氯化钠 北京康普汇维科技有限公司 分析纯;叠氮钠 分析纯,杭州百思生物技术有限公司;氯化钠 北京迈瑞达科技有限公司 色谱纯。
EX1103ZH电子分析天平 北京西杰天平仪器有限公司;乌式粘度计 上海正慧工贸有限公司;DW-86L390超低温冰箱 青岛澳柯玛超低温冷冻设备有限公司;2.5 L真空冷冻干燥机 美国Labconco公司;绝对分子量表征系统 美国Brookhaven有限公司;X85-2S型恒温磁力搅拌器 上海梅颖浦仪器仪表制造有限公司;广角静动态光散射仪 美国Brookhaven有限公司;XH-200A电脑微波固液相合成/萃取工作站 北京祥鹄科技发展有限公司。
1.2 实验方法
1.2.1 微波处理果胶 称取果胶溶于100 mL的蒸馏水中,配制质量浓度分别为0.5、1.0、1.5、2.0 g/100 mL(w/v)的果胶溶液,完全溶解后,移入三口烧瓶中,接通冷凝水,在微波条件680 W,100 ℃下,分别处理1、3、5、8、15、20、30 min。原果胶作为对照样。
1.2.2 特性粘度的测定 特性粘度[η]采用乌氏粘度计方法进行测定。将1.2.1中处理的样品首先在-80 ℃冷冻,然后在预冷的冻干机中-80 ℃,0.04 mbar压力下冷冻干燥。所得样品重新溶于0.1 mol/L的NaCl溶液中。先测定溶剂0.1 mol/L NaCl溶液流出毛细管的时间,再取10 mL样品加入乌氏粘度计中,记录溶液从毛细管中流出的时间,用5 mL 0.1 mol/L的NaCl溶液稀释4次至果胶溶液,分别记录其流出毛细管的时间,用哈金斯(Huggins)公式[14](公式1)建立曲线外推至0得样品特性粘度。测定前样品和溶剂均过0.45 μm的水系滤膜,测试在25 ℃的恒温条件下进行。
ηsp/c=[η]+k×[η]2×c
式(1)
式(2)
式(3)
式(4)
式中:ηsp为增比粘度;[η]为特性粘度(dL/g);k为Huggins常数;c为果胶浓度(g/mL);η为果胶溶液粘度(Pa·s);ηs为溶剂粘度(Pa·s);ηr为相对粘度;t1为样品流出时间(s);t2为溶剂流出时间(s)。
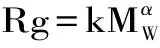
1.2.4 动静态光散射法测定果胶构象 取浓度为20 mg/mL经微波处理不同时间后的果胶溶液,并过0.45 μm的水系滤膜,然后用已过滤膜的NaCl溶液分别稀释至16、12、9、6、4、2、1 mg/mL,在波长633 nm下,选用角度30、45、60、75、90、105、120、135、150 °进行静态测试,得果胶溶液的Zimm图及均方回转半径Rg。
取浓度为20 mg/mL经微波处理不同时间后的果胶溶液,用0.1 mol/L的NaCl溶液稀释至1 mg/mL,波长633 nm,角度90 °进行动态光散射测试,得到果胶溶液的流体力学半径Rh。
计算ρ=Rg/Rh,用于表征分子链的构象,ρ≈0.77时,高分子为球状构象;ρ=1.0~1.1,高分子为松散的高支化链或聚合体;ρ=1.5~1.8,高分子为无规则线圈;ρ>2,高分子为伸展的刚性链[16]。
1.3 数据统计分析
所有实验均重复3次,采用SPSS 19.0中的方差分析(ANOVA)进行差异显著性分析,以p<0.05表示显著性差异。
2 结果与分析
2.1 微波处理对果胶特性粘度的影响
特性粘度是考察多糖构象的一个重要参数,能衡量既定溶剂中被单一聚合物链所占据的流体体积。由图1可看出,随着微波处理时间的延长,特性粘度降低。浓度0.5 g/100 mL的果胶,微波处理5、15、20、30 min,果胶的特性粘度从4.25 dL/g分别降低至3.35、3.10、2.97、2.85 dL/g。随着微波处理时间的延长,分子间热能变高,使果胶降解的程度变大,分子质量变小,其特性粘度也越低[17]。且随着样品质量浓度的增加,特性粘度的降低量减少,在微波处理30 min后,果胶质量浓度分别为0.5、1.0、1.5、2.0 g/100 mL时,样品特性粘度从4.25 dL/g分别降低至2.85、2.94、3.57、3.65 dL/g。果胶质量浓度低,单位分子接收到的能量大,所以容易发生降解[18],造成粘度下降更多。另一方面,果胶浓度越高,分子间的接触及交联程度越大,粘度越高,微波处理后溶液中分子间交联转变的机会更大,其特性粘度减少量更小。因此,在日常加工过程中,发现微波处理后果胶粘度的下降,可能不只是因为果胶的降解,还与果胶构象的变化有关。
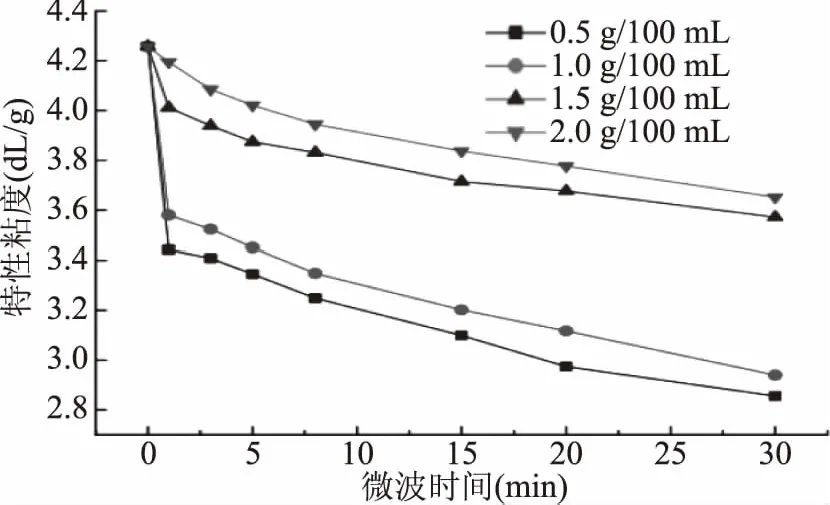
图1 微波处理对不同质量浓度果胶特性粘度的影响Fig.1 Effect of microwave treatment on the intrinsic viscosity of pectin of different mass concentrations
2.2 SEC-MALLS法表征果胶构象
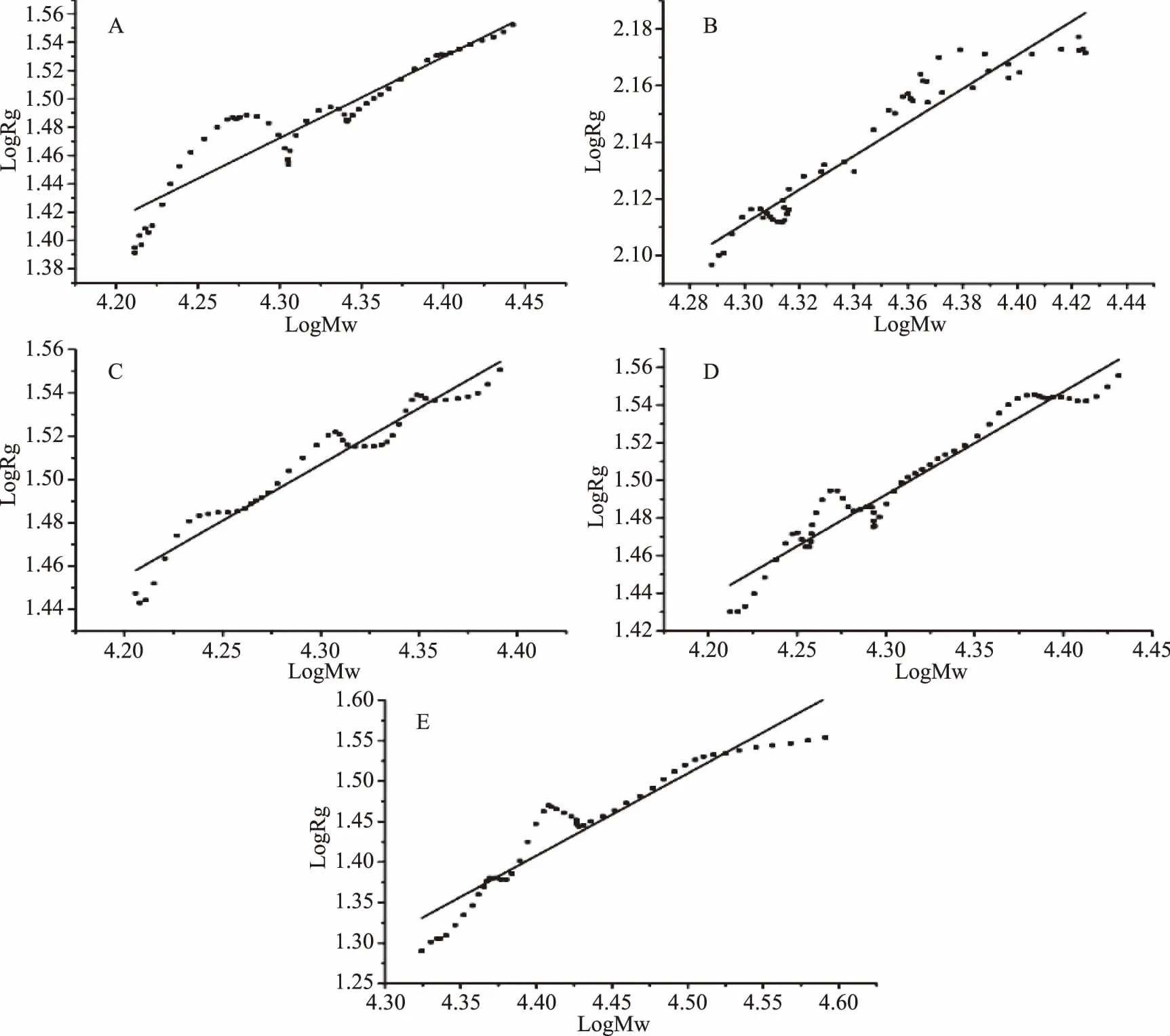
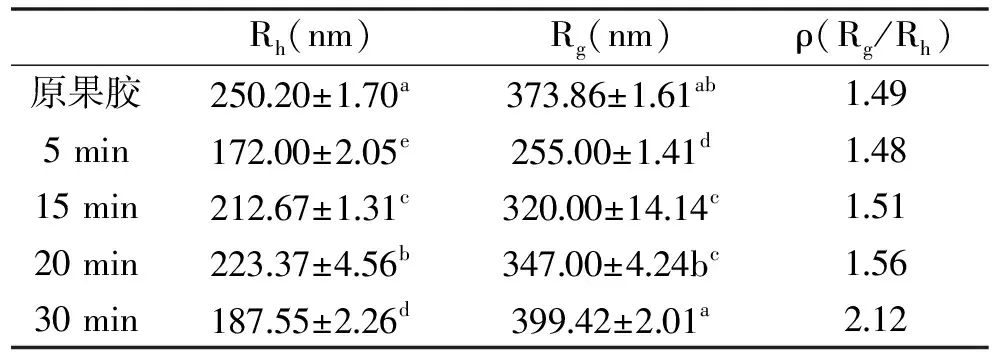
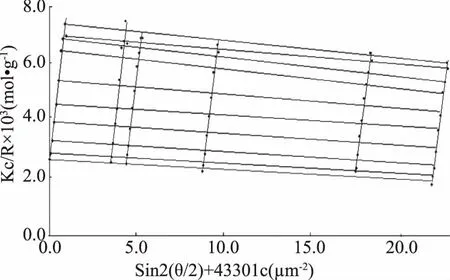
SEC-MALLS法测得的果胶溶液的数均分子量(Mn)、重均分子量(MW)、平均分子量(MZ)、多分散性系数(MW/Mn)和均方回转半径(Rg)如表1所示。从表1中可以看出,随着微波处理时间的延长,果胶的分子质量及Rg均降低,微波处理30 min后,MW由原果胶的31.38×104Da降低至4.76×104Da,证明微波处理导致了果胶的降解。原果胶及微波处理后的果胶Mn、MW及MZ的大小顺序为Mn 表1 原果胶及微波处理不同时间果胶的Mn、MW、MZ、MW/Mn、RgTable 1 The Mn,MW,MZ,MW/Mn and Rg of original pectin and pectin treated by microwave for different period 图2分别为微波处理不同时间后果胶溶液的Rg和MW的双对数图,斜率即为α值。从图2中可以看出,原果胶及微波分别处理5、15、20、30 min后,α值分别为0.57、0.59、0.51、0.54、1.00,表明原果胶及微波处理5、15、20 min后,果胶分子链构象为无规则线圈,而处理时间延长至30 min后,果胶分子的链构象发生改变,变为刚性棒状。这可能是因为长时间微波处理不仅打断了果胶分子的糖苷键,同时还改变了果胶分子间及分子内的交互作用如氢键,从而导致果胶分子的链构象发生改变。 图2 原果胶及微波处理不同时间果胶的Mw和Rg的双对数图Fig.2 Logarithmic plot of the molecular weight(Mw)vs radius of gyration(Rg)of original pectin(A)and pectin treated by microwave for different period注:A:原果胶;B、C、D、E分别为微波处理5、15、20、30 min。 采用静态光散射法测定不同浓度的果胶溶液,经作Zimm图可获得样品的均方回转半径(Rg),再结合动态光散射获得样品的流体力学半径Rh,可计算ρ值,Rg、Rh、ρ值如表2所示。原果胶的Zimm图如图3所示,结合表2可知,原果胶ρ=1.49,以无规则线圈形状存在于NaCl溶液中。微波分别处理5、15、20 min后,ρ分别为1.48、1.51、1.56,仍以无规则线圈存在与NaCl溶液中,构象没有发生变化,微波处理时间延长至30 min后,ρ=2.12,果胶构象变为伸展的刚性链。该结果与SEC-MALLS表征得到的果胶构象变化一致。Tsaih等[19]报道,多糖分子量越小,分子越伸展,刚性越强。本实验中,微波造成果胶分子量降低,当分子量降低到4.76×104Da时,果胶表现出刚性。这可能是由于高分子量果胶更容易团聚或含有更多的中性糖含量,从而更易卷曲,而低分子量果胶则表现得更加具有刚性[20]。由于果胶降解是非可逆过程,因此微波处理造成的果胶构象变化也是不可逆的。另外,采用SEC-MALLS和静态光散射都可以得到果胶的均方回转半径(Rg),对比表1和表2可以看出,使用静态光散射法测得的Rg明显大于SEC-MALLS法测得的结果,这可能是因为SEC-MALLS仅在一个角度、单一浓度下检测,而静态光散射是不同浓度的果胶溶液在不同散射角下测得,该结果与Liu等[15]的报道一致。 表2 原果胶及微波处理不同时间果胶的Rh、Rg及ρ(Rg/Rh)Table 2 The Rh、Rg and ρ(Rg/Rh)of original pectin and pectin treated by microwave for different period 图3 静态光散射所得原果胶溶液的Zimm图Fig.3 The Zimm figure of pectin solution by static light scattering 特征粘度法测定结果表明,微波处理5、15、20、30 min,果胶的特性粘度从4.25 dL/g分别降低至3.35、3.10、2.97、2.85 dL/g,说明随着微波处理时间的延长,特性粘度降低。采用SEC-MALLS法和静动态光散射法表征微波处理后果胶的构象,结果表明,短时间的微波处理对果胶溶液的构象不会产生影响,微波处理30 min后,果胶溶液的链构象由无规则线圈变为刚性棒状。基于果胶“结构-构象-功能”之间的紧密联系,微波处理后果胶构象发生不可逆改变,可能进一步影响其功能性质,这有待进一步的深入探讨。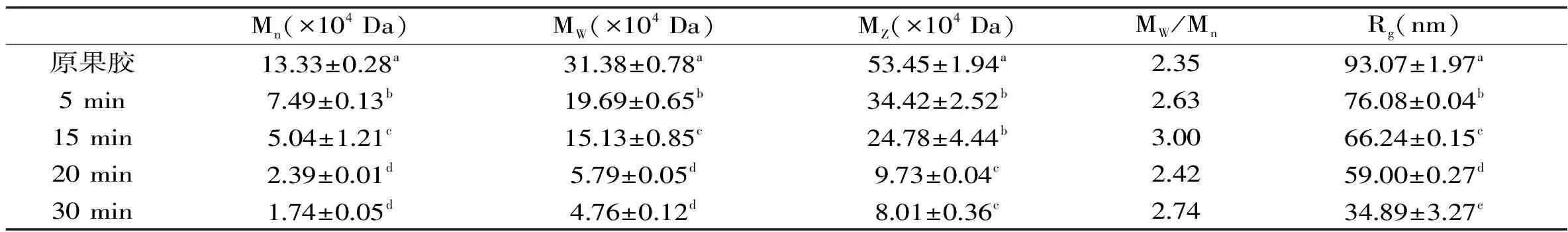
2.3 静动态光散射法表征果胶构象
3 结论
