基于分子印迹膜共振能量转移电化学发光法测定扑热息痛
2018-12-25,,,,
, , , ,
(巢湖学院化学与材料工程学院,安徽巢湖 238000)
在电化学发光(ECL)共振能量转移(RET)过程中,供体电化学发光试剂在电位作用下,通过非辐射相互作用将能量转移给合适的受体,使其产生发光,因背景干扰小、可控等特点而备受关注[1]。但其能量转移效率取决于供体与受体之间距离[2 - 4]。分子印迹(MI)技术是一种以目标分子为模板,制备对该分子具有特异识别功能的聚合物膜技术[5 - 6]。在电化学发光共振能量转移体系中,可用聚合物膜使供体和受体保持一定的距离,从而使共振能量保持高的转移效率,所构建的体系兼具有分子印迹的特异性及电化学发光共振能量转移的高灵敏度等优点[7 - 8]。

1 实验部分
1.1 仪器与试剂
MPI-E电致化学发光分析系统(西安瑞迈分析仪器有限公司);CHI660E电化学工作站(上海辰华仪器有限公司);T9CS紫外-可见分光光度计(北京普析通用仪器有限责任公司);三电极体系:玻碳电极(GCE,d=4mm)或分子印迹聚合物(MIPs)电极为工作电极,铂丝电极为对电极,Ag/AgCl电极为参比电极;JA2003电子分析天平(上海菁海仪器有限公司);KS-7200DE液晶超声波清洗器(昆山洁力美超声有限公司)。
邻二苯胺(o-PD)、K3[Fe(CN)6]、CdCl2、Te粉、NaBH4、L-半胱胺酸(L-Cys)(国药集团化学试剂有限公司);氯化三联吡啶钌(Ru(bpy)3Cl2·6H2O)、扑热息痛(PR)、三正丙胺(TPR)(上海阿拉丁生化科技股份有限公司);5.0%Nafion溶液(美国Dupont公司)。实验所用试剂均为分析纯。实验用水为二次蒸馏水。
1.2 实验方法
1.2.1CdTeQDs的合成参考文献方法[10],采用水热法合成CdTe QDs。将0.025 g Te粉和0.1 g NaBH4置于5 mL单口圆底烧瓶中,加入3 mL水,冰水浴中反应2 h可得淡紫色的NaHTe前驱体。在50 mL三口圆底烧瓶中分别加入0.086 g CdCl2和0.083 g L-Cys,用1 mol·L-1NaOH溶液调节混合液的pH值至10左右,氮气驱氧20 min。然后注入新制备的NaHTe溶液,回流2.5 h即可得CdTe QDs溶液。

1.2.3检测方法采用三电极检测体系,底液为0.02 mol·L-1K3[FeCN6]溶液(含0.1 mol·L-1KCl)。采用循环伏安(CV)法、交流阻抗(EIS)法对MIPs电极进行表征。采用同样三电极装置,底液为含0.1 mol·L-1TPA的5 mL 0.05 mol·L-1PBS( pH=7.0),再向底液中加入10 μL CdTe QDs。电化学发光法测定的电位范围为0~1.4 V,扫速为100 mV·s-1,负高压为-500 V。每次测量后,将电极浸入甲醇/乙酸(体积比8∶1)溶液中洗脱模板分子PR 8 min,以进行下一次测量。
2 结果与讨论

图1 CdTe QDs的透射电镜(TEM)图Fig.1 TEM image of CdTe QDs
2.1 CdTe QDs的表征
图1为所合成的CdTe QDs的透射电镜(TEM)图。由图可以看出,CdTe QDs为分散良好的球形颗粒,粒径在3 nm 左右。
2.2 电化学发光共振能量转移机理

图2 CdTe QDs的紫外-可见(UV-Vis)吸收光谱(a)和的电化学发光(ECL)光谱(b)Fig.2 UV-Vis absorption spectra of CdTe QDs(a) and ECL spectrum of 1.0×10-4 mol·L-1
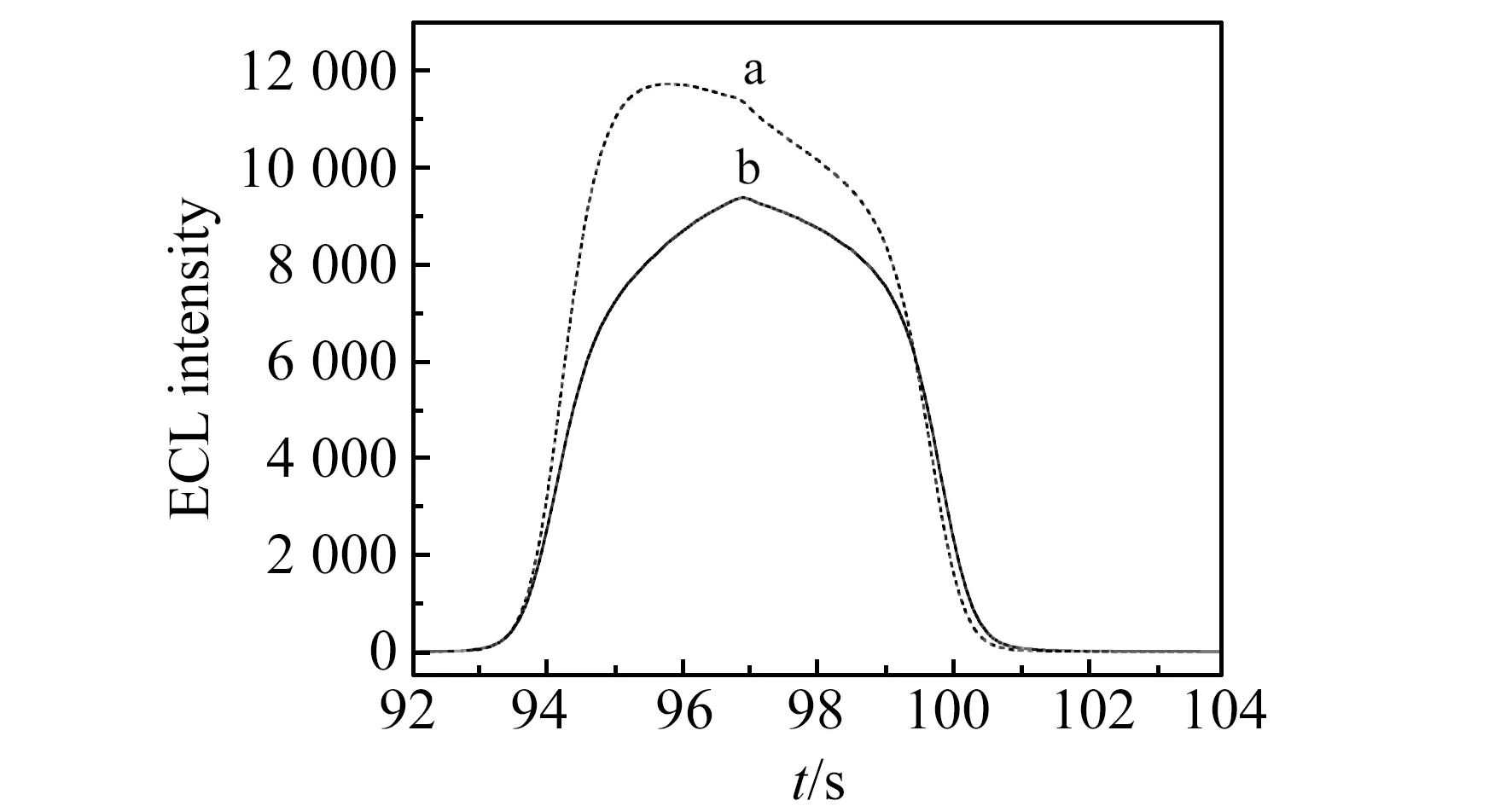
图3 滴加CdTe QDs前后体系在0.05 mol·L-1 PBS(pH=7.0,含0.1 mol·L-1 TPA)中的电化学发光(ECL)光谱Fig.3 ECL spectrum of system before(b) and after(a) addition of CdTe QDs in 0.05 mol·L-1PBS(pH=7.0) solution containing 0.1 mol·L-1 TPA
2.3 分子印迹膜表征



图4 不同电极在0.02 mol·L-1 K3[FeCN6](含0.1 mol·L-1 KCl)中的循环伏安图Fig.4 Cyclic voltammograms of different electrodes in 0.02 mol·L-1 K3[FeCN6] solution containing 0.1 mol·L-1 KClThe bare GCE(a),immobilized by removal of PR(c),after interaction with 1.0×10-1 mol·L-1 PR(d),after electropolymerization(e) and NIPs electrode(f).

图5 不同电极在0.02 mol·L-1 K3[FeCN6](含0.1 mol·L-1 KCl)中的交流阻抗图Fig.5 Electrochemical impedance spectroscopy of different electrodes in 0.02 mol·L-1 K3[FeCN6] solution containing 0.1 mol·L-1 KClThe bare GCE(a),immobilized by removal of PR(c),after interaction with 1.0×10-1 mol·L-1 PR(d),after electropolymerization(e) and NIPs electrode(f).
2.4 实验条件的优化
2.4.1洗脱液及洗脱时间的选择分别考察了乙酸、乙醇、甲醇-乙酸(体积比1∶8、8∶1)对PR的洗脱效果。结果发现,用甲醇-乙酸(体积比1∶8)进行洗脱效果较好,随时间延长PR因溶出而留下印迹空穴越多,电化学发光值不断增大,8 min后其值不再增大且峰形规整,表明PR全部溶出。实验选择甲醇-乙酸(体积比8∶1)为洗脱液,洗脱时间为8 min。
2.4.2培育时间的选择将洗脱后的MIPs电极置于1.0×10-10mol·L-1PR溶液中,结果发现培育时间在10 min内,因印迹空穴不断重新被模板分子占据,电化学发光值不断降低,但10 min以后其值基本保持不变,表明电极表面印迹空穴被模板分子占据,达到平衡。故实验培育时间选择为10 min。

2.5 工作曲线
在优化条件下进行电化学发光检测,结果表明当PR浓度在1.0×10-13~1.0×10-9mol·L-1范围时,电化学发光变化值与PR浓度的对数值呈线性关系,线性方程为:ΔI=3130.4lgc+42159,相关系数R=0.9953,检测限为0.42×10-13mol·L-1。
2.6 干扰考察
在优化条件下,考察了药品中常见共存物质葡萄糖、苯酚、柠檬酸、抗坏血酸及多巴胺对测定PR的影响。结果表明,误差范围在5%以内,100倍浓度的以上物质对目标物测定均不产生干扰,说明方法对PR测定具有较好选择识别性。
2.7 稳定性与重现性
MIPs电极在1.0×10-10mol·L-1PR溶液中平行测定10次,其相对标准偏差(RSD)为3.4%,表明电极具有良好的重现性。电极放置一周后,MIPs电极的电化学发光值降至93.6%,且电极连续重复使用3次后,其电化学发光值减小11.6%,表明该电极具有良好的稳定性。
2.8 实际样品的检测
选用白加黑镇痛剂三片,研磨至细粉。准确称取适量药粉,用0.05 mol·L-1PBS(pH=7.0)溶解并定容于50 mL容量瓶中,分别进行药品含量及回收率测定。其检测结果见表1,回收率在95.8%~103.9%之间。

表1 回收率测定结果
