荧光定量PCR辐照食品鉴定技术的优化研究
2018-12-25刘绵学伏毅郑宇王艳潘琳李华黄敏
刘绵学 伏毅 郑宇 王艳 潘琳 李华 黄敏
(1. 四川省原子能研究院辐照保藏四川省重点实验室,成都 610101;2. 四川省原子能研究院生物技术研究所,成都 610101)
辐照食品鉴定是指通过物理、化学及生物原理[1]对食品是否接受辐照,以及评估其接受的辐照剂量的技术方法[2],其应用领域为食品卫生监督部门及检验检疫部门等[4-5]。根据Akram等[3]描述,一种理想的辐照鉴定技术,需要在辐照或其它方式处理后的细微变化中,提供辐照专属的、敏感的、可重复的、具有剂量相关性且稳定的检测结果。由于辐照处理通常会造成细胞DNA的双链断裂现象(Double strand break,DSB)[7],基于DSB识别的辐照鉴定方法称为“DNA变异法”[8]。近年来研究者将荧光定量PCR(Realtime PCR)方法引入辐照鉴定[9-11],通过完整模板留存量鉴定辐照导致的DNA分子损伤,具体方法为通过持家基因(House-keeping gene,HK)引物的初始循环数变化值来评估辐照剂量。该技术初期用于辐照食品中的有害微生物(金黄色葡萄球菌[12]、沙门氏菌[13]和创伤弧菌[11])的灭菌效果验证,因发现辐照剂量和检测结果存在相关性[12],开始用于海鱼的辐照鉴定工作[14]。相较于现行国标“彗星DNA法”,其优势在于检测位点数量级增加,可进行辐照剂量评估。尽管如此,该方法仍存在不足之处:(1)无假阳性样本鉴别功能;(2)不同样本之间若DNA模板加入量存在差异,会干扰初始循环数与辐照剂量之间的对应关系。综上,辐照鉴定中荧光定量PCR技术具有较好的发展潜力,但需要更好的方法优化。
引物对应序列分布数是决定荧光定量PCR检测效果的重要因素之一[13],分布数越高,检测灵敏度越高。已有报道[15]植物基因组中逆转座子分子标记的重复性和特异性优于简单序列重复间区域(inter-simple sequence repeat,ISSR)和随机扩增多态性DNA分子标记(Random amplified polymorphic DNA,RAPD),但尚无将其应用于辐照鉴定技术的报道。本研究将长末端重复序列(Long terminal repeat,LTR)反转录转座子(Transposable Elements,TE)引物引入荧光定量PCR辐照鉴定方法,拟获得以下优化效果:提供假阳性样本甄别能力,减少因初始模板量差异导致的结果干扰,强化剂量标准曲线的线性关系。为达到以上目标,本研究以马铃薯(Solanum tuberosum)切片为实验材料,通过多引物体系筛选、转座子状态分析、DNA损伤特征分析和剂量回归分析等方法,探究TE引物应用及方法优化对该鉴定方法的优化效果。该辐照鉴定方法的构建与优化,对辐照食品监管及检验检疫相关领域具有重要的现实意义。
1 材料与方法
1.1 材料
选择四川新鲜马铃薯作为实验材料。挑选100-200 g块茎洗净,统一切为半圆形切片(厚度约5 mm),使用透明PE食品袋真空封装。DNA提取使用 OMEGA 公司 HP Plant DNA Kit(D2485-01)。定量PCR预混液购自Bio-Rad公司SsoFastTMEvaGreen Super Mix,引物由北京擎科生物合成,一般分析纯生化试剂购自成都科龙化工。
主要仪器:Multipette stream电动分液器,德国Eppendorf公司;Echotherm恒温震荡器,美国Torrey Pines Scientific公司;设计装源量200万Ci自动化60Co-γ射线辐照装置;5804r离心机,德国Eppendorf公司;Scandrop100核酸蛋白分析仪,德国耶拿公司;CFX-96 Real-time System,美国Bio-Rad公司。
1.2 方法
1.2.1 样本处理 加热和冻融是非辐照DNA损伤产生的主要原因,为区分辐照样本和假阳性样本的DNA损伤差异,采用了3种处理方式:(1)不同块茎的马铃薯切片进行Co60γ射线辐照处理,辐照剂量梯度设定为 0.5、1、2、4、6、8、10 kGy[16],每个剂量3个切片样本,分别使用剂量片计量每个梯度的真实剂量,样品编号设定为A1-A21。(2)不同块茎的马铃薯切片进行95℃水浴处理,水浴时间分别为1 min、2 min和3 min,每种处理各3个重复,样本编号H1-H9。(3)冻融处理样本使用-40℃保存10 min后转入20℃ 10 min,分别反复“速冻-解冻”3次、4次和6次,每种处理3个重复,样本编号F1-F9。另取未处理马铃薯切片作为对照,编号为CK1-CK9。以上样本均参照试剂盒说明书进行DNA提取,提取液65℃金属浴挥发10 min,去除乙醇残留,-20℃保存备用。
1.2.2 引物筛选 从Nucleotide数据库检索马铃薯持家基因18s、12s、gapdh、actin序列,从马铃薯转座子序列数据库(http://solanaceae.plantbiology.msu.edu/pgsc_download.shtml)检索转座子序列ltr1、ltr2,使用NCBI网站引物设计工具Primer-Blast进行引物设计和筛选(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHome), 共 获得HK引物与TE引物13对(序列来源见表2)。
参照胡广[17]操作步骤,取DNA模板CK1,测试待测引物扩增效率En。反应体系为10 μL,模板0.2 μL,预混液 5 μL,引物体系(1+1)μL,每种体系4个方法学重复。PCR程序为95.0℃ 2 min,95.0℃5 s,复性延伸60.0℃ 30 s,40次重复,95.0℃ 5 s,溶解曲线温度范围65-95℃,升温速度0.5℃/5 s。
取DNA模板A19-A21和CK1-CK3,检测待测引物的相对重复系数(Relative repeatability index,RRI)和相对辐照敏感系数(Relative sensibility index,RSI)。两种系数的定义公式分别为RRIB=(1+En)△CT0(A,B),RSIB=(RRI-(1+En)△CTD(A,B))/D,其中△CT0(A,B)为未辐照模板中不同引物A,B间的初始循环数差值;△CTD(A,B)为辐照模板中不同引物A,B间的初始循环数差值。根据测试结果,按照定义公式计算各引物模板的RRI和RSI值,并按照以下标准进行TE引物筛选:
(1)将初始循环数最低引物设定为参照引物,参照引物的RRI和RSI值均为1;(2)计算其余引物的RRI和RSI值,排除其中RRI> 512的引物;(3)选择RSI值相同或最接近的两个引物对作为鉴别引物组合;(4)选择RSI值差异最大两个引物对作为剂量评估引物组合。
1.2.3 转座子状态分析 参照1.2.2步骤PCR体系,分别使用辐照鉴定引物组合对未辐照马铃薯DNA模板CK1-CK9进行定量PCR检测。使用“ 单样本t检验”分析结果中各组的差异性,分析选择的转座子序列状态是否稳定。
1.2.4 方法检出限分析 参照1.2.2步骤反应体系,分别使用获得的筛选引物体系检测20个未辐照马铃薯DNA样本,检测初始循环数计算空白标准偏差(循环数),参照国标GBT5009.1-2003《食品卫生检验方法 理化部分 总则》附录A方法[18]计算优化鉴定方法的检出限。
1.2.5 DNA损伤特征分析 参照1.2.2步骤反应体系,对辐照样本(A1-A21)和假阳性样本(F1-F9、H1-H9)进行鉴定,比较不同处理方法导致的DNA损伤差异。计算测试样本的 ΔΔCTD(A,B)值(A,B为引物组合),计算公式如下:
ΔΔCTD(A,B)=(CTD(B)-CT0(B))-(CTD(A)-CT0(A))
=(CTD(B)-CTD(A))-(CT0(B)-CT0(A))
其中,CTD(A)、CTD(B)分别为处理条件下引物 A、B 的初始循环数平均数,(CT0(B)- CT0(A))为未处理样本初始循环数平均数。计算样本A1-A21,F1-F9、H1-H9 的 ΔΔCTD(P1,P2)、ΔΔCTD(P3,P4)值。使用纵坐标 ΔΔCTD(P1,P2)与横坐标 ΔΔCTD(P3,P4),进行散点图分析,归纳不同处理方法的数据点分布特征。
1.2.6 数据统计分析 所有定量PCR结果均采用Bio-Rad CFX Manager 3.1进行数据读取,使用Livak的2-ΔΔCT方法[19]进行相对定量模板分析,使用GraphPad Prism 6.0对测定结果进行数据分析。
2 结果
2.1 剂量测定
使用重铬酸钾(银)化学剂量计测定实际剂量(误差5%),结果如表1。除0.5 kGy与10 kGy剂量偏高外,基本符合设计剂量梯度。
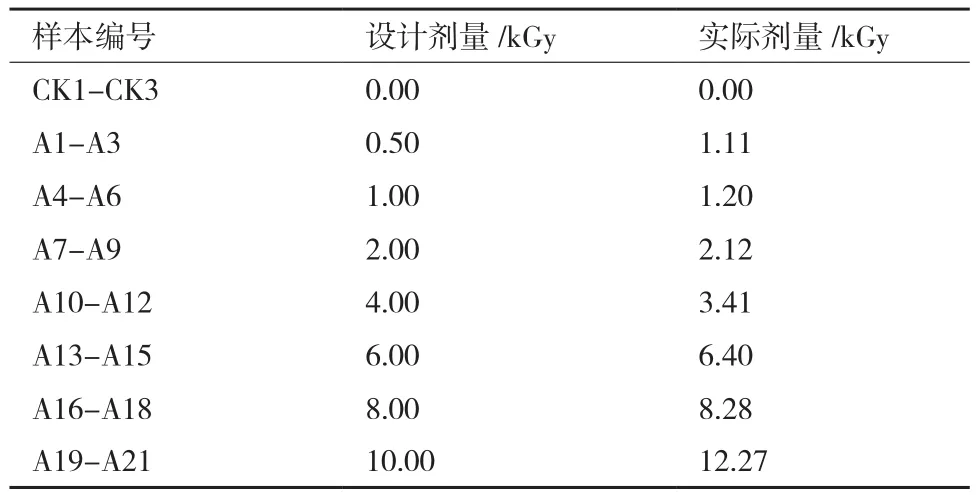
表1 辐照组样本实际剂量
2.2 引物筛选结果
参选引物的RRI、RSI值与扩增效率结果如表2。由表2可知,TE引物中RRI值最高为LTR2-5,因此将LTR2-5设定为基准引物,其RRI和RSI值均设定为1。根据1.2.2筛选条件,最终筛选获得的引物体系为:(1)样本鉴别引物组合:P1为LTR2-5,P2为 18S-8;P3为 LTR2-2,P4为 ACT-5;(2) 辐照鉴定引物组合:P5为LTR2-5,P6为18S-5。其中引物LTR2-5同时作为P1和P5。
2.3 转座子状态结果
如表3和表4所示,在未辐照马铃薯DNA样本中,△ CT(18S-8,LTR2-5)值与△ CT(ACT-5,LTR2-2)值分别在各自组内无明显差异,说明LTR2-5对应的逆转座子序列分布稳定,无明显转座活性。

表2 供筛选引物序列及参数
2.4 方法检出限结果
根据步骤1.2.4,P1-P2空白标准偏差为0.20,方法检出限为0.60;P1-P2空白标准偏差为0.13,方法检出限为0.39;P5-P6空白标准偏差为0.06,方法检出限为0.18。
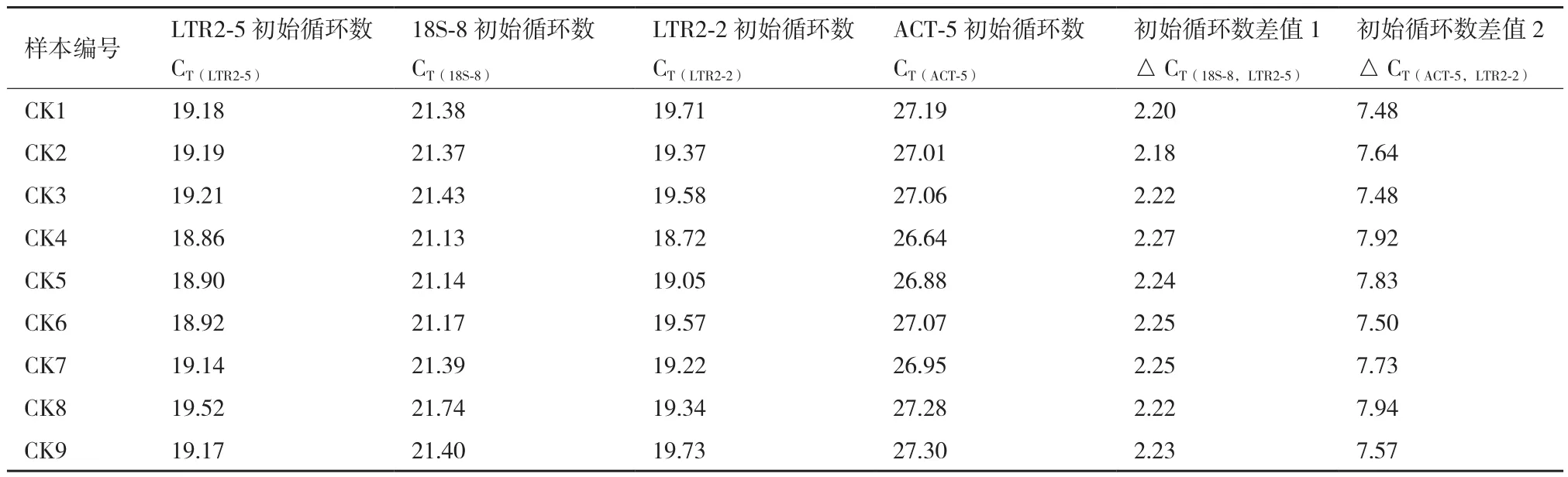
表3 模板分布频率的稳定性分析

表4 单样本t检验
2.5 DNA损伤特征结果
样本A1-A21,F1-F9、H1-H9的数据点分布如图1所示。从图1可知,辐照组样本(A1-A21)数据点的纵轴值 ΔΔCTD(P1,P2)均小于 0.60(P1-P2 方法检出限),横轴值 ΔΔCTD(P3,P4)均小于 0.39(P3-P4方法检出限),不同辐照样本中DNA损伤位点的相对分布频率具有一致性,不受辐照剂量变化(1-12 kGy)的影响。相对于辐照组样本,加热组(H1-H9)和冻融组(F1-F9)样本数据点中纵坐标或横坐标值大于对应方法检出限,呈现为相对于原点的离散分布。根据图1中辐照和干扰样本数据点的分布规律,这种一致性差异与处理方式本身或具有高度关联性。
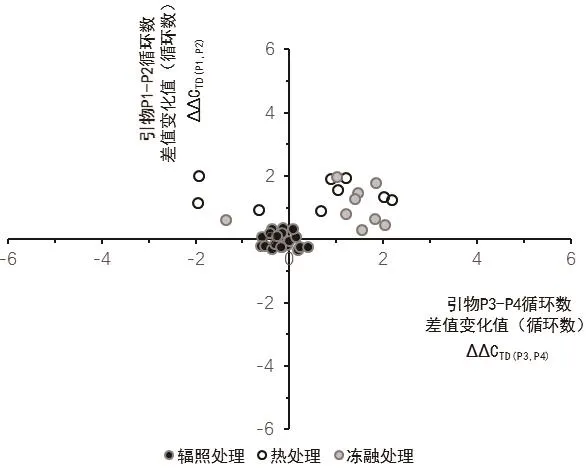
图1 辐照处理引发的DNA损伤特征
2.6 剂量回归分析结果
样本 CK1-CK3 与 A1-A21 的 ΔΔCTD(P5,P6)与辐照剂量D的相关性结果如图2所示。由图2可知,辐照样本的ΔΔCTD(P5,P6)值随辐照剂量D增加而增加,呈正相关关系;而在ΔCTD(P5,P6)值上,呈现为随剂量D增加而减小的负相关性。因此,分别使用ΔΔCTD(P5,P6)、ΔCTD(P5,P6)的 2 为底的指数函数值以及单引物LTR2-5和18S-5的ΔCTD值,与对应的辐照剂量进行线性回归分析,获得多种剂量标准曲线。

图2 辐照剂量与循环数相关性
单独TE引物LTR2-5或HK引物18S-5[20]的标准曲线中,R2分别为93.65%和92.45%(图3-C);而根据循环数差值/变化数的指数函数值获得的线性关系均进入显著区间(>99%)(图3-A、B),其中图3-B中使用ΔCTD值的线性关系最优(R2=99.24%),说明该回归模式更符合剂量-效应的实际对应关系。
3 讨论
本研究发现,RSI值相同或相近的引物(LTR2-5/18S-8、LTR2-2/ACT-5)之间,其初始循环数差值的变化值保持恒定,不受辐照剂量大小影响。而RSI值差异较大的引物(LTR2-5/18S-5),其初始循环数差值的变化值与剂量D成正相关关系。因此,DNA序列本身特性的RSI值,决定了不同引物间初始循环数差值的变化值是否会随剂量变化而变化,该结论与李文建等[21]的报道一致。
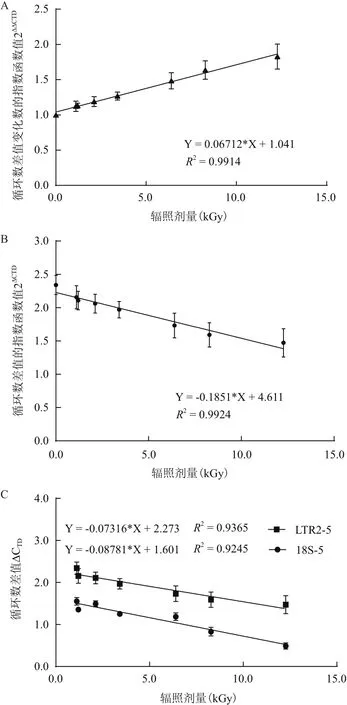
图3 不同引物体系的剂量回归函数
根据已知结果,荧光定量PCR辐照鉴定优化方法可归纳为以下5个步骤:(1)检测未辐照样本,获得引物(P1-P5)的循环数结果,计算 CT0(P1,P2)、CT0(P3,P4)、CT0(P5,P6)的空白标准偏差和对应检出限;(2)检测梯度剂量辐照样本,分别获得ΔCTD(P5,P6)以2为底的指数函数值,通过回归分析获得该样本“剂量-循环数差值指数函数”标准曲线;(3)检测待优化后鉴定体系构成为“五引物,双模板(辐照与未辐照)”。其中TE引物的分布数高于HK引物,这与Mrigaya和Paz等[22-23]报道相符。引物LTR2-5对应模板为马铃薯逆转录转座子酶蛋白质假设亚基编码序列ty3-gypsy[24],从属于马铃薯基因组中7个超级重复基因家族之一的LTR/Gypsy[25]。LTR/Gypsy基因家族的片段在所有染色体均有分布[22],呈现出比HK引物更高的检测灵敏性。研究采用2组引物(4对)进行假阳性甄别,排除了可能的干扰现象(图1)。理论上3组(6对)引物能达到更好的假阳性样本辨识效果,但会大幅度降低测试通量。
研究的优化点包括:(1)根据引物模板的RSI值来筛选引物,消除辐照敏感度差异对鉴定结果的影响;(2)使用高度重复的TE序列作为检测标记物;(3)使用引物之间的初始循环数差值来对应辐照剂量变化,消除模板差异带来的偏差;(4)优化剂量线性关系中初始循环数的函数模型。
技术优势在于:(1)TE引物模板分布频率高于HK引物,提高了检测灵敏度;(2)使用相对比例,消除了DNA模板量差异对鉴定结果的影响;(3)使用优化后的剂量标准曲线进行剂量分析。该方法与随机引物扩增多态性DNA[26](Random amplified polymorphic DNA,RAPD)相比,功能上均可进行DNA的辐照损伤鉴定[27-28],但RAPD检测结果为凝胶电泳谱带,需仪器观察,且不能辨识辐照样本;本方法结果为初始循环数差值,可直接量化分析,操作上更为简便直观。下一步工作中将通过构建多重探针体系[29],提高检测效率,扩大其适用范围。
4 结论
测样本,获得5种引物(P1/P5、P2、P3、P4和P6)的循环数结果,计算3种引物组合的循环数差值的变化数 ΔΔCTD(P1,P2)、ΔΔCTD(P3,P4)和 ΔΔCTD(P5,P6);(4)定性鉴定 :若样本的 ΔΔCTD(P1,P2)、ΔΔCTD(P3,P4)其中之一大于或等于对应检出限,判定为假阳性样本;若两个值均小于对应检出限,则为正常样本;正常样本中 ΔΔCTD(P5,P6)大于对应检出限的,判定为辐照样本 ;(5)剂量分析 :基于样本的 ΔCTD(P5,P6)值,通过步骤2的“剂量-循环数差值指数函数”的标准曲线进行剂量评估。
应用转座子重复序列引物,对辐照鉴定定量PCR技术进行了方法优化,筛选得到包含转座子引物在内的“五引物,双模板”的鉴定体系。该优化方法可甄别加热、冻融处理的假阳性样本,消除模板差异影响,增强了荧光定量PCR辐照鉴定技术的“剂量-效应关系”。
