活化素B促进皮肤伤口部位血管的再生
2018-12-20武薇曾惠昆张敏张琳
武薇 曾惠昆 张敏 张琳
南方医科大学基础医学院组织与胚胎学教研室(广州 510515)
皮肤创伤修复是一个在时空上均受修复因子调控的复杂生物学过程,多种生物活性物质在创伤愈合的不同阶段发挥重要的调节作用[1]。其中组织修复阶段形成的肉芽组织在皮肤伤口愈合过程中具有重要的作用,其形成可以填充伤口,机化异物,促进伤口再上皮化等。而在伤口愈合的早期,肉芽组织中血管新生的多寡及质量是影响创面愈合效率和疾病转归的关键环节之一[2]。血管再生的调控是调节创伤愈合速度的关键环节,目前已证实促进创伤部位血管形成的生长因子有成纤维细胞生长因子、血小板源生长因子(platelet derived growth factor,PDGF)、血管内皮细胞生长因子以及转化生长因子(transforming growth factor⁃β,TGF⁃β)等[3-4]。目前已有研究表明TGF⁃β对血管再生起着重要的调控作用。在血管再生模型中,根据TGF⁃β1含量的不同,它起着复杂的抑制或刺激作用。外源性TGF⁃β1刺激微血管向内生长和分化,在创伤愈合过程中,新生血管形成肉芽组织中见有内源性TGF⁃β1表达[5]。那么作为TGF⁃β超家族成员之一的活化素B(Activin B)[6],对血管的新生有何作用,目前尚不清楚。本课题组前期的研究发现Activin B在活体水平促进伤口周围角质形成细胞的增殖迁移,提高皮肤创伤愈合率,促进伤口的再上皮化[7]。但是Activin B对伤口愈合过程中其他生物学事件有何作用尚不清楚,本研究将探讨Activin B在活体水平对小鼠皮肤创伤愈合中血管再生的影响,采用小鼠全层皮肤切除模型,观察Activin B对创面修复过程中肉芽组织增生的情况以及血管的再生,为细胞因子Activin B的治疗应用提供研究基础。
1 材料与方法
1.1实验动物SPF级C57BL/6小鼠20只,6~8周,雌性,体质量20~25 g,由自南方医科大学实验动物中心提供,标准动物饲料喂养。
1.2仪器设备和试剂细胞因子Activin B购自R&D公司。CD31购自Abcam公司,α-平滑肌肌动蛋白(α-smooth muscle actin,α⁃SMA)、Sabc二抗试剂盒(生物素化羊抗小鼠IgG、链霉亲和素-生物素-过氧化物酶复合物)和3,3-二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒购置武汉博士德公司。石蜡包埋机、切片机和烤片机,购自德国Leica,Leica正置显微镜购自德国Leica,皮肤微循环检测仪(深圳市生强科技有限公司)。
1.3 实验方法
1.3.1小鼠皮肤创伤模型的制备20只C57BL/6小鼠,2%戊巴比妥钠腹腔注射麻醉,小鼠背部两侧剪毛后用蜂蜜脱毛冻蜡脱毛,碘酒酒精常规消毒,在小鼠脊柱两侧采用直径8 mm的打孔器各制备1个圆形全层皮肤缺损模型。术后动物自由进食、水。
1.3.2给药每只C57BL/6小鼠左边为Activin B组,在创口四周皮下注射Activin B(10 ng/mL),每次0.2 mL,每天2次。右边为PBS组,在创口四周皮下注射pH值7.4的无菌PBS,每次0.2 mL,每天2次。单只分笼饲养,整个实验期间创口均为自然暴露状态。
1.3.3创面愈合检测每天观察伤口愈合情况,并使用数码相机记录第0、3、5、7天伤口部位愈合情况,IPP图像分析系统计算创面愈合率,愈合率=(原始创面面积-未愈合的创面面积)/原始创面面积×100%。
1.3.4创面血管观察分别于伤后第3、5、7天断髓处死小鼠,将创面及创面周围1 cm皮肤从深筋膜下方掀起并取下,用手电作光源,进行创面透光试验,观察血管情况并拍摄记录。
1.3.5组织学检查及免疫组化分析于伤后第3、5、7天断髓处死小鼠,对创口及创口周围1 cm皮肤取材,用4%的多聚甲醛液固定,石蜡包埋,切片。HE染色检测中,将石蜡切片进行二甲苯脱蜡,酒精梯度水化,苏木素染核,流水冲洗,自来水泛蓝,用伊红染胞质,酒精梯度脱水,最后二甲苯透明后封片,在光学显微镜观察伤口愈合情况及肉芽组织的生长及血管再生情况。免疫组化检测,石蜡切片二甲苯脱蜡,酒精梯度水化,置于0.1 mol/L枸橼酸缓冲液(pH=6.0),90℃热修复10 min,自然冷却后流水冲洗。3%双氧水去内源性过氧化物酶,PBS冲洗,山羊血清室温孵育40 min。4℃孵育一抗过夜。PBS冲洗,室温孵育二抗40 min。PBS冲洗后DAB显色。苏木素复染,流水冲洗,自来水泛蓝,常规脱水、透明、封片。每组免疫组化结果选取高倍镜下5个视野,计数阳性组织进行统计分析。
1.3.6血流量分析伤后第3、5、7天,2%戊巴比妥钠腹腔注射麻醉小鼠,之后使用皮肤微循环检测仪分别记录3只小鼠两侧伤口(PBS组和Activin B组)中心统一大小区域的动态血流灌注量,记录血流灌注量曲线,并记录动态血流灌注量。每组3只小鼠,每个伤口部位取1 min内的血流量(PF)数值作为原始数据,计算1 min内平均血流量值,进行统计分析。
1.4统计学方法使用SPSS 20.0软件进行统计分析。数据的表达形式是均数±标准差。整体比较采用重复测量方差分析,相同时间点采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1Activin B促进C57BL/6小鼠创面愈合皮肤创伤后第3和5天Activin B组伤口显著小于PBS组(图1A),统计分析发现,Activin B组创面闭合率高于PBS组,差异有统计学意义(P<0.01)(图1B)。

图1 皮肤伤口愈合过程和伤口愈合率统计折线图Fig.1 Time course of wound closureand statistical broken line graph of wound closure rate
2.2Activin B促进C57BL/6小鼠创面周围血管进入肉芽组织术后第3、5及7天大体观察皮肤伤口周围血管的分布情况,结果发现术后第3和5天,Activin B组肉芽组织周围血管数量明显多于PBS组(图2A)。而第7天两组间的血管数量差异无统计学意义,这说明小鼠创伤的第7天已经进入伤口愈合的组织重塑阶段,肉芽组织中血管数量开始减少。
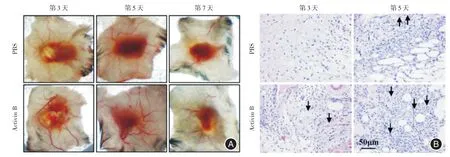
图2 Activin B促进小鼠创面周围血管进入肉芽组织Fig.2 Activin B promotes blood vessels around the wound into granulation tissue
2.3Activin B促进C57BL/6小鼠创面肉芽组织中血管再生,提高血流量H&E染色发现术后3 d Activin B组肉芽组织更成熟,成纤维细胞更多、新生毛细血管形成,而PBS组肉芽组织以炎症细胞为主。术后第3和5天,如图2B中黑色箭头所示Activin B组肉芽组织内部新生的薄壁毛细血管多于PBS组。免疫组化检测周细胞标记物α⁃SMA,结果发现术后第3和5天,肉芽组织中周细胞数量高于PBS组(图3A),根据统计分析,差异具有统计学意义(P<0.01),术后第7天,两组间周细胞数量差异无统计学意义(图3B)。进一步检测血管内皮细胞标记物CD31(图4A),结果也发现术后第3和5天,肉芽组织中毛细血管数量高于PBS组,术后第7天,两组间毛细血管数量差异无统计学意义(图4B)。利用皮肤微循环检测仪检测术后第3和5天肉芽组织中血流量(图5),发现Activin B组(创面平均血流量高于PBS组P<0.01)(图5D),而术后第7天,Activin B组创面平均血流灌注量低于PBS组(P <0.01)(图5C、D),这可能是由于Activin B已经完成血管再上皮化,肉芽组织中血管减少。

图3 免疫组织化学检测周细胞标物α⁃SMA和两组肉芽组织中周细胞的数量统计分析Fig.3 α⁃SMA,the marker of pericyte were detected by immunocytochemicaland statistical bar chart of the number of pericyte in two groups′granulation tissue

图4 免疫组织化学检测血管内皮细胞标记物CD31和两组肉芽组织中新生血管的数量统计柱状图Fig.4 CD31,the marker of vascular endothelial cell were detected by immunocytochemicaland statistical bar chart of the number of angiogenesis in two groups′granulation tissue

图5 皮肤微循环检测仪检测同一只小鼠两组伤口部位肉芽组织中平均血流量和平均血流量统计柱状图Fig.5 The blood flow in two groups′granulation tissue about the one mouse were detected by skin micro⁃circulation testing equipmentand Statistical bar chart of the mean blood flow
3 讨论
创伤愈合是十分复杂的生物学过程,包括早期止血、创面保护、炎症控制及多种组织细胞的增生,新生血管的形成,创缘的爬行收缩等[8]。在伤口愈合的早期阶段形成的肉芽组织在皮肤伤口愈合过程中具有重要的作用,血管的新生质量和数量直接影响创伤部位的愈合效率。虽然目前已有研究证实部分细胞因子在创伤愈合过程中促进血管新生,但是因为伤口愈合过程的复杂性,血管再生的问题依然是伤口愈合尤其是难愈合性伤口研究的重点。
创面血管新生是指皮肤组织损伤后,在各种因素刺激下(如出血、缺血缺氧和炎性反应等),在原有微血管床基础上血管再生的过程,其为创伤部位提供氧、营养和生物活性物质,因此对创面愈合起到了重要作用[9]。本研究在小鼠创面局部应用Activin B后,创面闭合优于PBS组。研究发现Activin B处理后伤口周围深入至肉芽组织中的毛细血管增多,继而在光镜水平观察,发现Activin B处理后伤口部位肉芽组织较成熟,较多新生血管、成纤维细胞和细胞外基质。已有的研究认为血管生成首先是通过内皮细胞发生增殖、迁移,形成新生血管芽,此后血管芽在血流的冲击下出现管腔,同时招募间质中的周细胞贴附于新生血管,完成新生血管的塑型[10]。因此笔者利用血管内皮细胞的标记物CD31免疫组化检测发现Activin B组伤口部位肉芽组织中血管内皮细胞的数量明显高于对照组。在调节伤口部位血管再生的问题中,Activin B与TGF⁃β1具有类似的作用,但是外源性TGF⁃β1主要是通过刺激微血管向内生长和分化发挥作用,那么Activin B是否通过调节血管内皮细胞进而促进血管的新生,这将是未来可以探讨的问题。
研究发现周细胞能够感受血管生成刺激,引导血管芽生,是血管生成的先驱者[11]。因此检测周细胞的标记物α⁃SMA可以反映血管再生[13]。在创伤愈合过程中周细胞可能来源于成纤维细胞[14]、内皮细胞以及周围毛细血管的周细胞等[15]。本研究发现肉芽组织中周细胞(α⁃SMA阳性)增多,一方面提示Activin B促进伤口部位肉芽组织中血管的新生,另一方面也提示Activin B对血管新生过程中周细胞具有重要的调节作用。TGF⁃β信号通过ALK5/Smad2/3信号通路介导内皮细胞分化为周细胞[16]。PDGF⁃β及其受体通路在新生血管周细胞的募集中具有关键作用[17]。那么Activin B对周细胞有何作用,通过何种信号机制调节周细胞的生物学行为进而调节血管的新生目前尚不清楚。
创伤愈合的病理情况有不愈合和过渡愈合两种形式。不愈合主要是指那些不能正常上皮化的开放性创面。由于皮肤组织缺损较大,肉芽生长缓慢,血管新生及胶原沉积减慢[18],局部血液供应不良或者细菌感染等原因,导致细胞增殖不良、细胞老化或功能减退,因而需要较长时间修复。本研究在活体水平初步探讨发现Activin B促进伤口部位肉芽组织的生长,调节伤口部位血管的再生和血流灌注量,从而促进小鼠皮肤创伤愈合。但是具体的调控机制尚未深入研究,因此下一步的研究计划是在细胞水平研究Activin B对血管内皮细胞以及周细胞的功能影响。深入探讨Activin B在创面愈合过程中的血管再生的作用机制,将为临床促进难创愈合、糖尿病血管病变等疾病的治疗提供新的思路。
