YY1基因对J82膀胱尿路上皮癌细胞增殖侵袭能力的影响
2018-12-20刘翔耿和吴宗林施华娟张涛
刘翔 耿和 吴宗林 施华娟 张涛
上海市普陀区人民医院泌尿外科(上海 200060)
在世界范围内,膀胱尿路上皮癌在泌尿系统恶性肿瘤中发病率最高[1],它具有复发率高、易向肌层侵润等特点[2]。近年来该病在我国的发病率有进行性增高的趋势[3],故对该病增殖、侵袭机制的研究能带来明显的科研及社会价值。 转录因子YY1(Yin⁃Yang1)是锌指类核转录调节因子,通过结合不同的辅助因子,参与细胞周期的调控、肿瘤的形成等多种生物学进程[4]。多项研究显示YY1在包括膀胱癌在内的多项恶性肿瘤中均有表达,并揭示YY1可能是导致正常细胞转变为肿瘤细胞,并且促进肿瘤细胞增殖、转移的关键因子[5-6]。故我们设计本研究来观察YY1在不同表达水平下对J82膀胱尿路上皮癌细胞的增殖、侵袭能力的影响,以探索YY1的表达水平与膀胱尿路上皮癌进展的关系。
1 材料与方法
1.1主要材料和试剂本研究起止时间为2017年4月至2018年4月。J82人膀胱尿路上皮癌细胞购自美国Sciencell公司。细胞培养液采用购自美国Hyclone公司。转染试剂盒购自美国Invitrogen公司。兔抗人多克隆抗体YY1购自美国ProteintechT公司。Transwell小室购自美国Corning公司。酶标仪购自瑞士TECAN Nanoquant公司。靶向YY1序列的shRNA由上海齐合生物技术有限公司合成,依筛选出来的709、827、1186三个靶标位点进行制备。
1.2细胞培养和转染将J82细胞在含10%FBS的MEM培养基中于37℃、5%CO2培养箱中培养,转染前1天将J82细胞接种到(不含抗生素的培养基)6孔板中,每孔2 mL。等到细胞生长到80%~90%融合度时,将细胞分为三组:(1)空白组未进行转染操作。(2)YY1增强表达组在Opti⁃MEM 250 μL中加入脂质体核酸转染试剂10 μL,在室温下孵育5 min,加入Opti⁃MEM 250 μL和搭载YY1的pFLAG⁃CMV4载体4 μg,转染后6 h后换成完全培养液,转染完成48 h后收集蛋白。(3)YY1沉默组转染时采用pLKO.1puro载体搭载的shRNA,转染方法同YY1增强表达组。
1.3Western blotting检测相关蛋白的表达分别将空白组、YY1增强表达组、YY1沉默组的细胞充分裂解后离心取上清液。配制凝胶置于电泳槽中,取各个处理组蛋白提取液,与缓冲液混合后煮沸、离心,加入孔中进行电泳,将PVDF膜浸泡于转移缓冲液中,修胶后制备转膜“三明治”,将转移盒放入电转仪中进行转膜。封闭、洗膜后加入封闭液稀释的YY1一抗和β⁃actin,孵育洗膜后加入辣根过氧化物酶(HRP)标记的二抗。膜于化学发光检测试剂中反应后,在暗室中感光、显影、定影。对胶片进行扫描,比较各组灰度值。
1.4MTT实验检测细胞增殖能力J82细胞在10%FBS的MEM培养基中于37℃、5%CO2培养箱中培养,经0.25%胰酶消化,离心后用完全培养基重悬细胞并计数。将空白组、YY1增强表达组、YY1沉默组的转染混合物加到96孔板的孔底,然后每孔接种8 000个J82细胞。置于37℃、5%CO2培养箱中分别培养24、48和72 h,然后在96孔板的每个孔中加入10 μL MTT,于37 ℃、5%CO2培养箱中孵育3 h后,弃去MTT和完全培养基,再加入100 μL DMSO,孵育后于酶标仪中检测各孔在490 nm处的吸光度,绘制细胞增殖曲线。
1.5Transwell实验检测细胞侵袭能力在24孔板和上室transwell insert中加入无血清培养液MEM,在37℃的培养箱里平衡一个h以增强细胞的粘附作用。将空白组、YY1增强表达组、YY1沉默组的细胞按3×104个接种在insert的上室内,6 h之后将上室培养基更换为无血清培养基,下室为完全培养基。Corning Polycarbonate Membrane Insert置于37℃、5%CO2的培养环境下培养,48 h后擦除未迁移跨膜的细胞,将小室置于干净的24孔板中并加入0.6 mL 100%甲醇,室温下固定10 min。固定完成后,在另外一个干净的小孔中倒入一定量的0.1%的结晶紫进行染色30 min,清洗残余染料,取膜后置于显微镜下拍照计数,计数小室中央10个随机视野内穿透膜的细胞数取平均值。
1.6统计学方法应用SPSS 20.0软件对实验数据进行统计分析,实验结果以x±s表示,采用独立样本t检验和单因素ANOVA分析,以P<0.05为差异有统计学意义。
2 结果
2.1YY1基因增强表达和沉默的效果对各组Western blotting蛋白印迹灰度值进行分析,使用β⁃actin作为内参,结果显示空白组与YY1增强表达组对比时,YY1蛋白表达水平分别为(5.73±0.30)和(8.14± 0.37),增强组的YY1表达明显升高,差异有统计学意义(P=0.001)。见图1。对比709、827、1 186三个靶标位点制备的shRNA沉默YY1的表达效果,以1 186位点合成的shRNA效果最佳,故后续数据分析及实验步骤均选取该位点shRNA转染的J82细胞作为YY1沉默组。空白组和YY1沉默组对比时,YY1蛋白表达水平分别为(14.52±0.71)和(10.08±0.37),沉默组的YY1表达明显降低,差异有统计学意义(P<0.05)。见图2。
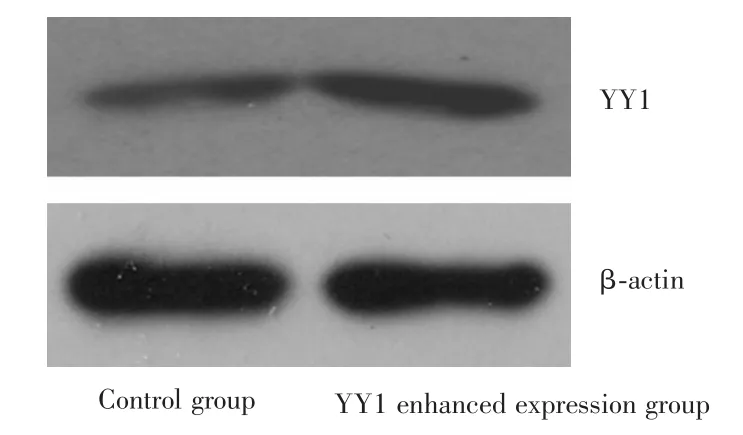
图1 增强表达后的J82细胞中YY1表达水平的改变Fig.1 Expression level of YY1 in J82 cells after enhanced expression
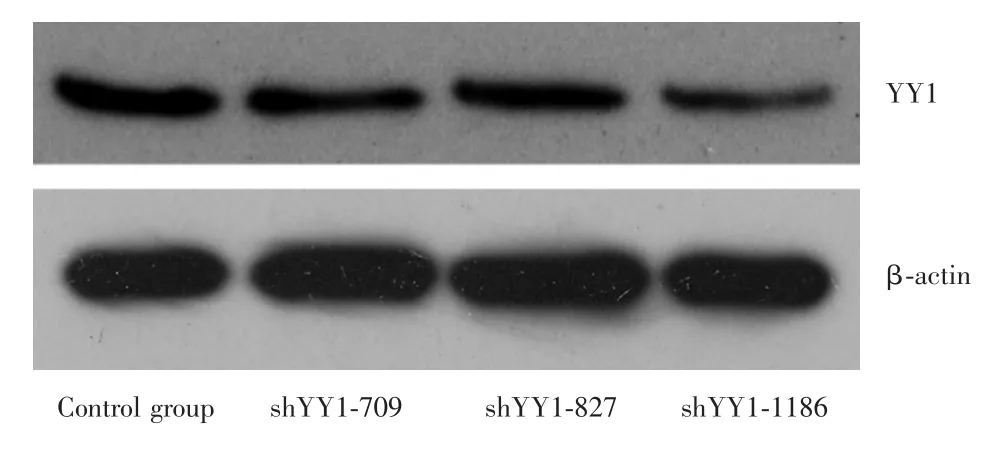
图2 shRNA转染后的J82细胞中YY1表达水平的改变Fig.2 Expression level of YY1 in J82 cells after shRNA transfection
2.2 MTT实验依酶标仪检测结果显示,培养24 h后,YY1沉默组、空白组、YY1增强表达组在490nm处的吸光度分别为(0.105±0.014)、(0.106±0.009)和(0.142±0.009)。培养48 h后,三组吸光度分别为(0.124±0.009)、(0.153±0.010)和(0.246±0.013)。培养72 h后,三组吸光度分别为(0.163 ± 0.028)、(0.234 ± 0.011)和(0.382 ± 0.018)。YY1增强表达组在各个时间节点的吸光度均高于空白组和YY1沉默组(P<0.05)。培养24 h后空白组和YY1沉默组的吸光度无明显区别(P>0.05)。培养48 h和72 h后空白组吸光度明显高于YY1沉默组(P<0.05)。细胞增殖曲线显示,YY1沉默组的增殖速率明显低于YY1增强表达组。见图3。
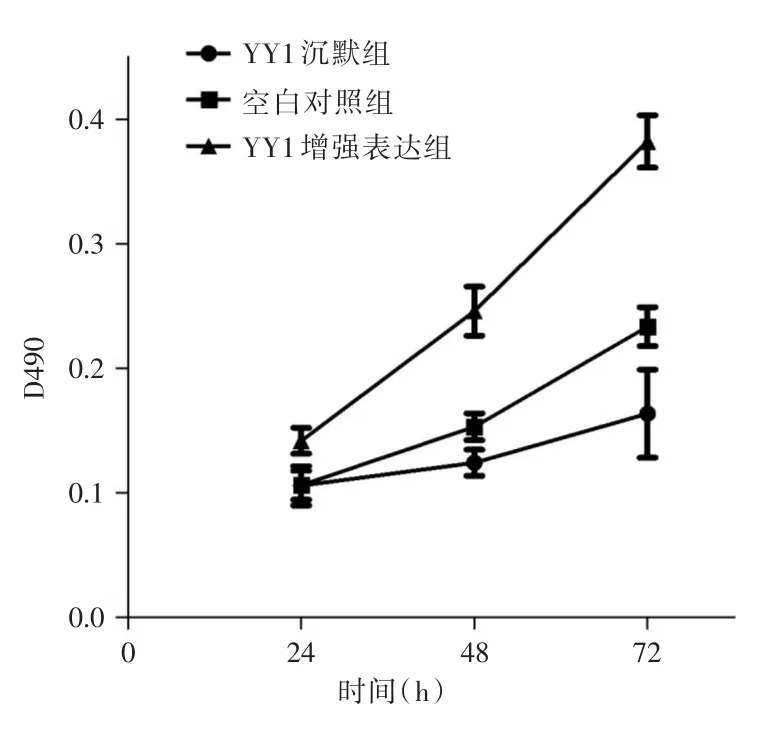
图3 各组J82细胞增殖曲线Fig.3 J82 cell proliferation curve of each group
2.3 Transwell实验随机取10个小室中央视野,计数其内穿透膜的细胞数取平均值,显示YY1沉默组、空白组、YY1增强表达组视野内的细胞计数分别为(7.2±3.6)、(54.4±6.7)和(56.6±10.7)。见图4-7。样本之间差异明显(F=67.804,P<0.05),其中YY1沉默组的细胞计数明显小于空白组和YY1增强表达组(P<0.05),空白组和YY1增强表达组之间无明显差异(P>0.05)。

图4 YY1沉默组中J82细胞的侵袭能力(×250)Fig.4 Invasion ability of J82 cells in YY1 silent expression group(× 250)
图5 空白对照组中J82细胞的侵袭能力(×250)Fig.5 Invasion ability of J82 cells in control group(× 250)
图6 YY1增强表达组中J82细胞的侵袭能力(×250)Fig.6 Invasion ability of J82 cells in YY1 enhanced expression group(× 250)
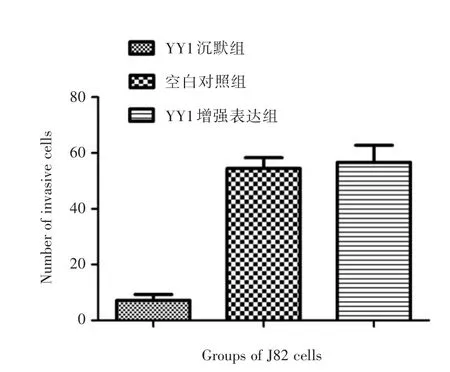
图7 各组透膜细胞计数Fig.7 Number of invasive cells in each group
3 讨论
肿瘤细胞增殖能力与细胞分裂周期密切相关。细胞分裂周期缩短,则在时间一定的条件下能分裂产生更多的细胞。而细胞周期的长短主要由合成前期(G1)决定,缩短合成前期,能有效地缩短细胞的整个分裂周期,从而促进细胞增殖能力的提升[7]。KANG等[8]研究者发现在体外沉默胃腺癌细胞中YY1的表达后,能使胃腺癌细胞停滞于G1期,同时引起胃腺癌细胞凋亡。此研究还提示敲除YY1的胃腺癌细胞的通过抑制Wnt通路从而表现为扩散能力受限制。同样的现象被CHOW KH在乳腺癌中发现[9]。笔者应用ShRNA干扰技术这一高效、特异的基因沉默手段,成功制备了敲低YY1表达的J82细胞模型。通过对YY1增强表达、YY1正常表达和敲低YY1表达的J82细胞进行实验比较各组的增殖能力,发现敲低YY1表达的J82细胞的增殖能力在各个时间节点均明显弱于YY1增强表达的J82细胞,仅在培养24 h后与空白组的J82细胞达到相近水平,而在48 h和72 h后,亦被空白组明显超越。此结果与上述研究者的研究结果相符,提示YY1被沉默后可能延长恶性肿瘤的G1期以减弱其增殖能力。YY1在膀胱尿路上皮癌中发挥作用的具体机制还有待进一步研究,受KANG等[8]作者研究结果的启示,推测该机制与Wnt通路可能存在关联。
肿瘤细胞的侵袭能力受多种因素影响。Tran⁃swell实验反映的是肿瘤细胞降解细胞外基质的能力,该过程是肿瘤细胞通过分泌蛋白降解酶来完成。基质金属蛋白酶家族(MMPs)是此类蛋白降解酶中具有代表性的一类,近年来大量研究显示MMPs在人类多种恶性肿瘤的侵润转移过程中起到了重要的促进的作用[10-11]。我们通过分析Tran⁃swell实验的结果,发现YY1沉默组中J82细胞的侵袭能力明显弱于空白对照组和YY1增强表达组,而对比空白组和YY1增强组中J82细胞的侵袭能力则未发现明显差异。联想到MMPs在肿瘤细胞侵袭过程中的重要作用,笔者试图寻找YY1与MMPs之间相互作用的证据以解释上述结果。NIE等[12]在食管鳞状细胞癌细胞中发现沉默YY1表达后可抑制该肿瘤细胞的扩散和侵润,其过程与MMP2和MMP9的表达受抑制相关。ZHENG等[13]在胃癌细胞中发现沉默YY1后可以明显减弱MMP14的作用,从而抑制胃癌细胞的转移,同时取决于MMP14水平的不同,YY1在胃癌转移的过程中可正向或负向调节MMP14的功能。故笔者推测膀胱尿路上皮的侵袭能力可能受到YY1调节后的MMPs表达的影响,同时MMPs的表达不一定总是随着YY1表达的增强而同时增强,或许存在某种受MMPs水平所决定的反馈机制,导致本实验结果中空白组和YY1增强组J82细胞的侵袭能力无明显差异,这有待在膀胱尿路上皮癌细胞中对不同YY1表达水平下的MMPs作进一步的检测来寻找线索。
前文中提到,笔者发现有关研究提示Wnt通路可能参与了肿瘤细胞的增殖过程,在肿瘤细胞的侵袭过程中,我们同样发现了类似的线索。DU等[14]发现当人类膀胱癌细胞中Wnt通路被激活后,通路中的重要因子β⁃catenin水平升高,刺激MMP9水平也升高从而增强膀胱癌的侵袭能力。结合其他作者在他们的研究中发现YY1可影响MMPs表达水平的结论,推测Wnt通路很可能是YY1作用于MMPs的中间通路,有待进一步研究的证明。
膀胱尿路上皮癌的增殖和侵袭均是十分复杂的过程,我们的研究结果提示沉默YY1基因可减弱J82膀胱尿路上皮癌细胞的增殖和侵袭能力,对其进行进一步研究有利于揭示膀胱尿路上皮癌进展的机制,为针对该肿瘤的治疗提供具有前景的作用靶点。
