南瓜DNA提取方法比较分析
2018-12-17陈学进郭卫丽姜立娜李新峥周俊国
陈学进 郭卫丽 姜立娜 李新峥 周俊国
摘要:DNA提取是基因克隆、PCR扩增、分子杂交以及遗传多态性分析等实验的基础。Whatman FTA卡已广泛应用于DNA的保存和提取,具有简便和高效的特点。采用煮沸法和FTA法分别提取南瓜(Cucurbita nwschata Duch.)根、茎、叶DNA,以常规CTAB法为对照,以期寻找一种简便快捷的DNA提取方法。结果表明,CTAB法适用于南瓜各组织部位的DNA提取,DNA质量最高,PCR扩增的条带清晰,亮度高,但实验操作也最复杂;用煮沸法从叶片中提取的DNA质量相对较好,从根和茎提取的DNA不宜用于PCR反应,实验操作相对简单;FTA法提取的DNA质量较好,PCR扩增的条带清晰,亮度较高,实验操作最简单,是一种最佳的DNA简化提取方法。
关键词:南瓜;DNA;CTAB;煮沸法;FTA法
南瓜(Cucurbita moschata Duch.)是葫芦科南瓜属一年生蔬菜,在世界范围内广泛栽培和食用[1]。南瓜果实营养丰富,含有糖类、维生素、多种氨基酸和矿物质等,南瓜还富含保健活性物质,具有抗氧化功效,南瓜多糖具有降血糖的作用[2-4]。南瓜还可作为其他瓜类蔬菜的砧木,提高嫁接苗的抗逆性及产量[5-6]。
南瓜DNA的提取是南瓜基因克隆,PCR扩增、分子杂交以及遗传多态性分析等分子生物学研究的基础。植物DNA提取的方法较多,如CTAB法、SDS法、试剂盒提取等[7],文献报道关于DNA的提取多为改进或提高DNA质量的方法[8],鲜有DNA提取方法的简化。其中CTAB法是最常用的经典方法。作为一种阳离子去污剂,CTAB可溶解细胞膜,能与核酸形成复合物,该复合物在高盐浓度下可溶解,在低盐浓度下会因溶解度降低而沉淀,通过离心可将CTAB- 核酸复合物同蛋白质、多糖等物质分开,然后用高盐溶液溶解CTAB- 核酸复合物,再用乙醇沉淀DNA而除去CTAB。该法需要经过预热、研磨、保温、2次离心等步骤,时间长、过程复杂,需要配置多种试剂,但提取的DNA质量较好。煮沸法提取DNA是在加入TE缓冲液之后,植物组织经过一冷一热极端的温度差,然后经过离心获得DNA,操作过程进行了简化,但提取的DNA质量不及CTAB法[9]。FTA法是将植物材料DNA保存在Whatman FTA卡(Flinders Technology Associates,简称FTA卡)上,经过FTA洗脱液洗脱、高温处理,FTA卡上的DNA释放到TE-1缓冲溶液中,进而获得DNA的一种方法[10-11]。FTA卡已广泛应用于动物、植物、微生物及噬菌体DNA的提取,FTA卡上的DNA可以长期保存,节省DNA存储空间,可随时用于DNA提取,方便快捷[12-14],但提取的DNA质量一般。实践证明,在满足实验要求的前提下,简化DNA提取可大幅提高实验效率。
笔者以河南科技学院南瓜创新团队培育的南瓜品种‘百蜜一号为试材[15],采用煮沸法和FTA法分别对南瓜根、茎和叶进行DNA提取,以常规CTAB法为对照,以期寻找一种简便快捷的DNA提取方法。
1 材料与方法
1.1 材料
南瓜品种为‘百蜜一号,是由河南科技学院南瓜创新团队培育的杂交品种。
1.2 方法
CTAB法:1.5 mL离心管中加入0.4 mL CTAB提取缓冲液,65℃恒温水浴锅中预热,取适量新鲜材料研磨成粉。转至提取缓冲液中,保温30min,期间轻柔搅动,加入等体积的氯仿/异戊醇(24:1),旋涡震荡,静置10min后10000r·min-1离心10min。取上清液,加入2/3体积的异丙醇,混匀,室温放置15min后10000r·min-1离心10min,去上清液,用70%(φ)乙醇冲洗2次,风干。用50μL TE缓冲液溶解DNA,取1μL用Nanodrop 2000进行DNA质量和浓度的检测。
煮沸法:取适量新鲜材料在研钵中研磨粉碎,加入0.4mL TE缓冲液,倒入离心管中;沸水中煮1~10min,之后立刻冰浴10min。最后在室温13000r·min-1离心5min;取上清液作为DNA样品[9]。取1μL用Nanodrop 2000进行DNA质量和浓度的检测。
FTA法:Whatman FTA卡购于上海仁邦医药科技有限公司。将适量南瓜组织放在FTA卡上,垫上封口膜,用力按压使汁液被FTA卡吸收,室温晾干。用打孔器在FTA卡上有组织印记的区域打孔,将得到的圆形纸饼放入离心管,加入50μL的FTA溶液浸泡5min,吸出;加入200 I-LL的TE-1溶液浸泡1min,吸出:再加入200μL的TE-1溶液浸泡1min,吸出;加入50μL TE缓冲液,将离心管盖好,放入干式恒温器中,95℃加热巧min,取出后室温冷却。取1μL用Nanodrop 2000进行DNA质量和浓度的检测。
以上述3种方法提取的DNA样品为模板进行PCR反应及电泳检测。PCR引物来自于国际葫芦科基因组数据库(http://cucurbitgenomics.org/)美洲南瓜(Cucurbita pepo L.) SSR分子标记数据库,正向引物序列:5-GGAAGAAGAGAGGTTGTGCG-3',反向引物序列:5-CGTTTTCTGTGGC-CATTTCT-3,PCR反应体系总体积20μL,其中模板1μL,10×缓冲液2μL, dNTP1.6μL,正向及反向引物各0.3μL,Taq DNA聚合酶0.1μL, dd Hz014.7μL。PCR反应程序为:94℃2min,94℃20s,58℃30s,72℃1min,35个循环。
PCR扩增产物的电泳检测:每个样品加入2μL溴酚蓝上样缓冲液,用1xTAE缓冲液配置1%(ω)的琼脂糖凝胶,加入适量Goldview核酸染料,120V條件下电泳30min后采用凝胶成像系统拍照。
2 结果与分析
2.1 DNA质量及浓度检测
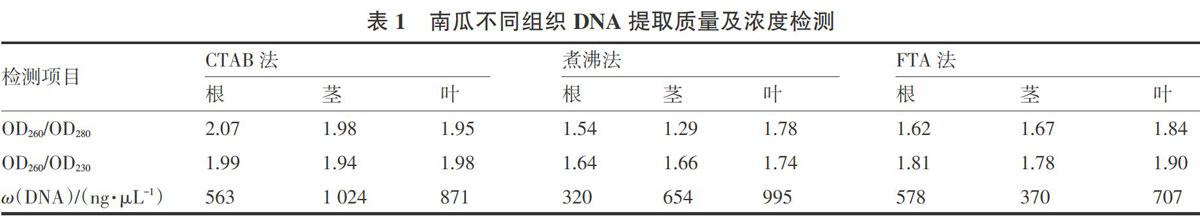
为简化试验操作,3种提取方法均未准确称取样品,根据表1的试验结果,3种提取方法、从不同组织得到的DNA浓度各不相同,也说明了这一点,但是表1中浓度均基本满足一般生物技术的实验操作所需浓度,说明本试验中DNA提取不需要准确称取样品,取样适量即可。
比较3种提取方法,CTAB法获得的DNA质量最高,如表1所示,OD260/OD280均在2.0左右,说明样品 DNA中蛋自含量较低;OD260/OD230均高于1.9,说明样品DNA中小分子杂质较少,从不同的南瓜组织(根、茎、叶)提取的DNA质量差异不明显,说明这些组织均可用CTAB法提取DNA。煮沸法和FTA法得到的DNA质量总体不高,尤其是以根和茎为提取组织时,但从叶片提取的DNA质量OD260/OD280均在1.8左右,OD260/OD230也在1.8左右,基本可以满足一般生物技术的实验需求。
2.2 PCR检测
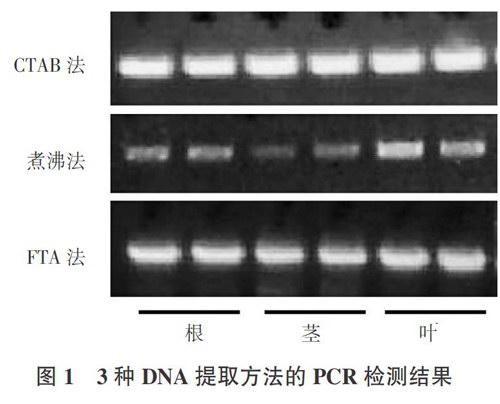
为了检测提取的DNA样品能否用于PCR反应,将上述3种方法提取的根、茎、叶组织DNA分别进行PCR反应。结果表明,CTAB法提取的DNA作为PCR反应的模板扩增得到的条带清晰,亮度较高,效果最佳;煮沸法提取的DNA经过PCR扩增后,条带隐约可见,亮度低,只有叶片组织的条带亮度稍微高一些。FTA法提取的DNA作为PCR反应的模板,扩增得到的条带清晰,亮度较高,效果较好(图1)。
3 讨论与结论
为了找到简单、快捷、高效且适用南瓜基因组DNA的提取方法,笔者以煮沸法和FTA法分别从南瓜的根、茎、叶进行DNA提取,并以常规CTAB法作为参照。经过比较,CTAB法提取的DNA质量最好,但操作程序繁琐,需要的試剂多,操作时间长。煮沸法只需要离心1次,操作过程相对简单,时间短,但得到的DNA质量欠佳。FTA法不需要研磨和离心,需要的试剂较少,操作方便,还可根据需要将材料DNA随时保存,与CTAB法相比具有高效、便捷的优点,虽然提取的DNA质量不及CTAB法,但可满足一般PCR反应。提取样品量较大时,FTA法的优势更加明显。综合比较,FTA法操作最简单,是提取叶片DNA的最佳方法。
FTA法是Whatman公司的一项专利技术,主要应用于室温下DNA的采集、存贮及提取,采集的样品通常是血液、口腔细胞等[13],有文献报道,拟南芥大规模批量提取DNA时采用FTA法更加简便快捷,且成本很低[14],但FTA法在其他植物上的应用鲜有报道。通过与经典的CTAB法和煮沸法比较,笔者为简化南瓜DNA提取提供了一条更优途径,是FTA法在南瓜DNA提取上的首次应用,也为探索南瓜DNA快捷提取提供了有价值的参考。
本试验中,笔者以叶片为材料,3种方法提取的DNA均可用于一般的PCR反应,但其能否满足基因克隆等其他生物技术实验要求,还需要进一步验证。
参考文献
[1]舒迎澜.主要瓜类蔬菜栽培简史[J].中国农史,1998,17(3):94-99.
[2]李新峥,杨鹏鸣,范文秀,等.南瓜多糖及可溶性固形物含量与口感性状相关性分析[J].中国蔬菜,2009(4):26-29.
[3]王士苗,康文艺,孙丽,等.25个南瓜品种不同溶剂提取物抗氧化活性研究[J].食品r一业科技,2015(7):118-121.
[4]王士苗,康文艺,周俊国,等.2个品种南瓜有机溶剂提取物和多糖成分降血糖作用研究[J].食品科技,2015,40(4):263-267.
[5]周俊国,扈惠灵,赵润洲,等.中国南瓜F1砧木对黄瓜嫁接苗生长的影响[J].华北农学报,2010,25(1):117-120.
[6]周俊国,扈惠灵.NaCl胁迫对不同砧木的嫁接黄瓜产量和品质的影响[J].核农学报,2010,(4):851-855.
[7]李会,任志莹,王颖,等.不同DNA提取试剂盒提取作物种子基因组DNA效果的比较[J].湖北农业科学,2013,52(8):1956-1958.
[8]徐艳,徐继法,陈磊,等.小麦TILLING突变体检测中基因组DNA提取方法的优化[J].麦类作物学报,2017,37(2):185-191.
[9]赫然,黄小乐,刘秋云,等.快速制备水稻基因组DNAPCR模板的煮沸法[J].植物生理学通讯,2003,391):41-42.
[10]徐飞,成述儒,罗玉柱.FTA卜和普通定性滤纸提取DNA方法研究[J].生物技术通讯,2011(11):221-224.
[11]匡金枝,聂同钢,杨智,等.FTA-DNA直接提取法的研究与应M[J].中国法医学杂志,2008,23(2):107-110.
[12]鲁巧云,余进,刘伟,等.FTA-DNA直接提取法在病原真菌分子鉴定中的应用[J].中国真菌学杂志,2010,5(3):137-140.
[13]包鹏甲,胡江,罗玉柱,等.绵羊血液基因组DNA的提取方法研究[J].甘肃农业大学学报,2008,43(2):37-40.
[14]李丽,吴凡,周荣明,等一种快速批量提取拟南芥DNA的方法[J].基因组学与应用生物学,2017(3):1-5.
[15]李新峥,孙丽,王士苗,等.百蜜系列南瓜品种性状调查与分析[.1].内蒙古农业大学学报(自然科学版),2014(1):16-20.
