阿司匹林联合氯吡格雷用于PCI术后1年内上消化道出血风险的影响因素研究
2018-12-17李娟妮高麦仓浩育盈李希玲刘怡晓
李娟妮 高麦仓 浩育盈 李希玲 刘怡晓
急性冠状动脉综合征为临床常见的心血管疾病,治疗方法包括药物治疗与手术治疗,其中经皮冠状动脉介入(percutaneous coronary intervention, PCI)可有效重建血运,临床应用广泛[1]。证据表明[2],PCI术后再发心绞痛发生率高达43%,血运重建率为8%,PCI术后的心脑血管时间的预防引起临床重视。阿司匹林联合氯吡格雷是目前临床公认的PCI术后抗血小板方案,术后需至少服用1年[3]。但有证据指出[4-5],双联抗血小板治疗会增加患者上消化道出血风。国外文献指出[6],年龄、吸烟与饮酒、既往消化道病史等是PCI术后双联抗血小板治疗的上消化道出血的危险因素,但目前国内尚缺乏PCI术后双联抗血小板治疗1年的上消化道出血数据的统计研究。本研究回顾性分析两院343例PCI术后口服阿司匹林肠溶片100 mg/d和硫酸氢氯吡格雷片75 mg/d维持治疗的急性冠状动脉综合征患者的临床资料,探讨PCI术后随访1年内上消化道出血风险的影响因素,以期为临床提供参考,现报道如下。
资料与方法
一、一般资料
回顾性分析2016年6月至2018年6月两院收治的343例行PCI治疗,并于术后口服阿司匹林肠溶片100 mg/d和硫酸氢氯吡格雷片75 mg/d进行维持治疗的急性冠状动脉综合征患者的临床资料。其中,男性244例、女性99例;年龄31 ~ 79岁,平均(66.14 ± 6.25)岁;2例合并幽门螺杆菌感染;111例有吸烟史,48例有饮酒史;117例合并糖尿病史、192了合并高血压。
纳入标准:①经冠脉造影明确诊断且行PCI术的患者,术后口服阿司匹林肠溶片(拜耳医药保健有限公司生产,批准文号:国药准字J20130078,规格:100 mg × 30片)100 mg/d和硫酸氢氯吡格雷片(赛诺菲制药有限公司生产,批准文号: 国药准字J20130083,规格:75 mg × 7 s)75 mg/d维持治疗;②术后随访时间≥1年;③年龄 > 18岁;④临床资料完善。
排除标准:①长期接受抗凝治疗者;②伴心肌病、瓣膜病、严重心衰者;③严重颈动脉狭窄者;④严重肝肾功能不全者;⑤入组前3个月内有脑血管疾病发作史者;⑥入组前6个月内有过颅内出血、消化道出血或其他出血倾向者;⑦左主干病变及及冠脉搭桥术后患者;⑧伴终末期脏器疾病者;⑨伴持续性恶性高血压者;⑩有血小板功能失调或血小板减少症(血小板计数<100×109/L)病史者;白细胞计数<4.0×109/L者。
二、方法
1. 分组
患者出现血便、黑便、粪潜血阳性或呕血等其中一项症状,伴或不伴血红蛋白浓度下降,胃镜检查结果呈阳性为上消化道出血。计算343例患者PCI术后双联抗血小板治疗1年的上消化道出血发生率。根据随访1年内纳入患者发生上消化道出血与否分为出血组与未出血组。
2. 单因素分析
对两组患者的临床资料进行回顾性分析,采用χ2检验或Fisher确切检验比较两组性别、年龄( > 60岁、≤60岁)、消化性溃疡病史、吸烟、饮酒、糖尿病、高血压、幽门螺杆菌感染、用药史(抗凝药、质子泵抑制剂、非甾体消炎药及其他药物)、血清肌酐(0 ~ 115 μmol/L、116 ~ 177 μmol/L、> 177 μmol/L)、血清丙氨酸转氨酶(0 ~ 40 U/L、41 ~ 80 U/L、> 80 U/L)。
3. 多因素分析
将单因素分析中有统计学意义的因素作为自变量纳入多因素Logistic回归分析,以是否出现上消化道出血作为因变量(是 = 1,否 = 0),采用非条件逐步回归模型筛选危险因素,以α = 0.05作为进入回归模型的显著性水准。
结 果
一、治疗结果
343例患者中,共24例患者PCI术后双联抗血小板治疗1年内出现上消化道出血,出血发生率7.00%(24/343)。其中20例患者表现为黑便或粪潜血,2例呕血、2例血便。
二、单因素分析
两组性别、年龄、幽门螺杆菌感染、吸烟、饮酒、糖尿病与高血压病史、抗凝药应用、非甾体消炎药、H2受体拮抗剂、胃黏膜保护剂、丙氨酸转氨酶的差异均无统计学意义(P> 0.05);出血组消化性溃疡病史、血肌酐水平 > 113 μmol/L的占比均高于未出血组,合用质子泵抑制剂的占比低于未出血组,差异有统计学意义(P< 0.05)。见表1。
三、多因素Logistic回归分析
多因素Logistic回归分析显示,消化性溃疡病史、质子泵抑制剂、血肌酐均为PCI术后双联抗血小板治疗1年内的上消化道出血的独立影响因素(P< 0.05),见表2。

表1 出血组与未出血组的临床资料比较 [n(%)] 因素出血组(n = 24)未出血组(n = 319) χ2值P值性别0.2510.616 男16(66.67)228(71.47) 女8(33.33)91(28.53)发病年龄0.5760.448 > 60岁15(62.50)223(69.91) ≤60岁9(37.50)96(30.09)幽门螺杆菌感染1(4.17)1(0.31)1.002*0.317 个人史 吸烟9(37.50)102(31.97)0.3110.577 饮酒5(20.83)43(13.48)1.0030.317既往病史 糖尿病8(33.33)109(34.17)0.0070.934 高血压13(54.17)179(56.11)0.0340.978消化性溃疡史4(16.67)13(4.08)5.077*0.024 用药史 抗凝药1(4.17)7(2.19)0.007*0.933质子泵抑制剂6(25.00)149(46.71)4.2470.039非甾体消炎药2(8.33)10(3.13)0.579*0.447H2受体拮抗剂1(4.17)8(2.51)0.030*0.864胃黏膜保护剂2(8.33)9(2.82)0.770*0.380血肌酐9.5850.002 > 113 μmol/L22(91.67)191(59.87) ≤ 113 μmol/L2(8.33)128(40.13)丙氨酸转氨酶(U/L)0.0800.583 0~4021(87.50)263(82.45) 41~802(8.33)45(14.11) > 801(4.17)11(3.44)
注:*Fisher确切检验。
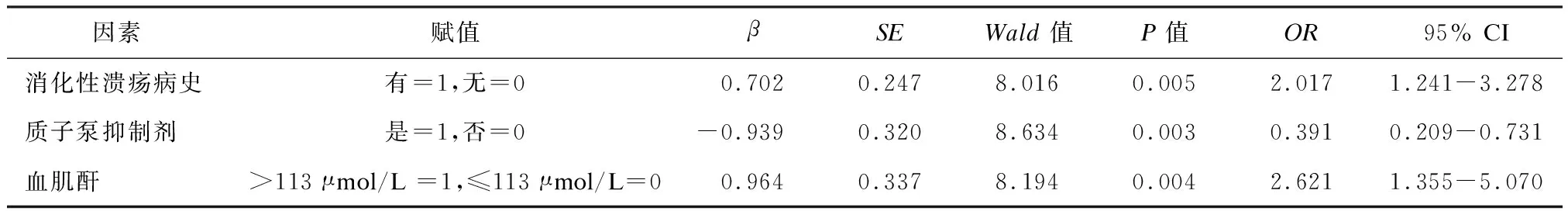
表2 PCI术后双联抗血小板治疗1年内的上消化道出血的多因素Logistic分析
讨 论
阿司匹林和氯吡格雷已在PCI患者术后抗血小板治疗中得到广泛应用,效果确切,但随之引起的出血风险也逐渐受到临床关注[7]。《抗血小板药物消化道损伤的预防和治疗中国专家共识(2012更新版)》提出[8],所有PCI患者术后均应进行至少1年的双联抗血小板治疗。目前的抗血小板治疗都将出血并发症作为安全性终点事件,表明抗栓药物并不单单通过血栓风险评判其优劣,更要以不增加出血风险作为其获益风险比的价值判断[9]。
本研究中,PCI术后双联抗血小板治疗1年的出血发生率为7.00%,略高于刘莹[10]等报道的4.1%,推测与纳入患者的自身条件有关,本研究纳入的患者包括静脉曲张、胃镜阳性的患者,而其他研究通常会将上述因素剔除。出血患者主要表现为黑便或粪潜血,呕血与血便的情况较少,与张泽锋[11]等所报道的临床特征一致。单因素分析结果显示,出血组与未出血组在消化性溃疡病史、血肌酐水平与质子泵抑制剂应用情况方面存在较大差异,进一步多因素Logistic回归证实,消化性溃疡病史、质子泵抑制剂与血肌酐水平为PCI术后双联抗血小板治疗的上消化道出血独立影响因素:
(1)有消化性溃疡病史患者的出血风险更高,是无消化性溃疡病史的2.017倍。消化性溃疡是一种极易复发的消化道疾病,原因与溃疡的发生打破了患者胃部血流动力学稳定性有关,造成疾病的高复发率[12-14]。笔者认为,消化性溃疡病史改变了患者胃部血流动力学,当再次受到相关刺激易再次复发、出血。同时溃疡病史的存在会在一定程度上损伤胃黏膜屏障[15-16],加之氯吡格雷会在一定程度上降低血小板活动,故有消化性溃疡病史患者PCI术后双联抗血小板治疗患者的出血增大。
(2)合用质子泵抑制剂患者的出血风险降低,是未合用质子泵抑制剂患者的0.391倍,合用质子泵抑制剂是PCI术后采用阿司匹林联合氯吡格雷维持治疗1年内发生上消化道出血的保护性因素[17-18]。155例合用质子泵抑制剂的患者中,质子泵抑制剂以奥美拉唑、其他包括兰索拉唑、雷贝拉唑、埃索美拉唑等较为常见。质子泵抑制剂是一类抑制胃酸分泌药,对胃黏膜有良好保护作用,可预防性改善局部微循环,在双联抗血小板治疗基础上合用质子泵抑制剂可在血栓形成与上消化道出血之间取得更稳定的平衡[19-21],值得临床借鉴。
(3)血肌酐 > 113 μmol/L患者的出血风险相对更高,是血肌酐≤113 μmol/L患者的2.621倍。血肌酐水平主要反映患者肾功能,血肌酐水平越高,肾功能越差,药物的吸收代谢相对减慢[22-24]。阿司匹林与氯吡格雷,主要在胃内酸性条件下崩解吸收,易损伤胃黏膜,其大部分经肾脏清除。若肾功能减弱,会破坏肾小球的机械屏障功能及电荷屏障功能,使肾小球的滤过率及肾小管重吸收率降低,造成药物在肠胃内大量累积,引发“过度给药”效应[25-26],从而引起出血。
综上所述,消化性溃疡病史、血肌酐水平、质子泵抑制剂是阿司匹林联合氯吡格雷用于PCI术后1年内上消化道出血风险的影响因素,对于有消化性溃疡病史及存在肾功能损伤的患者,应积极留意出血症状,也可在阿司匹林联合氯吡格雷维持治疗基础上预防性应用质子泵抑制剂。
