二肽基肽酶4抑制剂对早期糖尿病慢性肾脏疾病患者β2微球蛋白水平的影响
2018-12-17陈庆云焦林娟
陈庆云,焦林娟
(河南省南阳市第二人民医院 肾病风湿免疫科,河南 南阳 473012)
糖尿病慢性肾脏疾病(chronic kidney disease,CKD)是糖尿病最严重和最常见的慢性微血管并发症,约占全部并发症的20%~30%,是糖尿病患者肾功能衰竭的主要原因[1]。CKD的发病机制至今仍未完全清楚,而炎症机制是大部分学者比较认同的机制之一。β2微球蛋白(β2-MG)是淋巴细胞、血小板、多形核细胞等体内有核细胞产生的一种球蛋白,是反映肾小管重吸收功能的重要指标[2]。在正常情况下,尿液中的β2-MG微乎其微,在肾功能受损害时,大量β2-MG在体内潴留,血清中β2-MG浓度可为正常人的20~40倍,意味着肾小管功能损伤严重,肾小管滤过负荷增加。另外,血清中β2-MG的浓度的测量不受机体其他因素的影响,因此可以准确地评估肾脏损伤[3]。二肽基肽酶4(DPP-4)抑制剂列为2型糖尿病(T2DM)治疗的一线药物,已广泛应用于T2DM的临床治疗中。近年来研究[4]发现,DPP-4抑制剂除能促进胰岛素分泌,抑制胰升血糖素释放等多种机制控制血糖外,还存在调节炎症反应的作用,为多种非特异性炎症疾病提供了新思路,但目前国内此方面的相关研究很少涉及。鉴于此,本研究通过观察DPP-4抑制剂治疗后早期CKD患者β2-MG的水平变化,探讨其在早期CKD患者肾脏保护方面的作用,旨在为临床应用提供临床方面的数据,为保护肾脏提供可靠数据。
1 资料与方法
1.1 研究对象
选取2015年1月—2017年1月河南省南阳市第二人民医院内分泌门诊就诊的早期患者(CKD组)72例。其中,男性34例,女性38例;年龄45~65岁,平均(50.65±4.57)岁;糖尿病病程5~12年,平均(7.19±2.08)年;均出现持续性微量白蛋白尿,尿白蛋白排泄率(UAER)30~300 mg/24 d。同期选取该院糖尿病正常蛋白尿患者(DM组)80例。其中,男性39例,女性41例,年龄44~66岁,平均(51.00±4.78)岁;糖尿病病程5~13年,平均(7.22±2.18)年,UAER<30 mg/d。糖尿病均符合1999年WHO糖尿病诊断标准。排除标准:①T1DM、成人隐匿性自身免疫性糖尿病及其他特殊类型糖尿病;②合并恶性肿瘤、严重肝肾功能障碍、急性感染、外伤等应激状态者;③合并肝、肾疾病;④合并高血压肾病;⑤合并各种肾小球肾炎;⑥服用过影响肾脏功能的药物;⑦合并肾淀粉样病变。另选取同期体检健康者80名作为健康对照组(NC组),均无心血管、内分泌、泌尿系统疾病。其中,男性35例,女性45例;年龄44~63岁,平均(50.71±4.14)岁。
1.2 方法
1.2.1 治疗方法 根据入院先后顺序将CKD组患者随机分为常规亚组和DPP-4亚组,各36例。常规亚组采用降糖、抗凝、调脂、降血压等基础治疗,口服格列美脲2 mg、肠溶阿司匹林100 mg、瑞舒伐他汀10 mg,3种药物均1次/d;DPP-4亚组在此基础上给予DPP-4抑制剂5 mg,1次/d(中美上海施贵宝制药有限公司,规格:每片5 mg,国药准字:J20150066)。所有患者均进行糖尿病饮食管理、运动治疗,疗程共计12周。
1.2.2 指标测定 收集患者的性别、年龄、糖尿病病程,测量身高、体重、血压,计算BMI。分别于治疗前和治疗12周后于门诊行标准75 g OGTT检查FPG和2 h PG。抽取空腹静脉血,检测HbA1c、血脂、肝肾功能、TNF-α、IL-6及β2-MG。血糖、血脂及肝肾功能均采用AU 5400全自动生化分析仪,以酶法测定(日本奥林巴斯公司生产)。HbA1c采用Variant Ⅱ糖化血红蛋白分析仪,以高效液相色谱法测定(美国Bio Rad公司生产)。TNF-α、IL-6及β2-MG采用酶联免疫吸附法检测,试剂盒购自德国欧蒙试剂诊断公司,严格按照试剂盒操作说明书进行,批内差异<10%,批间差异<15%。另留取24 h尿,化学法测定UAlb,并计算 UAlb/Cr。
1.3 统计学方法
数据分析采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示,采用方差分析,在方差分析有意义的基础上,再采用LSD-t检验进行两两比较,治疗前后比较采用配对t检验,计数资料以率(%)表示,比较采用χ2检验。采用Pearson相关分析β2-MG与其他临床资料的相关性,采用多元线性回归分析β2-MG的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 各组入组时临床资料和生化指标的比较
CKD组 和 DM 组 BMI、FPG、2 h PG、HbA1c、24 h UAlb、IL-6、TNF-α及β2-MG均高于NC组,差异有统计学意义(P<0.05),CKD组2 h PG、24 h UAlb、IL-6、TNF-α及β2-MG均高于DM组,差异有统计学意义(P<0.05)。见表 1。
表1 各组入组时临床资料和生化指标的比较(±s)
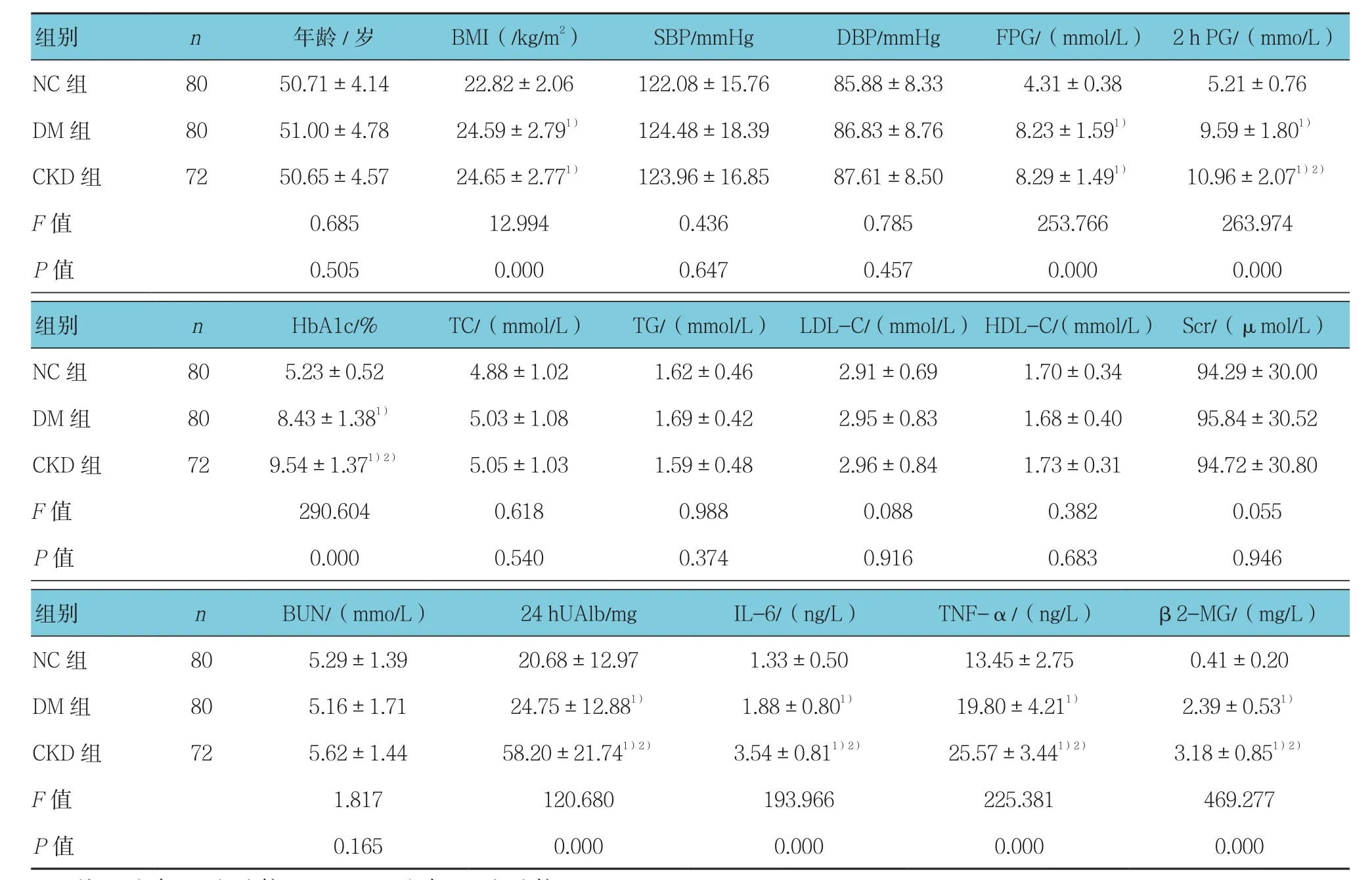
表1 各组入组时临床资料和生化指标的比较(±s)
注:1)与NC组比较,P <0.05;2)与DM组比较,P <0.05
组别 n 年龄/岁 BMI(/kg/m2) SBP/mmHg DBP/mmHg FPG/(mmol/L) 2 h PG/(mmo/L)NC 组 80 50.71±4.14 22.82±2.06 122.08±15.76 85.88±8.33 4.31±0.38 5.21±0.76 DM组 80 51.00±4.78 24.59±2.791) 124.48±18.39 86.83±8.76 8.23±1.591) 9.59±1.801)CKD组 72 50.65±4.57 24.65±2.771) 123.96±16.85 87.61±8.50 8.29±1.491) 10.96±2.071)2)F值 0.685 12.994 0.436 0.785 253.766 263.974 P值 0.505 0.000 0.647 0.457 0.000 0.000组别 n HbA1c/% TC/(mmol/L) TG/(mmol/L) LDL-C/(mmol/L) HDL-C/(mmol/L) Scr/(µmol/L)NC 组 80 5.23±0.52 4.88±1.02 1.62±0.46 2.91±0.69 1.70±0.34 94.29±30.00 DM组 80 8.43±1.381) 5.03±1.08 1.69±0.42 2.95±0.83 1.68±0.40 95.84±30.52 CKD组 72 9.54±1.371)2) 5.05±1.03 1.59±0.48 2.96±0.84 1.73±0.31 94.72±30.80 F值 290.604 0.618 0.988 0.088 0.382 0.055 P值 0.000 0.540 0.374 0.916 0.683 0.946组别 n BUN/(mmo/L) 24 hUAlb/mg IL-6/(ng/L) TNF-α/(ng/L) β2-MG/(mg/L)NC 组 80 5.29±1.39 20.68±12.97 1.33±0.50 13.45±2.75 0.41±0.20 DM组 80 5.16±1.71 24.75±12.881) 1.88±0.801) 19.80±4.211) 2.39±0.531)CKD 组 72 5.62±1.44 58.20±21.741)2) 3.54±0.811)2) 25.57±3.441)2) 3.18±0.851)2)F值 1.817 120.680 193.966 225.381 469.277 P值 0.165 0.000 0.000 0.000 0.000
2.2 两亚组治疗前后生化指标的比较
与治疗前比较,治疗后两组FPG、2 h PG、HbA1c及24 h UA1b均较治疗前降低,差异有统计学意义(P<0.05),治 疗 后 DPP-4亚 组 FPG、2 h PG、HbA1c及24 h UAlb均低于常规亚组,差异有统计学意义(P<0.05)。见表 2。
2.3 两亚组治疗前后炎症因子水平的比较
由表3可见,与治疗前比较,治疗后两组IL-6、TNF-α及β2-MG均较治疗前降低,差异有统计学意义(P<0.05),治疗后DPP-4亚组IL-6、TNF-α及β2-MG均低于常规亚组,差异有统计学意义(P<0.05)。
表2 两亚组治疗前后生化指标的比较(n =36,±s)
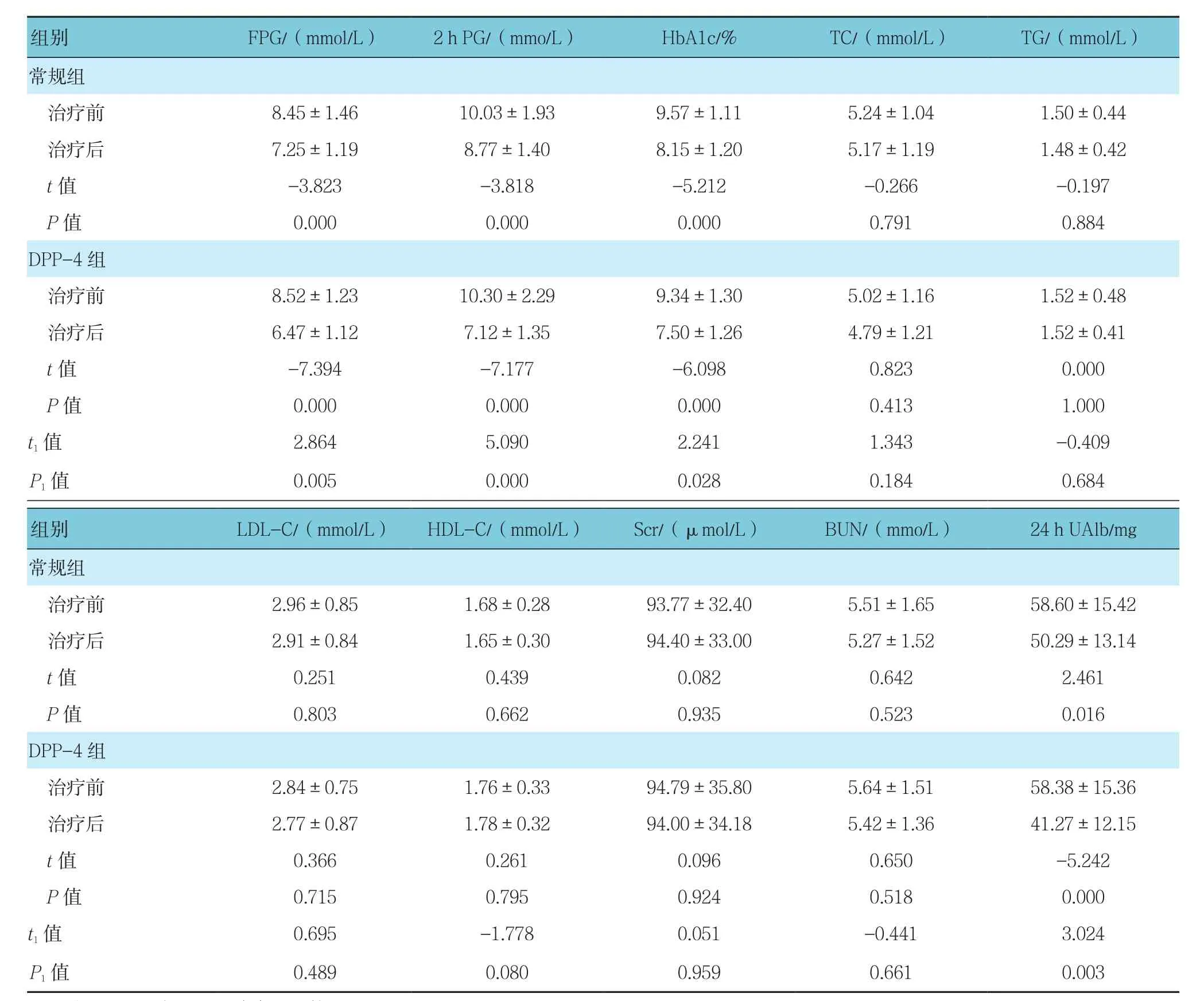
表2 两亚组治疗前后生化指标的比较(n =36,±s)
注:t1,P1为两亚组治疗后比较
组别 FPG/(mmol/L) 2 h PG/(mmo/L) HbA1c/% TC/(mmol/L) TG/(mmol/L)常规组治疗前 8.45±1.46 10.03±1.93 9.57±1.11 5.24±1.04 1.50±0.44治疗后 7.25±1.19 8.77±1.40 8.15±1.20 5.17±1.19 1.48±0.42 t值 -3.823 -3.818 -5.212 -0.266 -0.197 P值 0.000 0.000 0.000 0.791 0.884 DPP-4组治疗前 8.52±1.23 10.30±2.29 9.34±1.30 5.02±1.16 1.52±0.48治疗后 6.47±1.12 7.12±1.35 7.50±1.26 4.79±1.21 1.52±0.41 t值 -7.394 -7.177 -6.098 0.823 0.000 P值 0.000 0.000 0.000 0.413 1.000 t1值 2.864 5.090 2.241 1.343 -0.409 P1值 0.005 0.000 0.028 0.184 0.684组别 LDL-C/(mmol/L) HDL-C/(mmol/L) Scr/(µmol/L) BUN/(mmo/L) 24 h UAlb/mg常规组治疗前 2.96±0.85 1.68±0.28 93.77±32.40 5.51±1.65 58.60±15.42治疗后 2.91±0.84 1.65±0.30 94.40±33.00 5.27±1.52 50.29±13.14 t值 0.251 0.439 0.082 0.642 2.461 P值 0.803 0.662 0.935 0.523 0.016 DPP-4组治疗前 2.84±0.75 1.76±0.33 94.79±35.80 5.64±1.51 58.38±15.36治疗后 2.77±0.87 1.78±0.32 94.00±34.18 5.42±1.36 41.27±12.15 t值 0.366 0.261 0.096 0.650 -5.242 P值 0.715 0.795 0.924 0.518 0.000 t1值 0.695 -1.778 0.051 -0.441 3.024 P1值 0.489 0.080 0.959 0.661 0.003
表3 两亚组治疗前后炎症因子的比较(n =36,±s)
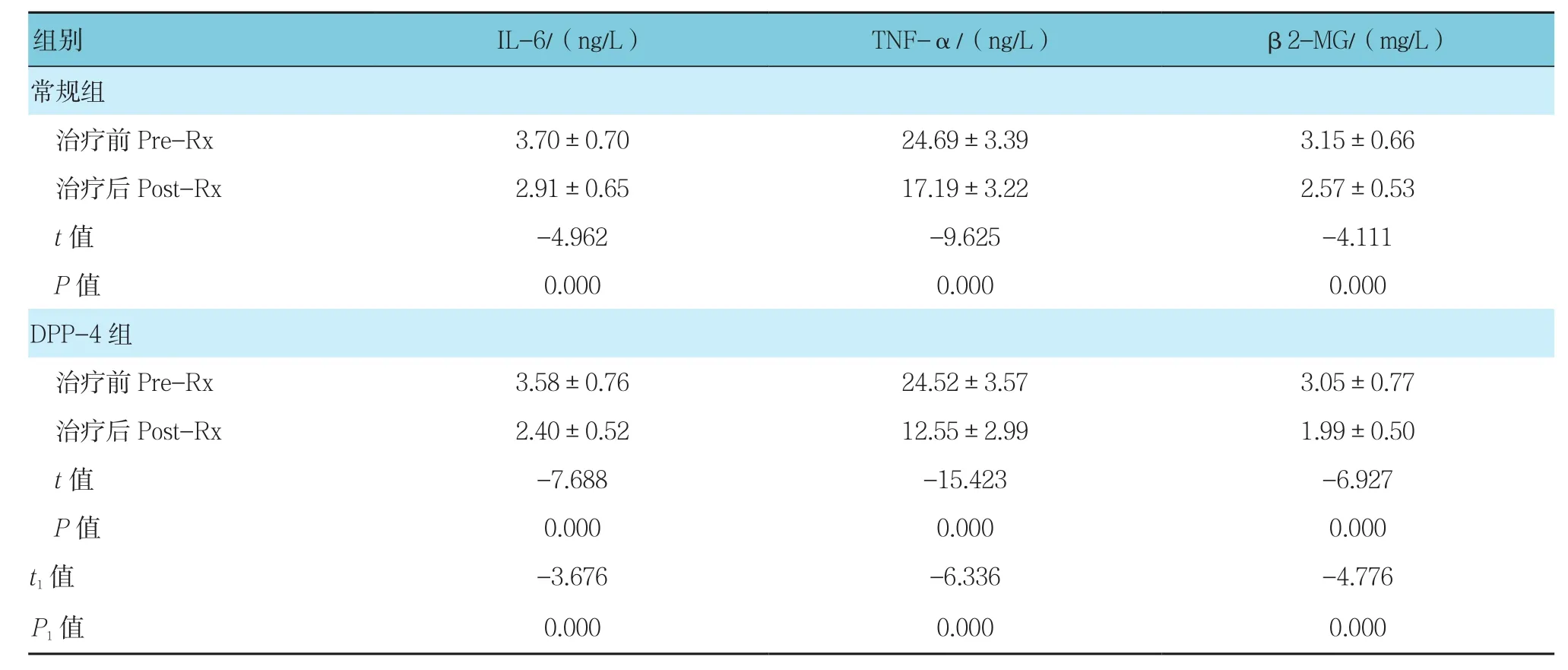
表3 两亚组治疗前后炎症因子的比较(n =36,±s)
注:t1,P1为两亚组治疗后比较
组别 IL-6/(ng/L) TNF-α/(ng/L) β2-MG/(mg/L)常规组治疗前Pre-Rx 3.70±0.70 24.69±3.39 3.15±0.66治疗后Post-Rx 2.91±0.65 17.19±3.22 2.57±0.53 t值 -4.962 -9.625 -4.111 P值 0.000 0.000 0.000 DPP-4组治疗前Pre-Rx 3.58±0.76 24.52±3.57 3.05±0.77治疗后Post-Rx 2.40±0.52 12.55±2.99 1.99±0.50 t值 -7.688 -15.423 -6.927 P值 0.000 0.000 0.000 t1值 -3.676 -6.336 -4.776 P1值 0.000 0.000 0.000
2.4 β2-MG与其他临床指标的相关性分析
Pearson相关分析发现,糖尿病病程、BMI、2 hPG、HbA1c、24 hUAlb、IL-6、TNF-α与β2-MG水平相关(P<0.05)。见表 4。
2.5 β2-MG影响因素的多元性线性回归分析
以β2-MG为因变量,以表4中具有相关性的指标为自变量,行多元线性回归分析,结果发现,糖尿病病程和HbA1c是β2-MG的影响因素(P<0.05)。见表5。

表4 β2-MG与其他临床指标的相关性分析

表5 β2-MG影响因素的多元性线性回归分析
3 讨论
早期CKD的特征是尿中白蛋白排泄轻度增加,且存在较长时间的无症状阶段,若非通过筛查,很难发现,但症状一旦出现将不可逆转[5]。因此,早期诊断CKD显得尤为重要。体内的补体、免疫复合物、化学物质、内毒素等刺激机体激活单核-巨噬细胞系统,被激活的-巨噬细胞系统释放TNF-α和IL-6等促炎性细胞因子,机体在这些炎症细胞因子的调控下产生的轻微炎症反应被称为微炎症状态。有研究[6]认为,早期CKD患者已存在微炎症和免疫功能下降,因此可通过消除或控制促炎因素,改善早期CKD免疫功能障碍,延缓CKD的进一步发生发展。本研究发现,CKD组和DM组IL-6、TNF-α及β2-MG均高于NC组,且CKD组IL-6、TNF-α及β2-MG均高于DM组,提示在CKD早期已存在肾小管重吸收功能下降或者有可能早于肾小球的损伤,与以往研究[7]结果类似。
DPP-4抑制剂的作用机制如下:DPP-4抑制剂与DPP-4结合形成DPP-4复合物,DPP-4的活性在结合后就被抑制,活性胰升血糖素样肽-1的浓度在DPP-4呗抑制的情况下增高,调节α细胞,促进胰岛β细胞分泌胰岛素,降低血糖;在高血糖的情况下,可降低胰升血糖素水平,升高血糖,从而实现其对血糖的双向调节作用[8]。苏永等[9]研究发现,服用二甲双胍降糖效果不理想的患者加用DPP-4抑制剂后,可以有效降低患者血糖及HbA1c水平,且不影响患者肝肾功能。本研究亦发现,加用DPP-4治疗的患者FPG、2 h PG、HbA1c及24 hUAlb较常规治疗患者更低。GROOP等[10]研究发现,T2DM患者加用DPP-4抑制剂后,患者尿微量白蛋白明显下降,研究对早期CKD患者肾小管功能变化方面的数据暂未有涉及。在本研究中,加用DPP-4治疗的患者治疗后IL-6、TNF-α及β2-MG较常规降糖治疗的患者低,提示DPP-4抑制剂可以消除或控制促炎因素,减轻肾小管损伤,进而延缓CKD进一步发展。本研究认为这可能与DPP-4抑制剂能够有效控制血糖,减少高血糖对肾组织的损害[11]及抗炎作用有关。研究发现[12],在动物模型研究中,DPP-4抑制剂降低C反应蛋白、白细胞介素1β等炎症因子的表达。
本研究还发现,糖尿病病程和HbA1c是早期CKD患者β2-MG的影响因素。刘利祥等[13]研究发现,糖尿病病程≥5年的患者体内β2-MG的浓度及异常率高于病程>5年的患者,说明糖尿病程越长的患者肾小球功能受到的影响越大。研究显示[14],糖尿病患者引起肾功能损害与高血糖有关,高血糖可激活多元醇、PKC途径,增加蛋白非酶糖基化和大分子终末产物的合成,影响细胞因子的表达,还使炎症、介质及信号因子等发生异常。因此,长期血糖控制欠佳是导致糖尿病肾损害的重要因素。
综上所述,DPP-4抑制剂可以有效降低早期CKD患者血糖水平,降低β2-MG水平,消除或控制促炎因素,减轻肾小管损伤,进而延缓CKD进一步发展。但因收集的样本病例较少,且观察时长有限,故本研究结果还有待扩大样本量、延长观察时间进一步确定。
