注射剂药品说明书辅料信息标注情况调查与分析
2018-12-15王庆娥
王庆娥
(徐州医科大学附属医院药学部,江苏 徐州 221000)
注射剂具有“作用迅速、剂量易控、疗效确切”等优点,被临床广泛应用,但是静脉输液是高风险的给药方式,可能引起不良反应。国家药品不良反应监测年度报告(2016年)显示,按药品给药途径统计,药品不良反应/事件报告最多的为静脉注射,达59.7%[1]。注射剂除主药外,根据配制需要会添加药用辅料,以增加有效性、安全性与稳定性。通常认为药用辅料是无活性的,不存在安全隐患。事实上,有些药用辅料本身具有药理活性,与药物联用亦可能发生理化变化或相互作用,影响疗效或产生不良反应[2]。如何规避由药物辅料带来的用药风险,合理使用注射剂日益引起人们的重视。本文汇总分析了我院常用的注射剂药品说明书中辅料标注情况,旨在为临床安全合理用药提供参考。
1 资料与方法
以“注射剂”、“药用辅料”、“不良反应”为关键词,在中国知网检索近十年相关文献。依据《药品说明书和标签管理规定》、2015年版《中国药典》等资料,查阅我院静配中心常用的、用药途径为静脉注射和滴注的注射剂药品说明书,将药品说明书中相关内容输入EXCEL表,进行分析。
2 结果
2.1 此次调查注射剂药品说明书229份,按药品类别分为中药注射剂25份,占10.9%,化学注射剂204份,占89.1%;说明书中辅料成分有标注161份,占70.3%,其中中药注射剂12份,标注率为48.0%,化学注射剂149份,标注率为73.0%;标注与辅料相关的安全合理用药信息57份,占24.9%。见表1。
按产地不同分为进口注射剂18份,占7.9%,国产注射剂211份,占92.1%;进口注射剂说明书辅料成分有标注占83.4%,16.6%明确标注辅料为“无”;国产注射剂辅料成分有标注占69.2%,6.1%明确标注辅料为“无”。见表2。
在有标注辅料的161份说明书中,3份标注辅料等级,5份标注辅料用量;共用辅料品种数为53种,其中2015版《中国药典》收载的品种有25个,占47.2%。
2.2 同一成分的注射液因规格或生产厂家不同,说明书中标注的辅料亦有所不同。见表3。
2.3 常用辅料在不同的注射剂说明书标注情况汇总。见表4。
2.4 标注辅料的注射剂药品说明书有24.9%标示了与辅料相关的不良反应、注意事项、禁忌症、药物相互作用等。见表5。注:依据药品批准文号分为“H”为化学注射剂,“Z”为中药注射剂
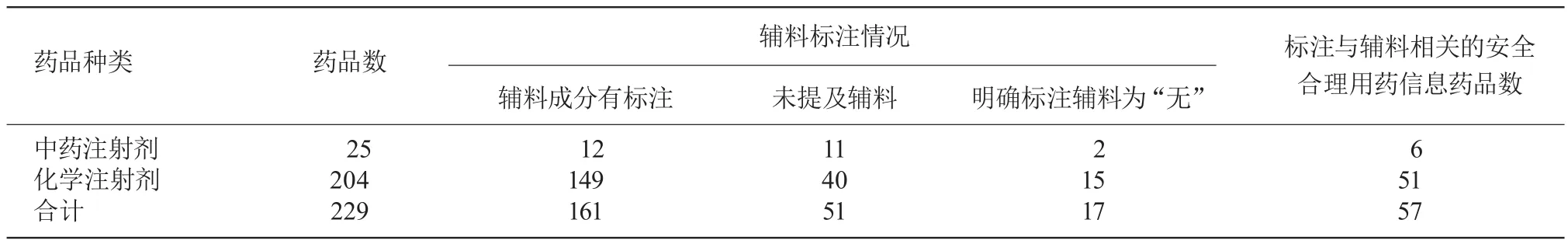
表1 不同类别注射剂药品说明书中辅料标注情况

表2 不同产地注射剂药品说明书中辅料标注情况

表3 相同成分不同规格或企业的注射剂说明书中辅料标注情况

表4 常用辅料在不同的注射剂说明书中标注情况汇总

表5 注射剂说明书中标注与辅料相关的用药注意事项
3 讨论
3.1 注射剂辅料总体标注情况与临床合理用药
药品说明书是医师开具医嘱、药师指导患者安全合理用药的法定依据,不仅为临床安全合理用药提供参考,也可为分析药物的不良反应提供依据[3]。原国家食品药品监督管理局(CFDA)于2006年颁布的《药品说明书和标签管理规定》第十一条指出,注射剂应当列出所用的全部辅料名称。由本次调查的229份注射剂说明书情况看,标注辅料成分的占70.3%,明确标注“无”辅料成分的占7.4%,可见辅料成分标注率与《药品说明书和标签管理规定》要求存在差距。中药注射剂本身成分复杂,制备过程中往往需要添加各种辅料以改善有效成分的溶解度、稳定性等,且中药注射剂作为C级高警示管理药品,临床应用过程中应严格按照说明书的指导用药,而此次调查显示近一半的中药注射剂说明书中未标注辅料信息。由表2可知,进口注射剂说明书辅料成分标注率为83.4%,国产注射剂为69.2%,可见进口注射剂说明书中辅料标注情况相对规范。究其原因,笔者认为我国部分药品生产企业一方面缺乏全面系统的药用辅料研究资料[4],一方面对辅料引起的安全隐患重视不够,从而导致说明书中辅料的成分、不良反应、注意事项等信息标注不全,不足以指导临床安全合理用药。
3.2 注射剂辅料具体标注情况与临床合理用药
3.2.1 辅料的质量标准《中国药典》指出:制剂生产使用的药用辅料,应符合现行国务院药品监督管理部门关于药用辅料管理的有关规定,以及药典四部药用辅料的有关要求[5]。2015年版《中国药典》收载了270种药用辅料,较2010年版《中国药典》收载品种大幅增加,且更加系列化、多规格化,并加强了药用辅料安全性控制及标准适用性研究的要求[3]。本次调查的229种注射剂药品说明书中,执行标准为2015年版《中国药典》的有48种,仅占20.9%;药品说明书共标注辅料53种,被2015年版《中国药典》收载的有25种,占47.2%。目前,国内部分药用辅料采用相关的行业标准和企业标准,但没有药典标准[6],导致辅料标准不同、质量良莠不齐、使用级别、范围不明确等而存在安全用药隐患。2015版《中国药典》四部收录了大豆油、丙二醇、聚山梨酯-80、甘油等注射用级别的辅料,此次调查的注射剂说明书中仅有3份标示了辅料的等级。注射用辅料作为注射剂的重要组分,它的无菌、细胞内毒素是否符合注射剂要求是保证注射剂质量的重要环节[7]。
3.2.2 辅料用量标示情况 在已标注辅料成份的药品说明书中,仅有5份标示了辅料的用量。有报道显示[8],同成分同规格的注射剂辅料的用量,与该药物是否产生不良反应有关,如不同厂家生产的同一规格的注射用胸腺法新,因辅料甘露醇的用量不同而出现多例不良反应,表现为注射部位出现红肿、疼痛等。
3.2.3 辅料成份标注情况调查发现,有3份注射剂说明书的辅料成分项中虽有标注,但信息不全,如紫彬醇注射液(海南中化联合制药),在辅料成分项标注为聚氧乙基蓖麻油,而在“注意事项”中才提到本品含无水乙醇,临床应用时需详细阅读说明书。另外,相同成分不同厂家或规格的注射剂辅料应用情况亦有不同,如艾司洛尔注射液(齐鲁制药)规格2 mL的含有95%乙醇、丙二醇,10 mL的则不含。使用头孢类药物期间不宜饮酒已成为医患间的共识,与含醇辅料制剂合并用药易导致双硫仑样不良反应[9]却容易被人们忽视。因此,临床在使用此类同种不同规的药品时应注意不良反应的发生。表3列出了相同成分不同规格或企业的注射剂说明书中辅料标注情况供临床用药参考。
3.3 辅料本身引起不良反应与临床安全合理用药
调查得知,注射剂说明书中标注与辅料相关的安全合理用药信息的有57份,其中有32份(56.1%)提示为“对任一辅料成分过敏禁用”。理论上讲,药用辅料是无活性的,但有研究表明,注射剂产生不良反应的原因与辅料的添加情况密切相关。药用辅料常引起的安全隐患表现在注射用辅料潜在的过敏性、刺激性、溶血性和基因毒性[7]。表4列出几种常用辅料在不同注射剂说明书中标注情况汇总。
3.3.1 吐温-80吐温-80是非离子型表面活性剂,作为难溶性药物的增溶剂或乳化剂,在注射剂中广泛应用,可提高注射剂的澄明度和稳定性,特别是对中药注射剂。近年来,文献报道中多有提及吐温-80可引起不良反应,包括急性过敏反应、外周神经毒性、抑制P-糖蛋白活性、肝毒性等[10]。有研究指出中药注射剂的不良反应与所含吐温-80关系密切。吐温-80的生产原料(油酸)纯度不够,使有强烈致敏性的脱色剂(过氧化氢)残留,可增加类过敏反应发生率[11]。本调查结果发现,含吐温-80的中药注射剂说明书中指出用药开始30分钟内应加强用药监护,滴注过程宜缓不宜快。如多西他赛注射液(含吐温-80),临床使用时宜将一日总剂量分为小、大剂量,先滴注小剂量进行观察,若无异常反应再给予大剂量,避免药物过敏。
3.3.2 丙二醇丙二醇为溶剂,可引起渗透压升高、乳酸酸中毒、中枢神经系统抑制、溶血、局部静脉炎、心脏毒性反应、接触性皮炎等不良反应[12]。李伟平指出溶血性反应是葛根素最严重的不良反应[13],葛根素注射液中含有助溶剂丙二醇,它的存在加重了溶血性反应,建议临床使用时尽可能选择较低浓度,并注意避免与含丙二醇为辅料的药物联用[14]。
3.3.3 苯甲醇苯甲醇作为溶剂、抑菌剂、局部止痛剂应用,可引起臀肌挛缩症。本次调查的注射剂说明书中,有7份标有辅料苯甲醇,在说明书“注意事项”中均提示:禁止用于儿童肌肉注射。另外,注射用甲泼尼龙琥珀酸钠说明书提示:苯甲醇与致命的早产儿“喘息综合征”有关。苯甲醇产生毒性的最低量未知,建议儿童用药时若联用含有苯甲醇为辅料的药物,应从各方面考虑苯甲醇的加合日代谢量。
3.3.4 乙醇乙醇为溶剂,肌注或皮下注射刺激性强,浓度在11 %以上时可引起急剧溶血[15]。氢化可的松注射液中含辅料乙醇,建议临床使用时严格按照说明书要求,加25倍的生理盐水或5 %葡萄糖注射液500 mL稀释后静滴。乙醇对中枢神经系统亦有影响,如紫彬醇注射液60 mg含无水乙醇,说明书中指出该注射剂中含高剂量的乙醇,短时间输注可能是引起中枢神经系统毒性的最主要原因。建议临床输注此类注射剂时,应注意滴注速度。另外含辅料乙醇的注射剂与含“甲巯四氮唑侧链”结构的药物如头孢哌酮、甲硝唑等联用,可引起双硫仑样反应。
3.3.5 其他亚硫酸盐(抗氧化剂)主要毒副作用是严重的过敏反应[11];聚氧乙基代蓖麻油(增溶剂)静脉给药易引起严重的过敏反应及周围神经病变[16]。建议临床使用含该辅料的药物时,宜按说明书中交代的用法用量配制,以防不良反应的发生。
3.4 含辅料注射剂与药物间配伍对临床安全合理用药的影响
有些药物含有辅料磷酸、磷酸二氢盐、碳酸、碳酸氢盐等为PH调节剂,如头孢他啶中含有碳酸钠,单唾液酸四己糖神经节苷脂中含磷酸盐;有些药物本身为磷酸盐如复合磷酸氢钾、克林霉素磷酸酯等,与含Ca2+的注射剂配伍可生成不溶性的白色沉淀。如复合辅酶中含辅料葡萄糖酸钙,林格氏液、复方氯化钠、钠钾镁钙葡萄糖注射液等含Ca2+;这些药物在临床联合应用中,不仅需要注意不能在同一组输液里配伍使用,而且在两组药物输液序贯滴注时应避免直接接触,宜用合适的液体冲管或间隔一段时间使用。另外,辅料依地酸二钠为金属离子螯合剂,起抗氧化作用。含该辅料的注射剂使用时应尽量避免与含金属离子的药物配伍,以免影响药效。有的注射剂中含有辅料精氨酸,有报道[17]盐酸精氨酸与多烯磷酸酯胆碱有配伍禁忌。
3.5 辅料与某些病患的安全合理用药
山梨醇作为等渗调节剂,本身具有生理活性。奥拉西坦、阿加曲班、长春西汀等注射剂中均含有山梨醇。高血糖可激活细胞内的多元醇通路,引起山梨醇的畜积,造成细胞水肿,神经细胞内环境紊乱,代谢平衡破坏及神经传导速度减慢,最终导致糖尿病周围神经病变[18]。对果糖不耐受或1,6二磷酸果糖酶缺乏的糖尿病患者应避免使用长春西汀(润坦)。
4 结论
综上所述,辅料的添加一方面为药物的稳定性、有效性保驾护航,另一方面辅料潜在的安全隐患及对合理用药的影响不可小觑。本次调查的注射剂仅涉及给药途径为静脉注射和滴注的药品,具有一定的局限性。调查发现,注射剂说明书中与辅料相关的信息标注情况不足以指导临床安全合理用药,建议药品生产企业应重视并完善注射剂药品说明书中的辅料信息,国家相关部门应加大监管力度;医生应仔细阅读药品说明书,关注注射剂疗效的同时不能忽略由辅料导致的不良反应;药师需熟悉药品说明书,审核医嘱时要充分考虑辅料对配伍的影响,必要时在输液标签中增加提示,如头孢哌酮舒巴坦提示“不与含酒精制剂联用”,痰热清提示“序贯滴注需冲管”,吉西他滨(含辅料甘露醇)提示“为防结晶析出配制好的溶液不得冷藏”等;护士要了解药物配伍禁忌,按提示操作并加强患者用药过程的巡视。总之,注射剂在临床应用过程中,医、药、护应携手加强用药监护,尽量规避由辅料引起的用药风险。
