鸭瘟病毒TaqMan实时荧光定量PCR方法的建立
2018-12-14万春和刘荣昌陈翠腾程龙飞施少华傅光华陈红梅傅秋玲
万春和, 刘荣昌, 陈翠腾, 程龙飞, 施少华, 傅光华, 陈红梅, 傅秋玲, 黄 瑜
(福建省农业科学院畜牧兽医研究所/福建省畜禽疫病防治工程技术研究中心/福建省禽病防治重点实验室,福建 福州 350013)
鸭瘟病毒(duck enteritis virus, DEV),也称鸭肠炎病毒,属疱疹病毒科(Herpesviridae)α-疱疹病毒亚科(Alphaherpesviridae)马立克氏病病毒属(Mardivirus)[1].鸭群感染DEV主要表现为体温升高、两腿发软、流泪,部分鸭感染可见“肿头瘟”;剖检主要出现食道黏膜出血或溃疡、泄殖腔黏膜出血等症状.DEV可感染鸭、鹅和其他雁形目禽类[2-3].
目前,GenBank数据库中登陆了6株DEV全基因组,其基因组长度约160 kb(158 015~162 175 bp).DEV基因组由长独特区(unique long, UL)、短独特区(unique short, US)及位于US区两端的内部重复序列(internal repeat, IR)和末端重复序列(terminal repeat, TR)组成,其基因组结构UL-IR-US-TR具有典型的疱疹病毒基因组结构特征[4-9].DEVgE基因全长1 473 bp,编码490个氨基酸,在DEV不同代表株中极为保守,仅存在个别点突变[10].gE蛋白是DEV重要的囊膜蛋白,该蛋白亚细胞主要定位于细胞质,具有良好的免疫原性和反应活性[11-12].研发发现,疱疹病毒科猪伪狂犬病毒在非同源细胞系中传代易导致gE和gI基因丢失,造成毒力显著下降,具有良好的弱毒活疫苗潜力[13-14].对DEV的研究发现,DEV强毒株(CSC株)经鸡胚成纤维细胞(CEF)传代后致弱毒株(p80株)第25~100代均稳定缺失gE基因[8].但对GenBank数据库中的3株DEV疫苗株[VAC株(登录号:EU082088)、K株(登录号:KF487736)、C-KCE株(登录号:KF263690)]和3株强毒株[CHv株(登录号:JQ647509)、CV株(登录号:JQ673560)、2085株(登录号:JF999965)]基因组分析发现, DEV强毒株和疫苗弱毒株均存在gE基因,表明gE基因对DEV毒力致弱的生物学机制还需进一步深入研究.
DEV的诊断常见有病毒分离与鉴定、血清中和试验(SN)、琼脂糖凝胶扩散试验(AGP)、酶联免疫吸附、微量固相放射免疫吸附试验(Micro-SPRIA)和反向间接血凝试验(RPHA)等经典病毒学方法.随着对DEV基因序列不断深入研究,针对DEV多个基因序列特征的PCR方法、环介导等温扩增技术(LAMP)和实时荧光定量PCR方法均有研究报道[15-17];此外,针对gE基因检测DEV的有酶联免疫吸附试验(ELISA)、免疫荧光和免疫组化方法等相关研究[11-13].本试验基于gE基因特征分析,设计特异性引物和探针,建立了基于TaqMan探针检测DEV的实时荧光定量PCR方法.
1 材料与方法
1.1 材料
1.1.1 试剂 病毒核酸提取试剂盒EasyPure Viral DNA/RNA Kit(货号:ER201)、细菌基因组提取试剂盒EasyPure Bacteria Genomic DNA Kit(货号:EE161)、荧光定量PCR反应cDNA反转录试剂盒TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)(货号:AT341)和T克隆载体试剂盒pEASY-T1 Simple Cloning Kit(货号:CT111)均购自北京全式金生物技术有限公司;实时荧光定量试剂盒Premix Ex TaqTM(Probe qPCR)(货号:RR390Q)和PCR扩增试剂Premix TaqTM(Ex TaqTMVersion 2.0 plus dye)(货号:RR902Q)购自宝日医生物技术(北京)有限公司;胶回收试剂盒(货号:Gel Extraction Kit D2500)和质粒小量提取试剂盒Ⅰ(货号:Plasmid Mini Kit Ⅰ D6943)均购自Omega Bio-Tek公司;荧光定量八排管(货号:PCR-0208-C)购自爱思进(Axygen)公司;其他常规化学试剂、耗材和引物合成购自生工生物工程(上海)股份有限公司.
1.1.2 毒株和菌株 番鸭细小病毒(muscovy duck parvovirus, MDPV)、鹅细小病毒(goose parvovirus, GPV)、鸭腺病毒A型(duck adenovirus A, DAdV-A)、鸭甲肝病毒1型(duck hepatitis A virus 1, DHAV-1)、鸭甲肝病毒3型(duck hepatitis A virus 3, DHAV-3)、番鸭呼肠孤病毒(muscovy duck reovirus, MDRV)、新型鸭呼肠孤病毒(novel duck reovirus, N-DRV)、H9N2亚型禽流感病毒(H9N2 subtype avian influenza virus, AIV)、禽1型副粘病毒(avian paramyxovirus type 1, APMV-1)、鸭源大肠杆菌(Escherichiacoli,E.coli)、鸭疫里默氏杆菌(Rimerellaanatipstifer,R.A.)和鸭源禽多杀性巴氏杆菌(Pasteurellamultocida,P.M.)均由福建省农业科学院畜牧兽医研究所鉴定并保存.
DEV疫苗株购自青岛易邦生物工程有限公司,疫苗株为DEV鸡胚化弱毒株(CVCC AV1222),批号:160051201,生产日期:20161020.
1.1.3 试验胚 7日龄非免疫半番鸭鸭胚购自莆田某健康养殖厂.
1.2 TaqMan实时荧光定量PCR检测方法的建立
1.2.1 引物的设计与合成 根据GenBank中DEV各分离株gE基因的特征,采用Oligo(v7.37)引物设计软件,设计特异性的TaqMan实时荧光定量PCR的引物和探针,上游引物DEV-gE-F:5′-AAGGGTATAGGGTTAAGAC-3′,下游引物DEV-gE-R:5′-GGTGTAGATTCGGTAGAC-3′,荧光探针DVE-gE-P:5′-ACGAATCCTCAGAACACAGACTCAG-3′.其中,DVE-gE-P的5′端标记有荧光报告基团FAM,3′端标记有淬灭基团Eclipse.
1.2.2 标准品的构建 采用Oligo(v7.37)引物设计软件,设计特异性引物扩增DEVgE基因,上游引物DEV-gE-F:5′-GACTACGGAACCTCAACAATT-3′,下游引物DEV-gE-R:5′-TGAGTCATTAGTTCAACATCCAT-3′.该引物扩增片段跨过完整的gE基因开放阅读框(ORF),预期目的片段大小为1 525 bp.
采用病毒核酸提取试剂盒EasyPure Viral DNA/RNA Kit提取DEV强毒株(FZ1501株)[18]核酸DNA,使用gE基因全长引物(DEV-gE-F/DEV-gE-R)对其进行PCR扩增.按照Premix TaqTM(Ex TaqTMVersion 2.0 plus dye)说明书进行PCR扩增,反应体系(50 μL)参考试剂盒说明书配制,含25 μL 2×Ex Taq SuperMix、上/下游引物(DEV-gE-F/DEV-gE-R, 20 μmol·L-1)各1 μL、1 μL提取核酸DNA,补充22 μL灭菌去离子水至终体积50 μL.混匀,瞬时离心后进行PCR反应,反应条件为:94 ℃预变性5 min;94 ℃ 50 s、56 ℃ 35 s、72 ℃ 90 s,30个循环;循环结束后于72 ℃延伸10 min.
用1.0%琼脂糖凝胶电泳对PCR产物进行鉴定,对特异性目的片段进行切胶后采用琼脂糖凝胶回收试剂盒纯化.按照pEASY-T1 Simple Cloning Kit克隆连接试剂盒说明书将特异性的基因片段克隆到pEASY-T1载体上,随机挑取12个单菌落于氨苄青霉素(含量为100 μg·mL-1)抗性的LB液体培养基培养14 h后,采用快速质粒小提试剂盒提取相应的质粒.采用PCR扩增时的引物(DEV-gE-F/DEV-gE-R)和条件对提取的质粒(需稀释105倍)进行PCR鉴定,将筛选出的阳性重组质粒送生工生物工程(上海)股份有限公司进行测序.将测序结果在美国国立生物技术信息中心(NCBI)上进行DNA数据库相似性比较(BLAST),符合试验预期的阳性重组质粒经线性化酶切后作为实时荧光定量PCR的阳性标准品(T-gE).采用微量核酸测定仪测定阳性重组质粒的浓度,计算出拷贝数(2.17×108拷贝·μL-1),先将其稀释至1.0×108拷贝·μL-1,再对其进行10倍连续稀释(质粒含量分别为1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101和1.0×100拷贝·μL-1),分装后置于-20 ℃保存备用.
1.2.3 反应条件的优化 以阳性标准品(T-gE)(质粒含量为1.0×106拷贝·μL-1)为模板,按照Premix Ex TaqTM(Probe qPCR)试剂盒说明书配制20 μL的实时荧光定量PCR反应体系,在不同引物终浓度(0.05、0.1、0.2、0.4、0.6、0.8、1.0 μmol·L-1)、不同探针终浓度(0.1、0.2、0.3、0.4、0.5 μmol·L-1)的条件下,对退火温度(56、58、60、62 ℃)进行优化,以出现最高的荧光值(△Rn)、最小的循环数阈值(cycle threshold, Ct)以及在熔解曲线分析中不出现非特异性扩增,确定建立的实时荧光定量PCR的最优反应条件.
1.2.4 标准曲线的建立 分别以不同质粒含量(1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101拷贝·μL-1)的标准品作为实时荧光定量PCR反应的模板,用“1.2.3”中优化后的反应条件进行扩增,获得扩增动力学曲线.以标准品起始拷贝数的常用对数(lgC)为横坐标,以Ct为纵坐标,推导计算出实时荧光定量PCR反应的标准线性回归方程(标准曲线).
1.2.5 特异性试验 用优化后的最优反应条件分别对其他常见的鸭源病原(MDPV、GPV、DAdV-A、DHAV-1、DHAV-3、MDRV、N-DRV、AIV、APMV-1、E.coli、R.A.、P.M.)进行实时荧光定量PCR检测,评价建立方法的特异性.以DEV鸡胚化弱毒株(CVCC AV1222株)和强毒株(FZ1501株)为阳性对照,用病毒基因组DNA/RNA提取试剂盒提取相应的病毒株(CVCC AV1222株、FZ1501株、MDPV、GPV、DAdV-A)核酸DNA,用细菌基因组提取试剂盒提取相应菌株(E.coli、R.A.、P.M.)基因组DNA,用病毒基因组DNA/RNA提取试剂盒提取相应病毒株(DHAV-1、DHAV-3、MDRV、N-DRV、AIV、APMV-1)核酸RNA后使用TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)试剂盒反转录为cDNA,备用.
1.2.6 敏感性试验 分别以不同质粒含量(1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101拷贝·μL-1)的标准品作为实时荧光定量PCR反应的模板,用“1.2.3”中优化后的最优实时荧光定量PCR反应条件进行检测,确定建立的实时荧光定量PCR方法的最小检测限,同时进行常规PCR检测,评价两者的灵敏性.
1.2.7 重复性试验 用优化后的最优实时荧光定量PCR反应条件分别对不同质粒含量(1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101拷贝·μL-1)的标准品进行检测,每个含量的标准品重复检测3次,计算组内变异系数.分别将上述标准品分装后置于-20 ℃保存,每隔7 d取出,共检测3次,计算组间变异系数.
1.3 临床应用
1.3.1 临床样品检测 用优化后的最优实时荧光定量PCR反应条件,对临床送检疑似DEV感染的14份病死鸭进行检测,并与常规PCR方法、鸭胚病毒分离进行平行分析比较.采集病死鸭肝脏和脾脏组织,加入灭菌PBS(体积比为1∶5)研磨处理后,反复冻融3次,于4 000 r·min-1离心20 min,吸取上清备用.采用病毒核酸提取试剂盒提取14份待检样品的核酸DNA,分装后冻存备用.采用gE基因全长引物(DEV-gE-F/DEV-gE-R)对分离毒株的gE基因进行PCR扩增,明确其基因特征.
1.3.2 人工感染鸭检测 对3只15日龄的番鸭腿肌免疫注射0.5 mL DEV强毒株(FZ1501株),3 d后采集其肝脏和食道黏膜刮取物,按常规方法研磨处理后,用EasyPure Viral DNA/RNA Kit提取核酸DNA,采用优化后的最优实时荧光定量PCR反应条件进行检测,每个样品重复检测3次.
2 结果与分析
2.1 优化后的TaqMan实时荧光定量PCR条件
优化后的TaqMan实时荧光定量PCR最佳反应体系(20 μL)含10 μL Premix Ex Taq(Probe qPCR)Mix、上/下游引物(终浓度为300 nmol·L-1)各0.2 μL、2 μL模板,补充灭菌去离子水至终体积20 μL.优化后的最佳反应条件为: 98 ℃预变性2 min;95 ℃ 10 s,62 ℃退火/延伸20 s,40个循环.循环结束后,做出对应的溶解曲线.
2.2 实时荧光定量PCR标准曲线的建立

图1 DEV实时荧光定量PCR的标准曲线Fig.1 Standard curve for TaqMan real time PCR of DEV
从不同含量质粒的标准品扩增动力学曲线可见,建立的TaqMan实时荧光定量PCR在1.0×101~1.0×106拷贝·μL-1反应范围内有很好的线性关系,相关系数为0.999.以每个标准品模板中拷贝数的常用对数(lgC)为横坐标,以Ct为纵坐标,获得基于TaqMan探针检测DEV实时荧光定量PCR的标准曲线(图1)方程为:y=-3.480x+37.955,表明建立的实时荧光定量PCR的标准曲线具有良好的线性关系.
2.3 实时荧光定量PCR的特异性检测
从扩增曲线(图2)可见,优化后的TaqMan实时荧光定量PCR方法仅对DEV强毒株和疫苗株检测出阳性扩增,对其他常见的鸭源病原(MDPV、GPV、DAdV-A、DHAV-1、DHAV-3、MDRV、N-DRV、AIV、APMV-1、E.coli、R.A.、P.M.)均未见阳性荧光信号扩增,表明建立的TaqMan实时荧光定量PCR方法特异性强.
2.4 实时荧光定量PCR的灵敏性检测
用建立的TaqMan实时荧光定量PCR方法对不同含量质粒的标准品进行检测,结果(图3)显示,最低检测限为1.0×101拷贝·μL-1(即10拷贝·μL-1),常规PCR的检测限为1.0×103拷贝·μL-1(即1 000拷贝·μL-1)(图4),表明建立的实时荧光定量PCR方法较常规PCR方法更敏感.
2.5 实时荧光定量PCR的重复性检测
将不同含量质粒的标准品分别进行组内和组间的重复性试验,结果(表1)显示,组内变异系数为0.62%~1.14%,组间变异系数为0.69%~2.40%,Ct的变异系数均在2.5%以内,表明建立的实时荧光定量PCR方法重复性好.

1:DEV强毒株;2:DEV疫苗株;3:试验对照(MDPV、GPV、DAdV-A、DHAV-1、DHAV-3、MDRV、N-DRV、AIV、APMV-1、E.coli、R.A.、P.M.)因没有扩增信号,无法区分具体条带线.图2 DEV实时荧光定量PCR的特异性Fig.2 Specificity test for TaqMan real time PCR of DEV

1~6:质粒含量分别为1.0×105、1.0×104、1.0×103、1.0×102、1.0×101和1.0×100拷贝·μL-1.图3 DEV实时荧光定量PCR的敏感性Fig.3 Sensitivity test of real time PCR for DEV

M:DNA分子量标准;1~6:质粒含量分别为1.0×105、1.0×104、1.0×103、1.0×102、1.0×101和1.0×100拷贝·μL-1.图4 DEV常规PCR的敏感性Fig.4 Sensitivity test of conventional PCR for DEV
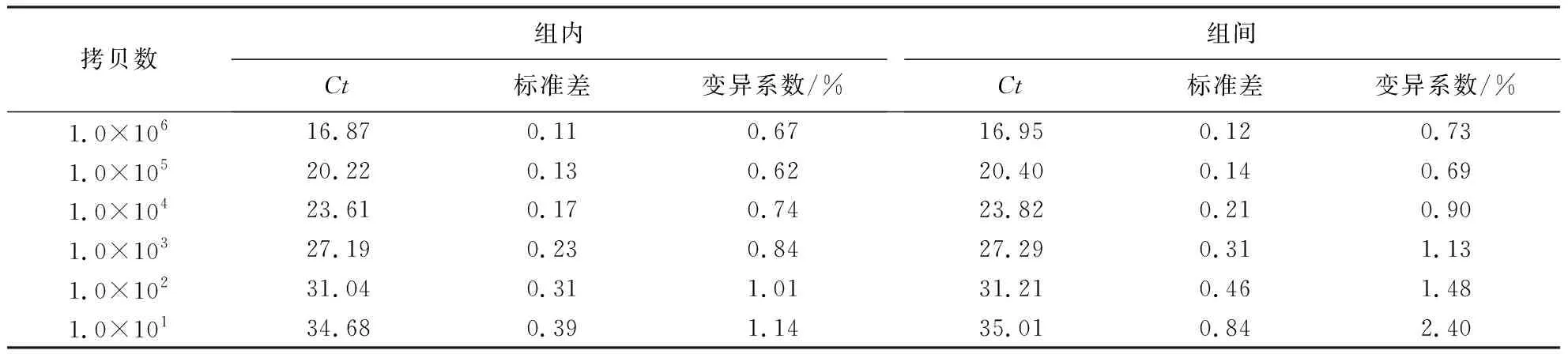
拷贝数组内Ct标准差变异系数/%组间Ct标准差变异系数/%1.0×10616.870.110.6716.950.120.731.0×10520.220.130.6220.400.140.691.0×10423.610.170.7423.820.210.901.0×10327.190.230.8427.290.311.131.0×10231.040.311.0131.210.461.481.0×10134.680.391.1435.010.842.40
2.6 临床应用
2.6.1 临床样品检测 用优化后的最优实时荧光定量PCR方法对临床送检疑似DEV感染的14份病死鸭进行检测,检测出阳性样品12份,阳性率为85.71%(12/14);使用常规PCR方法检测出阳性样品10份,阳性率为71.43%(10/14),且PCR阳性样品经荧光定量检测也均为阳性,阳性符合率为100%.经病毒分离鉴定后获得8株DEV,阳性率为57.14%(8/14),且8份分离的病料经常规PCR检测均为阳性,阳性符合率为100%.对这8份样品的gE基因进行克隆,结果可见,8株DEVgE基因相互之间的核苷酸序列同源性为100%,与DEV经典强毒株CHv(GenBank登录号:JQ647509)gE基因核苷酸序列的同源性也为100%.
2.6.2 人工感染试验 分别采集攻毒3 d后番鸭的肝脏和食道黏膜刮取物,按常规方法研磨处理后,提取核酸,用优化的条件进行实时荧光定量PCR检测,每个样品检测3次.结果经计算表明,3只番鸭肝脏和食道黏膜均检测出阳性扩增信号,肝脏中DEV的平均含量为7.47×104拷贝·μL-1,食道黏膜中DEV的平均含量为2.02×105拷贝·μL-1.
3 讨论
实时定量PCR方法是指在PCR指数扩增期间通过连续监测荧光信号强弱的变化来即时测定特异性产物的量,并据此推断目的基因的初始量.TaqMan实时荧光定量PCR方法是指在PCR扩增时加入一个特异性的寡核苷酸荧光探针,该探针两端分别标记一个报告荧光基团和一个淬灭荧光基团.探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5′-3′端外切酶活性将探针酶切降解,导致报告荧光基团与淬灭荧光基团分离,使荧光监测系统可接收到荧光信号.与常规PCR方法相比,该方法自动化程度高、特异性强,可有效避免PCR潜在的污染问题[19-20].
本试验建立了基于TaqMan探针检测DEV的实时荧光定量PCR方法,该方法特异性强,对DEV强毒株和疫苗株检测均出现阳性荧光信号,对常见水禽传染病病原(MDPV、GPV、DAdV-A、DHAV-1、DHAV-3、MDRV、N-DRV、AIV、APMV-1、E.coli、R.A.、P.M.)均无交叉反应(检测均为阴性);灵敏度高,最低检测限仅为10拷贝·μL-1,较常规PCR方法敏感100倍;重复性好,组内和组间重复试验的变异系数均较低(最高仅为1.14%和2.40%).应用建立的TaqMan实时荧光定量PCR方法对14份临床送检疑似样品进行检测发现,其阳性率为85.71%(12/14),与常规PCR方法、病毒分离鉴定的阳性符合率均为100%,表明临床送检疑似样品感染DEV的症状较为典型.2015年以来,我省多地成年番鸭和半番鸭出现典型的鸭瘟感染症状,经病毒分离鉴定和序列分析证实均为DEV感染[18,21].本实验室研究证实,当前商品化的DEV疫苗株对DEV强毒株可提供有效保护[18].虽然我省1999—2014年未出现DEV感染,但在当前养鸭业的生产实际中仍需按照科学的免疫程序接种DEV活疫苗,以避免更大的经济损失.
