入侵植物互花米草上的蚜虫新纪录:一条蚜及其种群分化
2018-12-14李俊洁吴杨雪张宜辉黄晓磊
李 强,李俊洁,吴杨雪,张宜辉,黄晓磊∗
(1.闽台作物有害生物生态防控国家重点实验室,福建农林大学植物保护学院,福建福州350002;2.厦门大学环境与生态学院,福建厦门361102)
互花米草(Spartina alterniflora)起源于美洲大西洋海岸,为多年生草本植物,隶属于禾本科Poaceae米草属Spartina。互花米草茎秆粗壮,地下根系发达,具有很强的生产力、繁殖力以及抗盐碱等生物学特性。二十世纪七十年代,美国本土的互花米草被广泛应用于沿海地区固沙促淤、减浪护堤、重建滩涂盐沼生态系统(Knutson et al.,1982;方民杰,2012;钦佩等,2012;杨东等,2014)。1979年,我国分别从美国北卡罗来纳州、佐治亚州和佛罗里达州引进了三种不同生态型的互花米草。虽然引种前期产生了一定的经济和生态效益,但由于互花米草的快速扩张,严重危害了沿海地区盐沼生态系统,因此2003年被中国环境保护部列为入侵物种(王卿等,2006)。
目前已知仅少数蚜虫物种可寄生米草属植物,包括:Anoecia corni取食S.cynosuroides,Sipha littoralis取食S.maritima及S.townsendii,Prociphilus erigeronensis取食S.patens(Blackman et al.,2018)。但互花米草上尚无蚜虫纪录,不管是在其原产地美国(Gary Miller,USDA,personal communication),还是在其入侵地区。然而在近期调查中,我们于厦门大学翔安校区的互花米草培育温室中发现大量取食该植物的蚜虫,经形态鉴定确定为一条蚜Hysteroneura setariae。
一条蚜隶属于半翅目(Hemiptera)蚜科(Aphididae)蚜族(Aphidini),被认为起源于北美洲,并在北美温带地区周期性孤雌生殖,一般在欧洲李(Prunus domestica)完成有性世代。1940年,北非地区也发现了该蚜虫的存在。1976年,澳大利亚李属植物P.persica上发现了一条蚜的性蚜和卵,但其是否在澳大利亚进行全周期生活尚未可知(Carver,1976)。一条蚜在1960年代中后期经历了一个快速扩散的过程,其无性生殖世代已经广泛的分布在世界范围内较为温暖的地区,包括印度、澳大利亚、南非、东南亚等地区(Blackman et al.,2018)。一条蚜主要取食禾本科植物,如水稻、甘蔗和玉米等,一般在穗的基部聚集为害,有时还会取食叶片以及未成熟的种子,造成谷物表面坏死斑点甚至空壳(Akibobetts et al.,1978;Noordam,2004)。Jahn等人(2005)曾报道在大豆(soybean)上发现一条蚜。另外在一些莎草科(Cyperaceae)以及油棕和椰子的幼苗上也偶见发生(Stoetzel et al.,2001;Blackman et al.,2018)。一条蚜还是重要的植物病毒携带者,比如南瓜花叶病毒(WMV)(Coudriet,1962)、甘蔗花叶病毒(SCMV)(Harborne,1988)以及大豆花叶病毒(SMV)(Quimio et al.,1993;Wijerathna et al.,1995)等,给农业生产造成重大损失。
本研究在对华南地区不同寄主植物上的一条蚜广泛采样的基础上,基于DNA条形码技术和分子系统发育分析,期望对互花米草上的一条蚜种群开展进一步的分子鉴定,并探究互花米草上一条蚜种群的来源。通过整合中国华南、印度、巴基斯坦、美国等地区一条蚜样品的序列数据,探讨不同地区或寄主植物一条蚜种群的遗传分化格局。
1 材料与方法
1.1 样品采集
2015-2018年,对中国华南地区(福建、广东、云南、海南、广西)进行了广泛的野外采样,每号样品保证为同一寄主同一生态位上的单克隆。采集到的样品均放入装有95%酒精的冻存管并置于-20℃环境中保存。共有62号一条蚜样品用来进行分子生物学试验以及系统发育分析,其中HL_20160302_Y1为采自互花米草上的样品。详细的样品编号、GenBank登录号、单倍型信息、寄主以及地理信息见表1,凭证标本均放置于福建农林大学植物保护学院。
1.2 DNA提取、PCR和测序
本研究使用DNeasy Blood&Tissue Kit(QIAGEN,GERMANY)试剂盒来提取单个蚜虫的基因组DNA。选用的分子标记为线粒体细胞色素氧化酶I亚基(cytochrome oxidase subunit I,COI),并由 COI的通用引物 LepF(5′-ATTCAACCAATCATAAAGATATTGG-3′) 和 LepR(5′-TAAACTTCTGGATGTCCAAAAAATCA-3′)(Foottit et al.,2008)进行目标片段的扩增。PCR扩增体系为:20 μL ddH2O,3 μL 10×buffer,2.4 μL dNTP,0.6 μL 前后引物 (10 μmol·L-1),0.4 μL Taq DNA聚合酶 (5 U·μL-1)and 3 μL DNA模板。反应条件为:95℃预变性5 min;94℃变性20 s,50℃退火30 s,72℃延伸2 min,共35个循环;最后,72℃的终延伸10 min。PCR产物用1%的琼脂糖凝胶电泳检测,目的条带清晰的样品寄送到上海生工生物有限公司进行双向测序。
1.3 数据处理
用BioEdit软件(Hall,1999)对所获得的序列进行汇总,依据每号样品的峰图对其双向序列进行校正。另外从GenBank数据库中下载了15条一条蚜的COI序列(表1)。将整合自测序列以及GenBank数据库下载的序列,进行下一步的系统发育分析。用MAFFT(Katoh et al.,2013)对序列进行对齐,并用BioEdit将序列切成相同的长度。准备好的序列文件使用MEGA 7.0(Kumar et al.,2016)基于Kimura 2-parameter(K2P)(Kimura,1980)模型计算遗传距离并分析序列的碱基的组成以及位点的变异情况。基于Akaike Information Criterion(AIC)使用jModelTest 2.1.7(Darriba et al.,2012)计算最佳核苷酸替换模型。选择同为蚜族的棉蚜Aphis gossypii和竹色蚜Melanaphis bambusae作为外群,使用MEGA 7.0、RaxML以及MrBayes 3.2.6等软件,使用邻接法(Neighbor-joining,NJ)、最大似然法(Maximum likelihood,ML)和贝叶斯法(Bayesian inference,BI)分别对一条蚜的序列构建系统发育树。另外对获得的COI序列进行单倍型网络构建,以探究一条蚜不同地理种群之间的种群遗传结构。首先将COI序列导入到DNAsp v5(Librado et al.,2009)来分析单倍型的组成,之后用NETWORK 5.0.0.3(Bandelt et al.,1999)来构建Median-joining单倍型网络。

表1 样品的采集信息、单倍型及GenBank登录号信息1)Table 1 Samples used in this study,with collection information,haplotype number and GenBank accession number

续表1Table 1(Continued)

续表1Table 1(Continued)
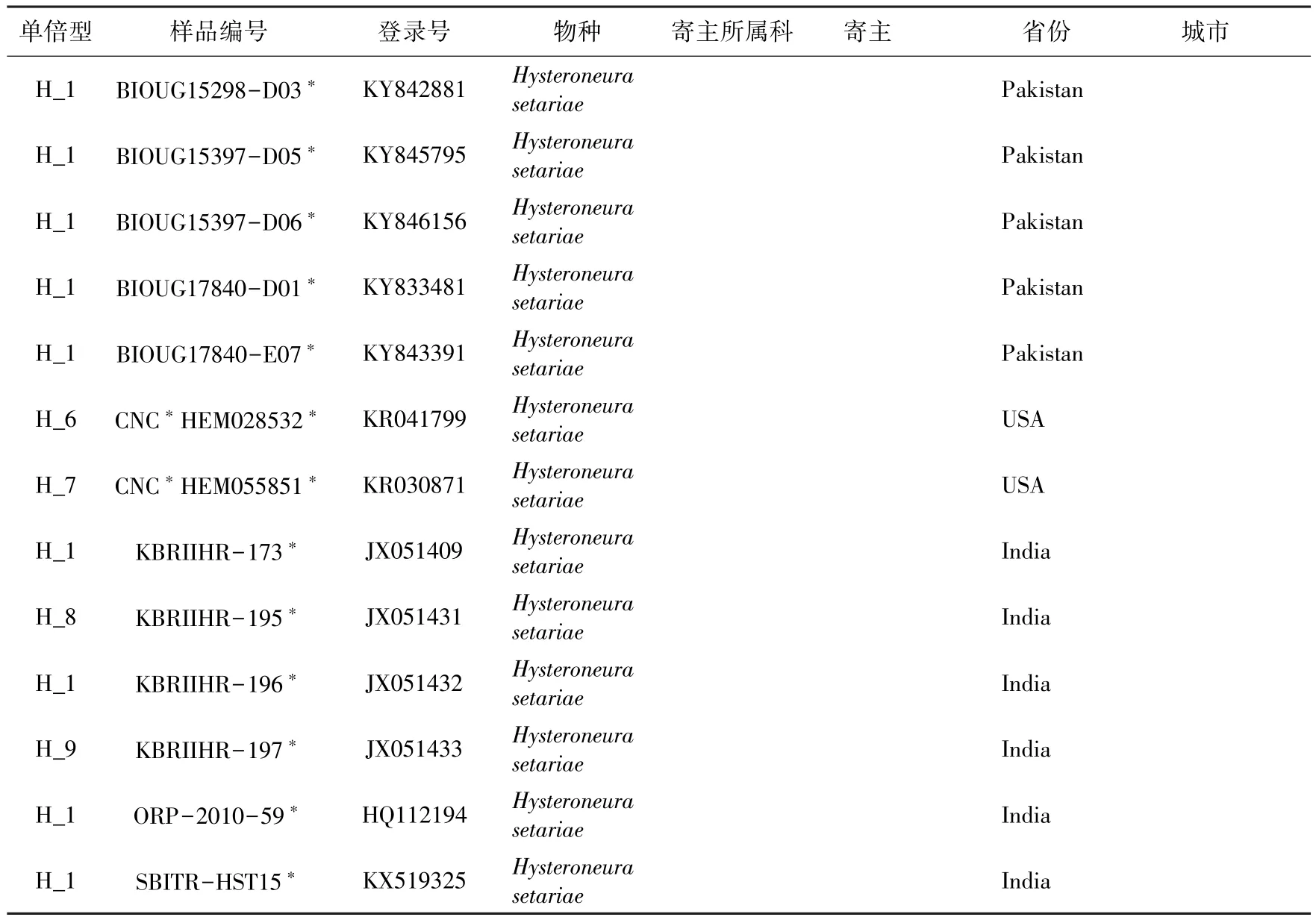
续表1Table 1(Continued)
2 结果与分析
2.1 序列特征
本研究所获得的62条序列最终统一截齐为560 bp,共包含554个保守位点,6个可变位点以及3个简约信息位点。序列核苷酸组成呈现很明显的A+T偏向(T:40.2%,C:14.8%,A:35.7%,G:9.3%)。加上NCBI下载的15条一条蚜序列最终共77条序列,包含546个保守位点,14个可变位点和4个简约信息位点。序列核苷酸碱基T、C、A、G的占比分别为40.2%、14.8%、35.7%和9.3%,依然呈现非常明显的A+T偏向。
2.2 遗传距离及系统发育分析
基于K2P模型计算的自测样品序列的遗传距离范围为0%-0.7%,平均遗传距离为0.2%;加上NCBI下载的一条蚜序列后,遗传距离范围0%-1.6%,平均遗传距离0.7%。值得注意的是,序列间最大遗传距离(1.6%)来自于美国的样品(表2)。jModelTest软件所计算的最佳核苷酸替换模型为GTR+I,基于此模型构建的BI和ML系统发育树以及基于K2P模型计算的NJ树均显示相似的拓扑结构(图1,附图1、2)。中国、巴基斯坦以及印度的一条蚜样品在系统发育树上很好的聚成一支,但是来自美国的两号样品(CNC∗HEM028532和 CNC∗HEM055851)很明显的聚成了独立于其他分支的两个单独分支,并且均具有很高的支持率以及后验概率。在厦门地区取食互花米草的一条蚜样品与其他不同地区、不同寄主的一条蚜聚在同一分枝。

图1 基于COI序列构建的贝叶斯系统发育树(BI)Figure 1 The BI phylogenetic tree based on COI

表2 一条蚜不同样品组成的遗传距离范围以及平均遗传距离Table 2 The genetic distances for different sequence sets of Hysteroneura setariae
2.3 单倍型与单倍型网络分析
本研究所涉及的77号样品中,共包含9个COI单倍型(表1)。根据单倍型网络分析可以看出(图2),H_1包含了 77.9%的样品(60号),覆盖了 Guangdong、Yunnan、Fujian、Hainan、Guangxi、Pakistan、India等地。相较于其他单倍型,H_6和H_7呈现了较大的分化,这两条序列分别代表美国的两号样品。

图2 基于COI序列的单倍型网络图Figure 2 Haplotype networks based on COI sequences
3 讨论
由一条蚜的系统发育树以及单倍型组成可以看出,采自厦门温室中互花米草上的一条蚜与同域分布但取食其他寄主植物(马唐属、属以及芒属等)的很多一条蚜样本具有同一单倍型,并位于系统树的同一分支。考虑到厦门大学翔安校区温室中的互花米草均为采自各地的种子种植而来,不存在一条蚜随植株远距离扩散的可能,因此取食互花米草的一条蚜应该由周边其他寄主种群扩散而来。
在DNA条形码研究中,判别为不同物种的遗传距离阈值在不同类群中有所差别。Weigand等人(2013)在关于Carychiidae的研究中表明,3.2%可以用来区分不同的物种。在鳞翅目中,2%常用区分不同的物种(Hajibabaei et al.,2006)。在蚜虫相关研究中,2%也被用来作为区分种内与种间关系阈值(Foottit et al.,2008;Liu et al.,2013;Zhu et al.,2017)。在本研究中,自测样品覆盖了中国华南地区,其样品之间最大遗传距离仅0.7%,远远低于种间距的阈值。自测样品与从GenBank下载的巴基斯坦和印度的序列之间遗传距离也为0.7%,表明中国华南及东南亚地区分布的一条蚜遗传分化不大。一条蚜原产地北美洲的序列与其他样品间遗传距离非常显著,最大达到1.6%,暗示一条蚜从原产地北美向世界其他地区扩散后,在不同的地理区域已形成一定的遗传分化。然而,北美种群与亚洲种群明显的遗传分化主要由地理因素还是寄主植物因素所导致,尚需要基于更多样品的深入分析。
目前防控互花米草的主要方法有物理清除、化学农药和生物防治等方法(Hedge et al.,2003)。物理防治主要通过手工拔除、遮阴、刈割等(李艳丽等,2009),有研究表明,围堤浸泡互花米草使其缺氧而亡也是一种相对有效的防治方法(Aberle,1990),使用物理的方法虽然暂时有效,但是费时费力高成本。而且互花米草的根系比较发达,使用物理的方法常常达不到根除的效果(李贺鹏等,2007)。化学防治主要是通过施用一些除草剂(草甘膦、咪唑烟酸以及米草败育灵),施用除草剂会对其周边生态系统造成非常大的伤害,并且受季节和天气的影响(Norman et al.,1994)。关于对互花米草的生物防治学术界持保守态度。主要是由于互花米草的天敌作用比较复杂,因为有些天敌不仅作用于互花米草,有时还会对非靶标生物造成危害,更有甚者会导致新的生物入侵。一些有益的探索,例如大丰王港用芦苇替代互花米草的生态工程(张茜等,2007),以及利用真菌(麦角菌Claviceps purpurea)和植食性昆虫(飞虱Prokelisia marginata以及蝗虫Melanoplus sp.等的寄生或取食,暗示生物防控或可作为有效控制互花米草扩散的方法(Johnson et al.,2008;Grevstad et al.,2012)。本研究首次发现一条蚜取食互花米草的纪录,将为后期研究互花米草的生物防控提供有效参考。

图1 基于COI序列构建的最大似然法系统发育树(ML)
Figure 1 The ML phylogenetic tree based on COI

图2 基于COI序列构建的邻接法系统发育树(NJ)
Figure 2 The NJ phylogenetic tree based on COI
