光谱法及分子模拟研究青蒿素与小牛胸腺DNA的相互作用
2018-12-13金丽虹王梦欣周雅静朱海焕刘美慧张善凯顾锡辉申炳俊
金丽虹 , 王梦欣, 周雅静, 朱海焕, 刘美慧, 张善凯, 顾锡辉, 申炳俊*
(1. 长春理工大学 生命科学技术学院, 吉林 长春 130022; 2. 河南科技学院新科学院 生物与化学工程系, 河南 新乡 453003)
1 引 言
青蒿素(Artemisinin,简称QHS)是一种具有过氧桥结构的倍半萜内酯化合物,为植物黄花蒿(A.annuaL.)抗疟的有效成分。20世纪70年代,中国科学家首次分离得到青蒿素并解析了其化学结构,作为最有效的抗疟药物青蒿素受到了全世界高度关注[1-2]。随着青蒿素研究的不断深入,人们发现,除了具有抗疟活性外,青蒿素还在抗血吸虫[3]、抗内毒素[4]、抗变态反应[5]、抗红斑狼疮[6]、增强机体免疫[7]等方面也有药理作用。同时,青蒿素在治疗肿瘤和艾滋病方面展现出了诱人的应用前景[8-9]。2015年,屠呦呦研究员因发现青蒿素而获得诺贝尔生理学或医学奖[10],这使得有关青蒿素的研究再次成为热点。全世界的学者们发表了大量与青蒿素有关的研究论文,其内容涉及疟原虫抗药性、抗疟和抗癌作用机制、作用靶点理论、生物活性及代谢调控等。然而令人遗憾的是,青蒿素抗疟和抗癌的具体分子机制至今尚未完全阐明。
DNA是所有生命活动的基础,也是一些药物最主要的作用靶点。药物小分子与DNA的相互作用能不同程度影响DNA的生理和物理化学性质,改变DNA的转录和复制,进而表现出抗病毒、抗肿瘤活性[11]。小分子物质与DNA的相互作用主要有3种模式:沟槽作用、嵌入作用和静电作用,其中具有选择性的沟槽和嵌插作用是药物分子和DNA相互作用研究的重点[12-13]。因此,在分子水平研究药物与DNA的相互作用机理,这对于了解药物药理活性、毒性以及预测药物相互作用等方面具有重要意义。已有文献表明,青蒿素可以嵌插到DNA分子中,两者间能形成QHS-DNA复合物[14]。但青蒿素嵌插到DNA的位置、非共价作用方式以及热力学参数等信息仍需要进一步研究。
基于此,本文采用吸收光谱、荧光光谱、共振散射光谱以及分子模拟等技术研究了青蒿素与DNA的相互作用模式、结合距离、分子间作用力、最佳作用位点等信息。实验结果为进一步揭示青蒿素抗疟、抗癌作用机理提供了依据。
2 实 验
2.1 材料与仪器
小牛胸腺DNA购买于Sigma公司,用pH 7.4的Tris-HCl缓冲溶液配成ctDNA储备液。青蒿素购买于成都普菲德公司,贮液用无水乙醇溶解配成。溴化乙锭(EB)购买于Sigma公司,用二次蒸馏水溶解配成储备液。上述储备液均置于4 ℃冰箱中保存。
测试仪器包括:UV-2550紫外-可见分光光度计(日本岛津公司),F-280荧光分光光度计(中国天津港东公司),DELTA320型pH计(瑞士Mettler Toledo公司),DC-4006高精度恒温水浴(上海菁海仪器公司)。
2.2 实验方法
2.2.1 紫外吸收光谱
于7 mL比色管中依次加入1 mL的Tris-HCl缓冲溶液(pH 7.4)、200 μL 4.5×10-4mol/L DNA储备液和不同体积的1.0×10-4mol/L青蒿素溶液,Tris-HCl缓冲溶液定容至4 mL,充分混合后于室温下作用30 min。以相应浓度的青蒿素Tris-HCl溶液为参比,扫描205~345 nm范围内QHS-DNA体系吸收光谱。Tris-HCl缓冲液作为参比,获得2.0×10-5mol/L 青蒿素Tris-HCl溶液吸收光谱。
2.2.2 荧光光谱
7个比色管中均加入1 mL Tris-HCl缓冲溶液、100 μL 4.5×10-4mol/L DNA储备液和180 μL 3.0×10-5mol/L EB溶液,充分混合于恒温水浴(298,304 K)中作用30 min。然后向每个EB-DNA体系中,依次加入不同体积青蒿素溶液,Tris-HCl缓冲溶液定容至3 mL,充分混合在恒温水浴中继续作用30 min,获得EB-DNA-QHS三元体系。扫描荧光发射光谱,激发波长(λx)488 nm,发射波长范围550~700 nm,激发(Ex)/发射狭缝(Em)为10 nm/5 nm。
2.2.3 共振散射光谱
依次将1 mL Tris-HCl缓冲溶液、280 μL 4.5×10-4mol/L DNA储备液和一定量1.0×10-4mol/L青蒿素溶液加入到7 mL比色管中,Tris-HCl缓冲溶液定容至3 mL,充分混合后在室温下作用30 min。λem=λex进行同步扫描,得到共振散射光谱,激发/发射波长均为200~700 nm,狭缝设定同前。
2.2.4 分子对接模拟
由Auto Dock Tools软件平台进行分子对接计算。首先在小分子数据库(Zinc)中获得小分子青蒿素晶体结构(ZINC ID:452191)。由蛋白质数据库(Protein data bank,PDB)中获取小牛胸腺 DNA 晶体结构(PDB ID:1BNA),利用 Auto Dock4对其进行去水、加氢、加电荷等一系列初步处理。分子对接位点的活性区域包含整个DNA分子,活性区域大小为40 nm×40 nm×16 nm,格点步长为16 nm。使用拉马克遗传算法(LGA)对可能的构象和结合位点进行充分搜索,以结合能量最低的结构作为相互作用的最优模式。
3 结果与讨论
3.1 紫外吸收光谱法研究青蒿素与DNA的相互作用
3.1.1 青蒿素对DNA紫外吸收光谱的影响
青蒿素与DNA作用的紫外吸收光谱如图1所示。由图可知,青蒿素在220 nm区域显示出了较弱的吸收峰带,这是由于青蒿素氧上的孤对电子与双键之间发生了n→π*电子跃迁(见曲线1)。而DNA在258 nm的吸收峰源于碱基共轭双键结构(见曲线2)。与青蒿素作用后,DNA特征吸收峰出现减色效应,但最大吸收波长无明显偏移现象(见曲线3~5)。一般认为,小分子化合物与DNA相互作用后,若吸收光谱发生减少、红移,则表明小分子化合物是以嵌插方式与DNA结合,减色率大小及红移程度能初步反映小分子化合物与DNA相互作用的强弱;而小分子化合物若以静电作用与DNA结合,则峰位不发生改变,但有强度变化[12,15]。由此推断,青蒿素与DNA的结合模式可能为静电或分子部分结构发生嵌插作用。
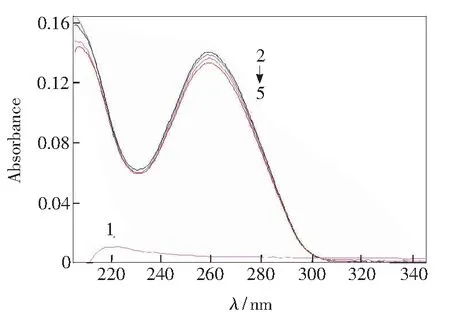
1:cQHS=2.0×10-5 mol/L; 2~5: cDNA=2.25×10-5 mol/L, cQHS=(0, 2.0, 6.0, 10.0)×10-6 mol/L.
3.1.2 青蒿素对DNA熔点的影响
小分子化合物以嵌插模式与DNA结合时,能增加双螺旋结构稳定性,DNA熔点(Tm)可提高5~8 ℃,而非嵌入式结合一般对DNA的Tm影响不大[16]。将DNA和DNA-QHS溶液分别放置于20~95 ℃环境中,10 min后迅速取出并测量A258 nm。根据fss=ΔA′/ΔA=(A-A0)/(Af-A0)(A为表观吸光度,A0为起始吸光度,Af为最终吸光度)[17],获得fss关于T的曲线,熔解曲线fss= 0.5处所对应的温度即为Tm,结果如图2所示。可以看出,DNA与青蒿素作用前后Tm分别为77 ℃和82 ℃,即Tm增加了5.0 ℃。因此,青蒿素与DNA发生了嵌插作用,该作用增加了DNA双螺旋结构稳定性。这与文献[14]结果一致。
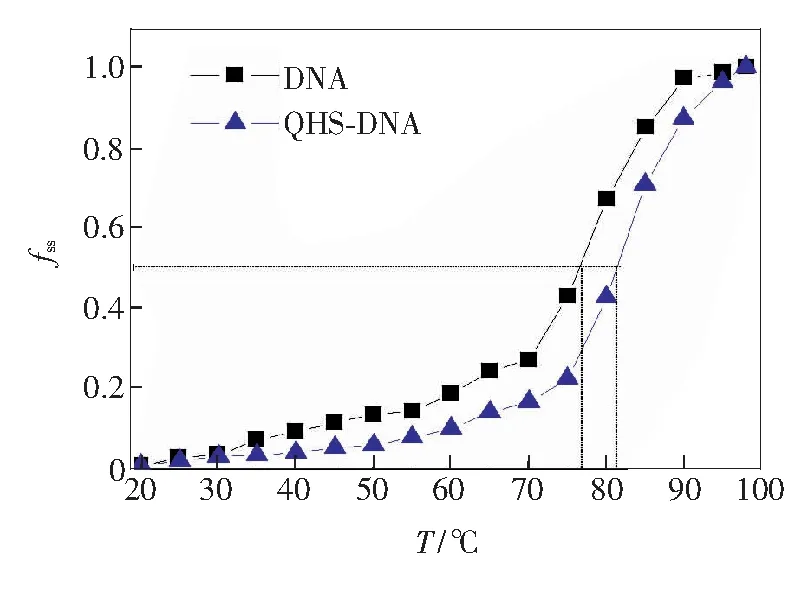
cDNA=3.7×10-5 mol/L, cQHS =9.0×10-5 mol/L.
3.2 荧光光谱法研究青蒿素与DNA的相互作用
DNA虽无内源性荧光,但可以通过荧光探针法研究其与青蒿素的相互作用。溴化乙锭(EB)是一种典型的DNA嵌入试剂,本身荧光强度不大,当嵌入到DNA碱基对间时,其荧光强度显著地增大,所以,EB被广泛应用于筛选抗肿瘤药物以及小分子与DNA间相互作用的研究[12,18]。不同浓度的青蒿素对EB-DNA体系的荧光猝灭光谱如图3所示。可以看出,浓度逐渐增加的青蒿素引起了EB-DNA体系601 nm处荧光强度显著降低,峰位略红移(3 nm)。造成荧光猝灭的原因有以下两种可能:(1)青蒿素、EB与DNA的结合位点相同,两者竞争结合导致嵌插进DNA中的部分EB被置换出来;(2)青蒿素、EB与DNA结合位点不同,青蒿素嵌插进DNA碱基对,引起DNA构象改变及EB被挤出。无论是以上哪种原因,青蒿素均以嵌入方式与DNA发生结合,所生成QHS-DNA二元体系具有低荧光强度的特点,这与紫外吸收光谱和熔点实验结论是一致的。
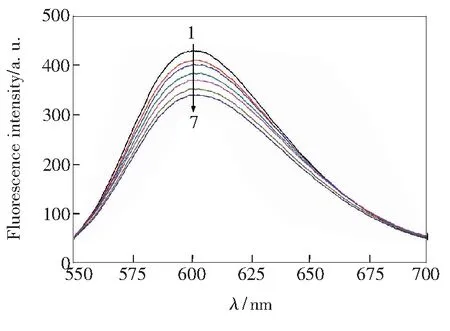
cDNA =1.5×10-5 mol/L, cEB =1.8×10-6 mol/L, 1~7: cQHS=(0, 1.0, 3.0, 5.0, 7.0, 9.0, 11.0)×10-6 mol/L.
3.2.1 荧光猝灭方式
为探讨青蒿素对DNA-EB的荧光猝灭机制,采用Stern-Volmer方程[19-20]F0/F=1+Kqτ0[Q]=1+Ksv[Q]处理数据。以F0/F对[Q]作图,Stern-Volmer拟合,由直线斜率可获得青蒿素对DNA-EB体系的猝灭常数Kq和Ksv值。由表1可知,Ksv值随温度的升高而降低,且Kq的数量级为1012,大于2×1010L/(mol·s)[12](最大碰撞速率常数),说明青蒿素对EB-DNA荧光强度的猝灭类型为静态猝灭。
由Lineweacer-Burk双对数方程 (lg[(F0-F)/F]=lgKa+nlg[Q])[12]求得青蒿素与EB-DNA的结合常数Ka和结合位点数n。具体为:T=298 K时,Ka、n为1.43×103L/mol和0.76;T=304 K时,Ka、n为0.99×103L/mol和0.74。结合常数随温度的升高而降低,说明温度是影响结合能力的有力因素。而Ka数量级在102~103,低于经典DNA嵌插剂EB的结合常数(Ka= 1.4×106L/mol)[21]。这进一步证明青蒿素虽然以嵌插方式与DNA结合,但青蒿素分子仅有部分结构嵌入到DNA碱基对中,其嵌插能力弱于EB。

表1 不同温度下青蒿素对DNA-EB的猝灭参数
3.2.2 热力学参数及非共价键类型
小分子与生物大分子间的主要结合力可以通过热力学参数(ΔH、ΔS和ΔG)大小和符号进行判断。当实验体系温度变化很小时,焓变可被视为常数,其热力学参数可由Van’t Hoff方程[20]ln(KA2/KA1)=(1/T1- 1/T2)×ΔH/R和ΔG=-RTlnKa=ΔH-TΔS计算获得。青蒿素与EB-DNA体系反应的热力学参数结果见表2。根据Ross[22]的结果,ΔH<0、ΔS<0是范德华力和氢键的特征,由此可以判断,青蒿素与DNA间的相互作用力主要是范德华力和氢键。ΔG、ΔH为负值,表明该体系的结合为自发、放热过程。

表2 青蒿素与EB-DNA热力学参数
3.3 共振散射光谱法研究青蒿素与DNA的相互作用
青蒿素、青蒿素与DNA反应体系的共振散射光谱(RLS)分别见图4(a)、(b)。可以看出,青蒿素自身在372.1~400.0 nm范围有RLS信号,两个尖锐峰位于450 nm和467 nm处,RLS强度随着青蒿素浓度的增加而增大。依据文献[12, 17]研究表明,RLS强度与散射粒子的浓度成正比,因此RLS信号出现增强。与青蒿素相比,DNA溶液的RLS信号比较弱小(见图4(b)中曲线5),当与青蒿素反应后引起了RLS信号增强(见图4(b)中曲线1~4),RLS强度随青蒿素浓度增加而增大,其中以467 nm处的增强效果最为显著,而且峰形发生了变化。这是由于青蒿素与DNA两者间发生作用形成了复合物,该复合物在467 nm处有较强的RLS信号。体系中青蒿素浓度增大,使其嵌入到DNA碱基中分子亦增加,进而引起QHS-DNA复合物分子体积增大,分子量增加。因此,随着青蒿素浓度的增加,QHS-DNA体系RLS信号强度增大。
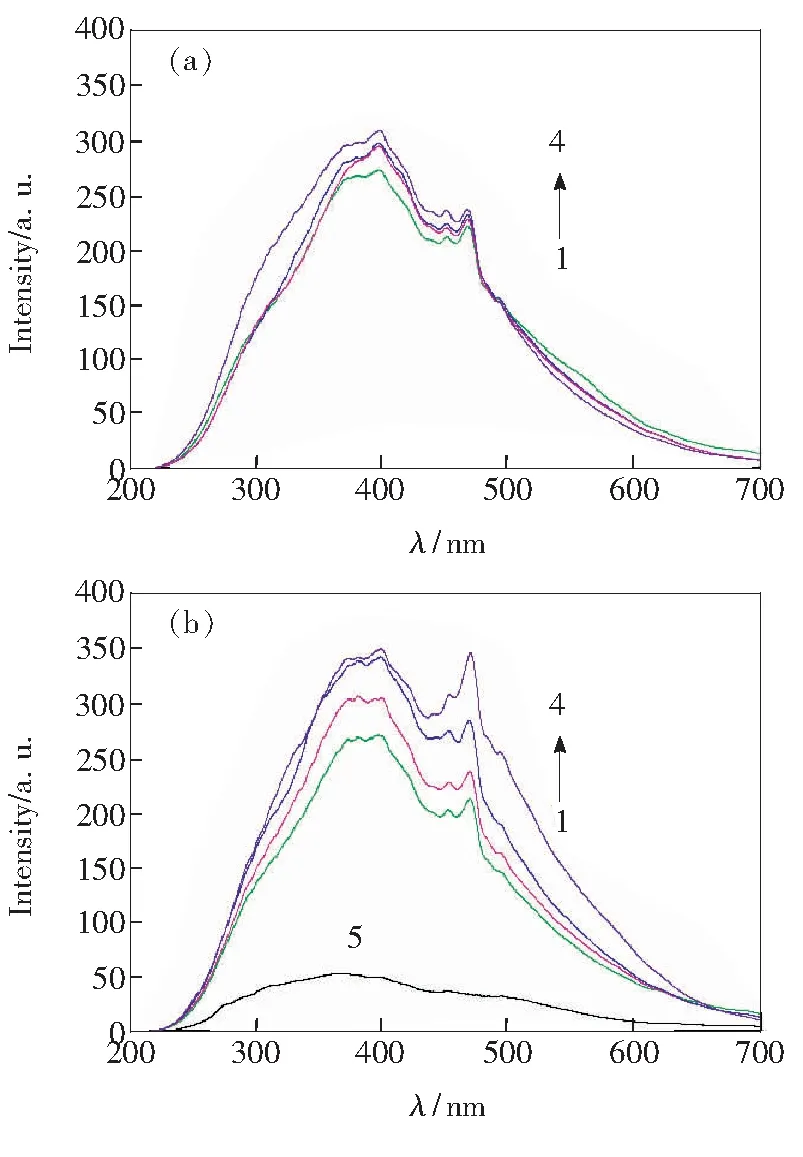
(a)1~4: cQHS=(1.0, 2.0, 3.0, 4.0)×10-6 mol/L. (b)1~4: cQHS=(1.0, 2.0, 3.0, 4.0)×10-6 mol/L, cDNA=4.2×10-6 mol/L; 5: cDNA=4.2×10-6 mol/L.
3.4 分子对接法研究青蒿素与DNA的相互作用


(a), (b): Molecular docking of QHS-dodecamer(1BNA) interaction. (c): Binding force and distance of QHS-DNA complex.
4 结 论
在模拟生理酸度(pH 7.4)条件下,运用紫外吸收光谱法、荧光光谱法和共振散射光谱并结合分子模拟手段,研究了青蒿素与小牛胸腺DNA的相互作用。结果显示,在熵驱动下,青蒿素吡喃环部分结构能自发地嵌插到DNA小沟区域GA碱基对间,青蒿素与DNA间形成了复合物,氢键和范德华力是两者间结合的主要非共价作用方式,其作用强度适中,过程为放热反应。研究结果对于理解青蒿素与DNA作用机理以及进一步揭示青蒿素抗疟、抗癌机制提供了理论基础。
