氮沉降对亚热带常绿阔叶天然林不同季节土壤微生物群落结构的影响*
2018-12-13郑裕雄曹际玲杨智杰林成芳杨玉盛
郑裕雄 曹际玲 杨智杰 林成芳 杨玉盛
(福建师范大学湿润亚热带山地生态国家重点实验室培育基地,福建师范大学地理科学学院,福州 350007)
由于化石燃料燃烧、氮肥施用和集约畜牧业等人为活动的影响,目前陆地上年均大气氮沉降量已达43.47 Tg·a-1(以氮(N)计,下同),预计至2050年大气氮沉降量将较2000年增加2倍[1],而我国亚热带地区氮沉降尤为明显。氮沉降的增加会直接影响陆地生态系统的结构和功能。森林是陆地生态系统的重要组成部分,是大面积氮沉降的直接承受者,因此,氮沉降对森林生态系统的影响已引起广泛关注[2]。
土壤微生物是森林生态系统养分循环的重要参与者,在土壤碳氮循环中起着极其重要的作用[3]。目前,关于氮沉降对土壤微生物群落结构的影响研究主要集中于北美和欧洲等温带地区的森林和草原[4]。相关研究表明,氮沉降可改变土壤微生物生物量,使其群落结构发生分异,改变细菌与真菌的比值[5]。也有研究发现,短期适量的氮添加提高了土壤底物有效性[6],促进了细菌或真菌等微生物类群的生长[7]。而Zechmeister-Boltenstern等[8]通过模拟氮沉降研究土壤微生物群落结构,并利用磷脂脂肪酸(PLFA)技术分析,发现过量的氮添加(大于等于32 kg·hm-2·a-1)可抑制真菌等土壤微生物类群的生长代谢。此外,土壤微生物对氮沉降的响应还具有季节性差异[9],Yan等[10]研究氮沉降对不同季节温带森林土壤微生物的影响时发现,春秋季节土壤微生物多样性对氮添加的响应要强于夏季。相比温带,亚热带森林处于氮富集状态,土壤较高的氮有效性会影响土壤微生物群落活性[11]。氮富集的亚热带森林地区土壤微生物群落对不同水平氮添加的响应是否明显仍不清楚,因此,了解其响应程度对于了解土壤微生物对未来全球环境变化的响应起到至关重要的作用。同时,亚热带地区气象变化更加复杂,底物有效性在不同季节发生变化,可能导致季节间微生物群落结构差异更加突出。但现有关于亚热带森林地区不同水平氮添加及其与季节变化的交互作用对土壤微生物群落结构影响的研究较为鲜见。基于此,本研究假设:(1)亚热带森林地区低水平氮添加对土壤微生物群落结构影响不明显,而高水平氮添加对土壤微生物群落结构产生显著影响;(2)不同季节微生物群落结构对不同水平氮沉降的响应不相同,在夏季微生物群落结构变化对氮添加的响应强于春、秋和冬季节。
我国亚热带森林是全国最重要的森林碳汇,有着极强的能量转化和物质循环能力[12]。细柄阿丁枫(Altingia gracilipes)是金缕梅科蕈树属,其枯枝落叶量大且易于分解,具有培肥土壤、提高地力的作用,是我国亚热带地区地带性植被的建群种之一。本文选取位于福建建瓯万木林自然保护区内保存较为完整的亚热带细柄阿丁枫天然林为研究对象,采用不同浓度梯度氮添加实验模拟大气氮沉降,通过PLFA分析技术探究氮沉降对亚热带森林土壤微生物群落结构影响的季节动态,旨在分析氮沉降对亚热带森林地区养分循环的微生物影响机制。
1 材料与方法
1.1 试验区概况
研究区域位于福建省建瓯市万木林自然保护区,地处武夷山脉东南(27°03′N,118°09′E),气候类型为中亚热带季风气候。该区域年平均气温为19.4℃,年均降水量1 731.4 mm,年均蒸发量1 466 mm,相对湿度81%,全年无霜期达277 d。土壤类型为花岗岩发育的山地红壤。研究植被群落细柄阿丁枫(Altingia gracilipes)为主要建群种,乔木层主要由细柄阿丁枫(Altingia gracilipes)、少叶黄杞(Engelhardtia fenzelii)、木荷(Schima superba)、浙江桂(Cinnamoum chekiangense)、杜英(Elaeocarpus sylvestris)等组成。灌木层以草珊瑚(Sarcandra glabra)和狗骨柴(Tricalysia dubia)为主,草本层以狗脊(Woodwardia japonica)为主。细柄阿丁枫(Altingia gracilipes)树龄125 a,平均树高28 m,平均胸径45.2 cm,密度为每公顷235 株,坡向北偏东15°,坡度27°,海拔390 mm,群落沿山脊向下延伸。土壤基本理化性质为:pH4.48,全氮1.7 g·kg-1,有效磷1.67 mg·kg-1,容重0.90 g·cm-3。
1.2 试验设计与样品采集
试验开始于2009年12月,在细柄阿丁枫天然林随机设置立地条件基本相似的9块5 m×5 m样方,相邻样方之间留一条2 m宽的缓冲带防止相互干扰,并在样方上方及左右两边插入聚氯乙烯(PVC)隔水板,防止下雨时土壤侵蚀造成氮肥流失。参照中亚热带地区研究氮沉降处理的强度(36.3 kg·hm-2·a-1),并结合未来大气氮沉降可能继续增加的氮沉降趋势,试验设置了3个氮水平:对照(CK, 0 kg·hm-2·a-1)、低氮(LN, 50 kg·hm-2·a-1)、高氮(HN,100 kg·hm-2·a-1),每个处理设3次重复。建立样地后自2010年冬季开始采用硝酸铵(NH4NO3)模拟氮沉降,每月初以溶液的形式在样地喷洒。按照不同处理水平,将每个样地所需的氮肥溶解于2 L(相当年降雨量增加约2 mm)去离子水中,用背式喷雾器在林地均匀喷洒,对照样地喷洒等体积的去离子水,以消除外加水的影响。
模拟氮沉降满2年后,分别于2012年的春季、夏季、秋季及冬季(2013年1月)采集4次土样。先去除表面凋落物,再用土钻在每个小样方内采用蛇形5点取样法采集0~10 cm土层土壤,将每个小区内5个点的土样混合均匀组成1个混合土样,于24 h内去除植物根系及土壤入侵物,过2 mm筛,用冰袋运回实验室,-80℃冰箱保存用于土壤微生物磷脂脂肪酸的测定。
1.3 PLFA提取与测定
PLFA的提取:采用氢氧化钾—甲醇溶液甲酯化方法[13]。(1)称取10 g鲜土于50 mL玻璃离心管中,加入15 mL 0.2 mol·L-1的氢氧化钾—甲醇溶液,80 r·min-1低速振荡5 min后,37℃温水浴10 min,振荡和水浴各反复6次浸提;(2)加入3 mL 1.0 mol·L-1的冰醋酸溶液,充分摇匀后,加入10 mL的正己烷,充分摇匀后于4℃、2 000 r·min-1下离心15 min,将上清液转入玻璃试管内,用高纯氮气吹;(3)在玻璃试管中加入1 mL甲基叔丁基醚—正己烷溶液(体积比为1∶1),手动摇匀,充分溶解后转入样品瓶中,-20℃冰箱保存。
PLFA的测定:样品中加入10μL浓度为1 mol·L-1的正己烷酸甲酯(19∶0)正己烷溶液为内标,采用气相色谱-质谱联用仪(GC-MS)(7890A-5973C,Agilent,美国)进行PLFA的测定。
PLFA的命名参照Frostegard方法[14]。PLFA含量用nmol·g-1表示。
以磷脂脂肪酸i14∶0、i15∶0、a15∶0、i16∶0、i17∶0、a17∶0加和表征革兰氏阳性细菌(Gram-positive bacteria,G+)量,以磷脂脂肪酸16∶1ω7c、16∶1ω7t、18∶1ω7c、18∶1ω7t、cy17∶0、cy19∶0加和表征革兰氏阴性细菌(Gram-negative bacteria,G-)量,以磷脂脂肪酸i14∶0、i15∶0、a15∶0、i16∶0、i17∶0、a17∶0、16∶1ω7c、16∶1ω7t、18∶1ω7c、18∶1ω7t、cy17∶0、cy19∶0加和表征细菌(Bacteria,B)量,以磷脂脂肪酸18∶1ω9c、18∶2ω6,9c加和表征真菌(Fungi,F)量,以磷脂脂肪酸7Me17∶0、10Me18∶0、10Me19∶0加和表征放线菌(Actinomycetes,Act)量,以磷脂脂肪酸cy17∶0、cy19∶0表征环丙烷脂肪酸(Cyclopropane fatty acids,Cy)量,以磷脂脂肪酸16∶1ω7c、18∶1ω7c表征其前体脂肪酸(Precursor fatty acids,Pre)量,以磷脂脂肪酸i14∶0、i15∶0、i16∶0、i17∶0加和表征顺式异构脂肪酸(Isomeric fatty acids,Iso)量,以磷脂脂肪酸a15∶0、a17∶0加和表征反式异构脂肪酸(Anti isomeric fatty acids,Ant)量。
1.4 PLFA相关指数计算
PLFA含量的标定和计算参照刘波等[15]方法,PLFA含量以每克干土中的含量(nmol·g-1)表示,按照以下公式计算:

式中,PPLFA和POSTD分别为样品脂肪酸和内标C19∶0的峰面积;S为内标c19∶0的浓度,μg·mL-1;V为加入内标c19∶0的体积,μL;MOSTD为内标c19∶0的相对分子量,g·mol-1;m为干土质量,g。
利用PLFA含量计算微生物多样性指数[16]。香浓-威纳(Shannon-Wiener)丰富度指数表征群落中的物种丰富度;辛普森(Simpson)优势度指数反映群落中最常见的物种。按下列公式计算:

Simpson 优势度指数:

式中,H′为丰富度指数,D为优势度指数,ni为第i种的个体数,N为所在群落的所有物种个体之和。
采用响应率分析造成不同氮水平处理下导致类群差异的特定PLFA。响应率计算参照Luo等[17]的方法,当响应值大于0时,微生物群落特定PLFA对氮沉降呈正响应;小于0,则呈负响应。
1.5 数据处理
采用SPSS19.0软件对数据进行统计分析,用单因素方差分析和图基(Tukey)多重比较法进行差异显著性检验,比较不同处理土壤微生物群落的差异(P<0.05),用重复测量方差(Repeated measures data ANOVA,SPSS)分析氮沉降处理与季节交互作用对土壤微生物群落影响和主成分得分值差异显著性,采用主成分分析(Principal component analysis,PCA)对土壤微生物群落结构进行分析,采用响应率计算分析造成不同氮水平处理下导致类群差异的特定PLFA。绘图由Origin 9.0和Canoco 5.0软件完成。数据为平均值±标准差。
2 结 果
2.1 氮沉降对土壤微生物群落PLFA的影响
氮沉降对不同季节土壤微生物PLFA的影响不同(图1)。土壤微生物以细菌为优势类群,占微生物总PLFA含量的78.3%。除放线菌外,LN显著增加夏季土壤微生物群落PLFA,而在其他季节土壤微生物群落总PLFA未产生显著影响(P>0.05);HN显著降低秋季和冬季土壤微生物群落总PLFA,但增加夏季土壤微生物群落总PLFA。其中,HN显著降低春季G-和冬季真菌PLFA(P<0.05)。

图1 氮沉降对土壤微生物群落结构的影响Fig. 1 Effects of nitrogen deposition on soil microbial community structure
2.2 氮沉降对土壤微生物群落PLFA特征值比值的影响
不同季节中,土壤微生物群落PLFA特征值比值对不同氮沉降处理的响应不同(图2)。氮沉降并未使F∶B和G+∶G-发生显著改变。LN增加全年Cy∶Pre和春冬季节Iso∶Ant,而HN显著增加夏季和秋季Iso∶Ant,对Cy∶Pre未产生显著影响。

图2 氮沉降对土壤微生物PLFA特征值比值的影响Fig. 2 Effects of nitrogen deposition on eigenvalue of soil microbial PLFA
2.3 氮沉降对土壤微生物群落多样性的影响
通过计算2个多样性指数,Shannon-Wiener物种丰富度指数(H′)和Simpson优势度指数(D-优势度),表示土壤微生物群落的多样性。结果表明,与对照相比,无论LN还是HN对不同季节土壤微生物群落多样性指数均未产生显著影响(表1)。

表1 氮沉降对不同季节细柄阿丁枫天然林土壤微生物群落多样性的影响Table 1 Effects of nitrogen deposition on soil microbial community diversity in Altinglia gracilipes natural forest in the different season
2.4 氮沉降和季节对土壤微生物群落结构的影响
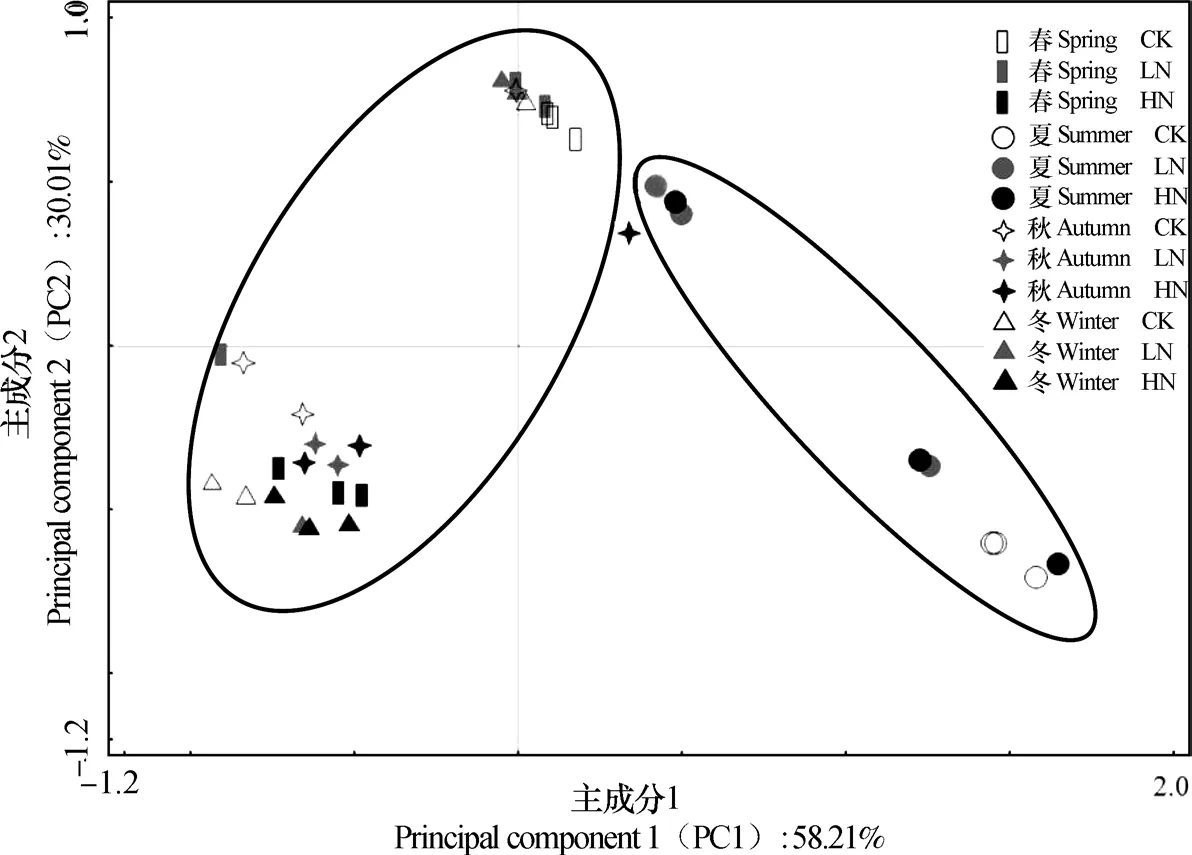
图3 氮沉降和季节对土壤微生物群落结构影响的主成分分析Fig. 3 Principal component analysis (PCA) of the effects of nitrogen deposition on soil microbial community structure relative to season
为进一步分析氮沉降和季节对土壤微生物群落结构的影响,对土壤PLFA进行主成分分析(图3),结果表明,主成分1(PC1)对PLFA变异的解释率达58.21%,主成分2(PC2)的解释率达到30.01%。LN仅显著改变夏季土壤微生物群落结构,而HN显著改变春季和冬季土壤微生物群落结构。夏季土壤微生物群落结构与其他季节发生显著差异。
土壤微生物群落主成分得分值存在显著差异(P<0.05)(表2),表明土壤微生物群落对季节和养分添加产生显著的变异。

表2 土壤微生物群落主成分得分值差异的显著性分析(F值)Table 2 Significance analysis of the difference between principal components of the soil microbial community in score value (F value)
土壤微生物总PLFA、细菌、G+、G-、真菌和放线菌特征性磷脂脂肪酸在季节和施氮处理及其交互作用存在极显著差异性(P<0.01)(表3),表明微生物PLFA的季节变化随施氮水平的不同而不同。

表3 季节变化和氮沉降及其相互作用对0~10 cm土壤微生物群落结构影响的显著性分析Table 3 Significance analysis of the effects of nitrogen deposition, season and their interactions on soil microbial community structure in the 0~10 cm soil layer
2.5 氮沉降对土壤微生物群落特定PLFA的影响
利用响应率曲线进一步分析造成土壤微生物群落差异的特定PLFA(图4),结果表明,LN处理下,夏季除i17∶0、a17∶0、18∶1ω7c和18∶1ω7t标记物外,细菌、G+、G-和真菌其余PLFA标记物丰度均显著增加。HN处理下,春季革兰氏阴性菌16∶1ω7c、16∶1ω7t、18∶1ω7t和cy17:0标记物丰度均显著下降,冬季真菌18∶1ω9和18∶2ω6,9c标记物丰度均显著下降。
3 讨 论
3.1 氮沉降量对土壤微生物群落结构的影响
氮素作为植物和微生物生长代谢必需的营养元素,适量输入可为植物生长和微生物的代谢提供营养。目前,大多数研究指出,氮源的输入会增加土壤微生物生物量,降低土壤微生物群落多样性[18]。本研究发现,短期适量的氮源输入(LN)未显著改变亚热带常绿阔叶天然林的土壤微生物多样性和群落结构。这一结果与氮沉降对亚热带杉木人工林土壤微生物群落结构的影响研究结果类似[18],其原因可能是该地区土壤中氮源相对充足,短期适量的氮添加对微生物多样性和群落结构影响较小。随着氮添加量的提高,过量的氮源输入(HN)导致土壤酸化,改变土壤营养物质的有效性,显著降低了土壤真菌或细菌类群含量(图1),使亚热带常绿阔叶天然林的微生物群落结构发生显著分异(图3)。Demoling等[19]在挪威森林试验中发现,氮沉降(100 kg·hm-2)加剧土壤碳限制,显著抑制细菌和真菌的生长速率,导致微生物量和活性分别下降40%和30%。Lu等[20]在我国南亚热带成熟林中发现森林生态系统对高氮输入非常敏感,持续两年的氮输入(50~150 kg·hm-2·a-1)显著加剧土壤酸化。Rousk等[21]研究发现土壤pH是影响微生物群落结构变化的主要因素,其变化对真菌及细菌的生长影响最大。Wang等[22]在氮富集的亚热带森林中发现细菌群落组成与土壤的pH成负相关,过量的氮添加(150 kg·hm-2·a-1)显著降低土壤的pH,导致细菌类群PLFA含量显著降低。同时,团队前期研究发现土壤酸化会导致交换性铝和有机络合铝含量增加,铝形态和含量变化可能会对某些敏感型的微生物类群产生一定的影响[18]。

图4 氮沉降处理下土壤微生物特定PLFA的变化(95%的置信区间)Fig. 4 Effects of nitrogen deposition on specific PLFA of soil microbes at a 95% confidence interval
不同微生物类群对环境变化的响应程度不同,其特征比值可反映微生物对环境变化的响应能力以及生态系统的稳定性。本研究中氮沉降未对F:B产生显著影响(图2),这与黄幸然等[23]对4种亚热带树种进行氮添加时发现不同水平氮添加并未显著改变真菌/细菌比的结果相一致。这表明,虽然氮沉降对亚热带地区天然林某些季节土壤微生物群落结构产生显著影响,但未显著改变其生态功能。此外,微生物类群生长代谢的改变会影响到特殊脂肪酸的积累来响应环境变化。Cy∶Pre反映土壤微生物所处的养分压力状态,其值越高表明土壤微生物对养分竞争越强。本研究发现LN显著提高Cy∶Pre,说明适量的氮添加可促进微生物对养分的竞争,这与Zechmeister-Boltenstern等[8]发现氮沉降会显著增大Cy∶Pre的结果相同。Nilsson等[24]在瑞典南部橡树进行氮沉降实验时发现,施氮会增加Cy含量,而降低Pre含量。但导致Cy∶Pre增大的原因尚不清楚,有学者认为可能是因为施氮引起的土壤高渗环境造成的胁迫,或施氮使凋落物产量和生化性质改变,导致异养微生物底物可获得性改变造成的[25-26]。Iso∶Ant反映微生物对环境胁迫的适应力,其值越高表示土壤微生物对环境胁迫的适应力越强。本研究发现,LN显著降低夏季Iso∶Ant,这说明微生物间对养分需求的竞争降低对环境变化的适应力,HN显著降低春冬季节土壤微生物Iso∶Ant,这表明高氮输入减弱春冬季节微生物群落对环境胁迫的适应力,该结果也表明微生物对环境变化的响应与植物生长、土壤温湿度和养分有效性等多种因素有关。
3.2 季节和氮沉降量交互作用对土壤微生物群落结构的影响
亚热带地区不同季节森林凋落物量、土壤温度和水分等生物和非生物因素存在明显的差异,会导致微生物群落发生季节变化,从而改变微生物群落结构对氮沉降的响应程度。Yan等[10]研究发现,氮沉降对不同季节土壤微生物类群的影响不同,且发现与土壤因子的变化密切相关。本研究发现,LN仅显著改变夏季土壤微生物群落结构,这是由除i17∶0、a17∶0、18∶1ω7c和18∶1ω7t标记物外的细菌、G+、G-和真菌其余PLFA标记物丰度显著增加所致。夏季植物林下植被生长旺盛,氮素可能较多地被林下植物吸收和降雨淋溶,氮素含量和有效性较低,从而限制土壤微生物的生长。适量的氮添加能增加土壤中氮的有效性,有利于加快微生物类群对易分解有机碳的摄取,从而促进微生物的生长代谢。袁颖红等[27]在亚热带杉木人工林模拟氮沉降时发现,土壤微生物群落对碳源的利用能力在LN最强。Allison等[7]在研究北方森林不同有机质分解时发现,适量的氮添加能最大水平促进真菌的生长和活性提高。HN使常绿阔叶天然林土壤微生物群落结构在春季和冬季发生显著分异,但不同季节土壤微生物变化类群不同,变化程度也不同。这与田艳琴等[28]发现HN(60 kg·hm-2·a-1)对不同季节柑橘林土壤微生物影响不同的研究结果相似。春季革兰氏阴性菌16∶1ω7c、16∶1ω7t、18∶1ω7t和cy17∶0标记物丰度均显著下降,这可能与G-对高氮添加适应力较弱有关。大多数G-分布于根系周围,主要利用根际沉积物和有效氮进行快速的生长和周转[29]。春季林木处于短暂而集中的换叶期,导致地面凋落物增多,同时新叶将光合作用产物大量输送至地下增加细根生物量,但添加的氮超过土壤氮饱和状态时,会减缓凋落物的分解和降低根系生物量,导致土壤中易分解的有机碳来源减少,使G-对环境胁迫的适应性降低。周世兴等[30]在模拟氮沉降对凋落物分解影响时发现,氮沉降显著抑制凋落物分解,HN处理凋落物质量残留率较CK高8.81%。冬季真菌18∶1ω9和18∶2ω6,9c标记物丰度均显著下降,与Demoling等[19]在挪威森林试验中发现氮沉降能降低真菌18∶2ω6,9c标记物丰度的结果相似。大多数真菌属于贫营养型,对氮源的需求并不高,在外加氮沉降条件下,其竞争力低于富营养型的细菌,抑制真菌的活性和生长。同时,冬季土壤温度和含水量均较低,土壤中可利用易变化碳源大量减少,难分解有机碳含量增加,养分流动性降低。土壤微生物为维持正常生长代谢,类群间增大对养分的竞争,从而在有限养分中摄取足够的营养物质,这与冬季土壤微生物Cy∶Pre比值增大相一致。因此,在考察氮沉降对土壤微生物的影响及机制时,结合植物生长、土壤环境因子和季节等因素,有助于全面评价氮沉降对森林生态系统养分循环的作用机制。
4 结 论
通过模拟不同水平氮沉降,发现夏季土壤微生物群落结构与其他季节发生显著差异,氮沉降在50 kg·hm-2·a-1水平下仅显著改变了亚热带常绿阔叶天然林夏季土壤微生物群落结构,在100 kg·hm-2·a-1水平下显著改变了春季和冬季土壤微生物群落结构,但不同季节土壤微生物变化类群不同,变化程度也不同,即氮沉降对土壤微生物的影响表现出一定的季节差异性。因此,在考察氮沉降对亚热带地区森林生态系统土壤微生物群落结构的影响时有必要结合季节因素开展。此外,氮沉降未显著改变土壤微生物群落的多样性、F∶B和G+∶G-,而使不同结构的环丙烷脂肪酸或异构脂肪酸等特殊脂肪酸比值发生改变,表明亚热带常绿阔叶天然林土壤微生物对短期氮沉降具有一定的抵抗能力。
