小麦 HD2基因家族的全基因组鉴定及热胁迫下的表达模式分析
2018-12-13李梓彰郑文杰闻珊珊
李梓彰,丁 宁,田 文,郑文杰,张 珊,闻珊珊
(西北农林科技大学农学院,陕西杨凌 712100)
真核生物的遗传信息主要储存在染色质内,而染色质的基本组成单位是核小体。核小体由核心组蛋白组成的八聚体和缠绕其上的一段约147 bp的双链DNA组成[1],其中核心组蛋白对于调控核小体和染色质结构具有重要意义。组蛋白乙酰化修饰是核心组蛋白上的一种重要的修饰作用,它可以使核小体构象发生有利于转录调节蛋白和染色质相结合的改变,从而提高基因转录活性[2]。组蛋白的乙酰化是可逆的,由组蛋白乙酰转移酶(histone acetyltransferases,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)共同调节[3-4]。HDAC负责去除组蛋白上的乙酰基团,使染色质结构变得紧密,抑制基因的表达。HDAC广泛存在于动植物和真菌中,主要分为三个家族,分别是Rpd3家族、Sir2家族和HD2家族[5-7]。
HD2家族是植物特有的组蛋白去乙酰化酶家族[8],在序列上与其他HDAC家族完全不同。其蛋白质序列在N端通常包含一段保守的氨基酸序列(MEFWG),被称为 HD2基因标签( HD2s label),是HD2家族最明显的特征[9]。此外,HD2家族内部成员之间,最大的不同是其C端是否含有锌指结构,根据这一特征可将其分为Group1和Group2[8]。
HD2基因首次从玉米中被鉴定和克隆出来[10-11],研究表明, HD2基因参与核糖体染色质结构调节和功能调控[12]。随后,在模式植物拟南芥中鉴定到4个HD2家族成员,分别为 HD2A、 HD2B、 HD2C及 HD2D[5,13-14]。对其进一步研究表明,4个基因中, HD2A、 HD2B和 HD2C在植物受精、种子发育和叶发育过程中具有重要作用[15]。如 HD2A基因的缺失会影响种子和叶的发育,导致种子畸形,果实干瘪[16]; HD2B基因可被低温和种子休眠诱导表达[17]; HD2D则在拟南芥根部发育中具有重要作用。 HD2基因不仅参与植物生长发育过程,且在植物多种非生物胁迫响应中发挥重要作用。在拟南芥中的研究表明,过表达 HD2D会提高植物对干旱胁迫、盐胁迫和ABA胁迫的抵抗能力[18]。同时,HD2家族去乙酰化酶还可以与其他去乙酰化酶相互作用,共同调控植物对胁迫的响应。如,HD2C可以与HDA6和RPD3家族去乙酰化酶共同作用于组蛋白H3上,从而参与调节植物ABA和盐胁迫的响应[19-20]。 HD2C也可以与染色质重组复合物相互作用,调节植物热胁迫响应[21]。
近年来,气候变化对小麦的产量产生了重大影响,各种不利于小麦的环境因素威胁着小麦的生长[22]。目前,关于 HD2基因的研究已在拟南芥和玉米等植物中报道,但关于小麦 HD2基因还鲜有研究。本研究利用生物信息学方法对小麦 HD2基因进行全基因组鉴定、互作网络和不同组织及逆境胁迫下的表达模式等进行系统分析;并选用科农199(Kenong 199)半冬性小麦品种,利用qRT-PCR方法研究 HD2基因在小麦生长发育的不同时期叶片组织响应热胁迫的表达模式,为进一步研究小麦 HD2基因的功能机制和改良小麦性状提供参考。
1 材料与方法
用田 文等[23]在“普通小麦DREB基因家族的全基因组鉴定及热胁迫下的表达模式分析”一文中所采用的方法对 HD2基因做如下研究:(1)基因家族成员的全基因组鉴定;(2)序列多重比对和进化树构建;(3)基因结构和蛋白质保守结构域分析;(4)染色体定位、顺式作用元件及互作网络分析;(5)不同组织和不同逆境下的表达模式分析;(6)小麦品种科农199植株的干旱和热胁迫处理,以及处理植株RNA提取、cDNA合成和qRT-PCR分析。qRT-PCR分析中所用的特异性引物见表1。
2 结果与分析
2.1 小麦 HD2基因家族成员鉴定
利用HMMER建模搜索和BLASTP比对搜索两种方法,从小麦基因组中共鉴定出39个 HD2候选基因,进一步去除冗余、根据保守结构域和基因结构验证筛选,最终得到12个小麦 HD2基因,根据其蛋白质C端是否含有锌指结构和在染色体上的位置,将其命名。所有的小麦HD2蛋白的N端均含有保守的MEFWG或MSSFWG序列,这是已报道的 HD2基因标签(gene label)。在鉴定到的12个小麦 HD2基因中,有7个基因的编码蛋白序列的C端含有锌指结构,它们属于Group1;有5个基因的编码蛋白序列的C端没有锌指结构,属于Group2。小麦 HD2基因编码蛋白的序列长度为312~472个氨基酸,分子量为3.37~5.17 kDa,理论等电点为4.60~8.78。亚细胞定位预测结果表明,所有的小麦HD2蛋白都定位于细胞核中。

表1 小麦 HD2基因qRT-PCR引物Table 1 Primers for qRT-PCR analysis of wheat HD2 genes
2.2 小麦 HD2基因系统进化、保守结构域和基因结构分析
为了分析小麦 HD2基因编码蛋白的结构和进化关系,利用ClustalX软件将小麦HD2蛋白和拟南芥、玉米、大麦和水稻中的HD2蛋白质序列作多重比对(图1A)。所有的小麦HD2蛋白质序列与其他物种蛋白质序列有34.29%的相似度,它们均在N端含有已报道的 HD2基因标签(MEFWG或MSSFWG)和两个保守的氨基酸残基,分别是位于25位的组氨酸残基和位于72位的天冬氨酸残基。其中TaHD2-G1-1B,TaHD2-G1-1A和TaHD2-G1-1D与HvHDAC2-1亲缘关系更近,其蛋白质序列相似度达到53.99%;TaHD2-G1-3A,TaHD2-G1-3B1和TaHD2-G1-3D1与HvHDAC2-2亲缘关系更近;TaHD2-G1-3B1,TaHD2-G1-3D和TaHD2-G1-3A与ZmHDA106亲缘关系更近,其蛋白质序列相似度达到41.70%;而TaHD2-G2-2A,TaHD2-G2-5A,TaHD2-G2-5B和TaHD2-G2-5D则与AtHD2d亲缘关系更近,蛋白质序列相似度达到50.86%。以上结果表明,小麦中的Group1类型 HD2基因与同是禾本科的玉米和大麦比较相似,而Group2类型 HD2基因则与拟南芥中同属于Group2类型 HD2基因的 AtHD2d相似。
用MEME对小麦HD2和其他植物的HD2蛋白序列的保守结构域进行分析。结果(图1B)表明,所有鉴定到的小麦HD2和其他植物HD2均含有motif 2,这是HD2的gene label;TaHD2-G2-2A和AtHD2d结构非常相似,只含有motif 2、motif 4和motif 8这三个motif;并且,TaHD2-G2-2A与同为Group2类型的HD2其他成员的结构不同,说明其可能在功能上与Group2类型的HD2其他成员存在差异。
根据Ensembl Plants上的小麦 HD2基因注释信息,研究其内含子-外显子分布。结果表明,在同一染色体组的小麦 HD2基因中,其外显子-内含子结构非常相似,而在不同染色体组中则有差异。如:位于5号染色体上的 TaHD2基因,其外显子-内含子分布非常相似,他们都含有9个内含子,且其长度和分布非常相似。同样的情况发生在1号染色体组和3号染色体组的 TaHD2-G1-3A、 TaHD2-G1-3B1和 TaHD2-G1-3D1上。 TaHD2-G2-2A与其他 TaHD2基因的结构都不相同; TaHD2-G1-3B2和 TaHD2-G2-3D2位于进化树上的同一分支,且它们的外显子-内含子结构非常相似,但它们并不属于同一种类型的 HD2基因。以上结果表明,小麦 HD2基因在同一染色体组和属于同一类型 HD2时,其染色体结构非常相似。

Ta:Triticum aestivum;Zm:Zea mays;Hv:Hordeum vulgare;Os:Oryza sativa;At:Arabidopsis thaliana 图1 小麦、拟南芥、玉米、水稻和大麦HD2蛋白系统发生树(A)及蛋白质保守结构域(B)分析Fig.1 Phylogenetic and protein conserved domain analysis of HD2 in wheat,Arabidopsis,maize,rice,and barley
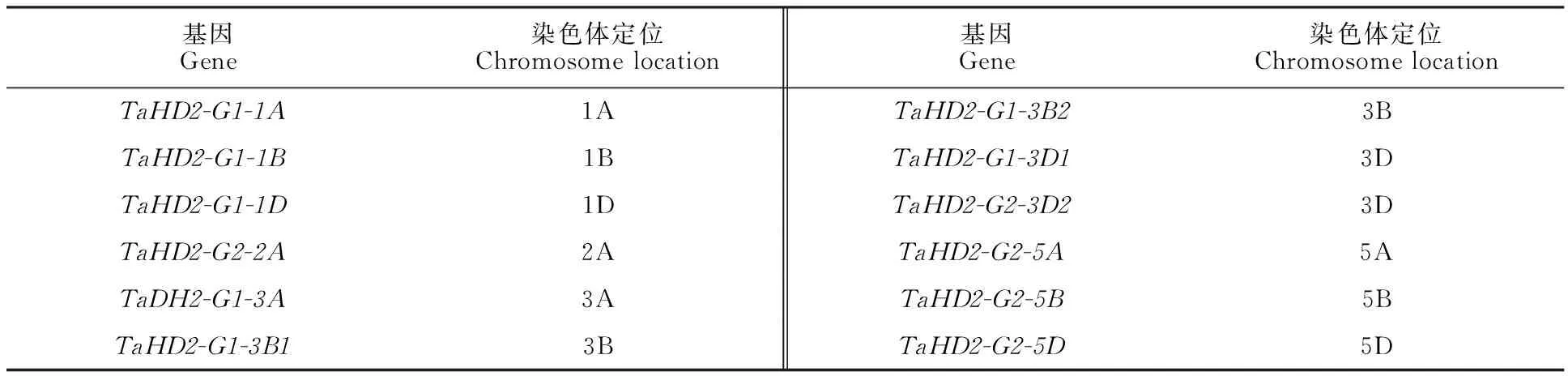
表2 小麦 HD2基因在染色体上的定位Table 2 Chromosome location of HD2 genes in wheat
2.3 小麦 HD2基因染色体定位、顺式作用元件及互作调控网络分析
根据基因组的注释信息,进行小麦 TaHD2基因的染色体定位;结果(表2)表明,所有鉴定到的12个小麦 HD2基因分布于小麦4个不同的染色体上,且这些基因在染色体上的分布并不均匀。1号染色体组和5号染色体组上A、B和D染色体均有一个基因;3号染色体组上含有5个基因;2号染色体组上只有一个基因。这表明,在小麦基因组中,位于3号染色体组上的 HD2基因可能发生了复制,产生多个拷贝,而位于2号染色体组上的 HD2基因可能发生缺失。
根据小麦与拟南芥中 HD2的同源基因,参考拟南芥基因互作网络研究小麦 HD2基因与其他基因的互作调控网络。结果(图2)发现,只有一个小麦 HD2基因与其他小麦基因存在互作关系,形成121个分支。这些互作基因主要参与DNA和RNA的修饰,表明小麦 HD2基因主要通过DNA修饰或RNA修饰来调控基因的表达。
为进一步研究小麦 HD2基因可能的生物学功能和参与的调控网络,选取所有鉴定到的小麦 HD2基因上游1.5 kb区域,用于顺式作用元件的鉴定。结果表明,小麦 HD2基因上游序列中存在78个与胁迫及激素相关的顺式作用元件,其中数量最多的是光响应元件,表明小麦 HD2基因可能参与光合作用过程。所有的小麦 HD2基因上游区域均含有Skn-1模体,该元件在胚乳相关基因表达中起重要作用,表明小麦 HD2基因可能参与调控胚乳的生长发育。另外,小麦 HD2基因的顺式作用元件中还包含了多种非生物胁迫响应相关的调控元件,包括干旱胁迫响应元件MBS、热胁迫响应元件HSE、低温胁迫响应元件LTR和脱落酸胁迫响应元件motif IIb等,表明小麦 HD2基因可能参与调控多种非生物胁迫响应过程。
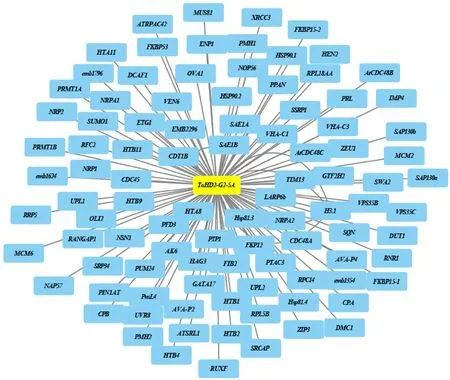
图2 基于拟南芥同源基因构建的 HD2基因互作网络Fig.2 Interaction network of HD2 genes in wheat according to the orthologs in Arabidopsis
2.4 小麦 HD2基因在不同组织中和不同逆境胁迫下的表达模式分析
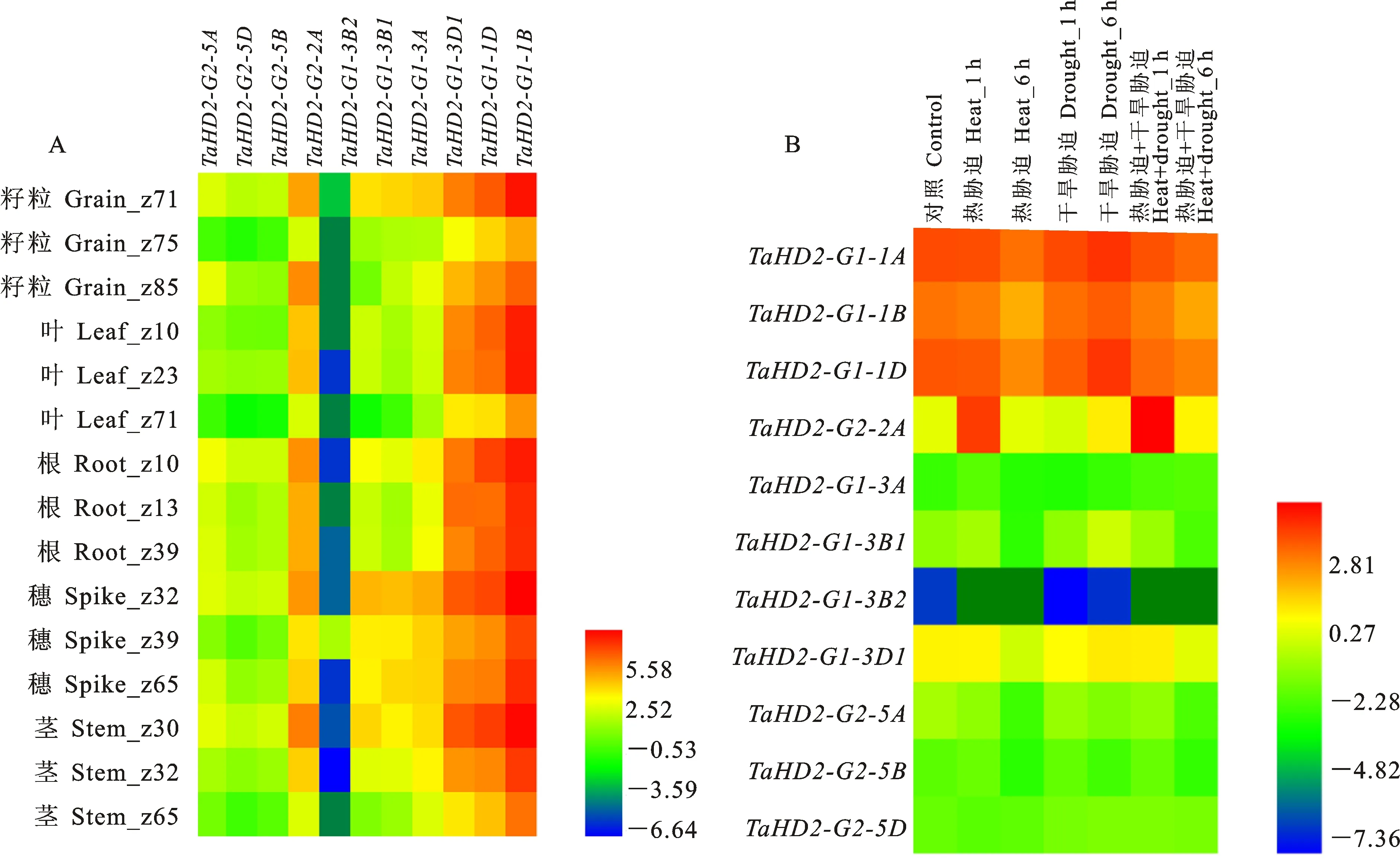
为了解小麦 HD2基因在不同组织中的表达模式,本研究从WheatExp获取小麦 HD2基因在根、茎、叶、穗和种子中的表达量,然后利用Heml软件将结果可视化(图3A)。结果表明,除 TaHD2-G1-3B2外, TaHD2基因在所有组织中都有表达,且同一基因在不同组织、不同基因在同一组织下均存在显著差异(P<0.05)。 TaHD2-G1-1A、 TaHD2-G1-1B和 TaHD2-G1-1D在除grain z85和root z10外的所有组织中的表达量均比其他 TaHD2基因高,且其表达模式相似,表明这三个基因在小麦整个生长发育过程中都较为重要。而 TaHD2-G1-3B2在所有组织中的表达量均非常低,在种子中甚至无表达,表明该基因可能不参与种子的生长发育过程,这与拟南芥中 AtHD2d基因的表达模式相似,两者可能具有相似的生物学功能。从整体上看,定位于同一染色体组上的小麦 HD2基因具有相似的表达模式。而对于 TaHD2-G1-3B2基因,其表达模式与其他位于3号染色体组上的小麦 HD2基因差异较大,表明其可能在小麦进化过程中,由于染色体加倍或复制等原因,功能丢失或产生了新的功能。
为了解小麦 HD2基因在非生物胁迫下的表达模式,本研究对从SRA数据库下载的RNA-seq数据进行处理,得到小麦在干旱胁迫、热胁迫和旱热共胁迫分别处理1和6 h的表达量,并使用Heml软件将结果可视化(图3B)。结果表明,随干旱胁迫时间的延长, TaHD2-G1-1A、 TaHD2-G1-1D和 TaHD2-G1-3B1的表达量呈上升趋势; TaHD2-G2-2A在热胁迫1 h和旱热共胁迫1 h的表达量比对照高10倍以上。其他基因的表达量无显著变化。由此推测,这4个基因可能在小麦响应热胁迫和干旱胁迫的过程中发挥重要作用。
z10:第一片叶抽出胚芽鞘时期;Z13:3叶期;z23:3个分蘖时期;z30:穗长为1 cm时期;z32:2个节时期;z39:减数分裂时期;z65:开花期;z71:开花后2天;z75:开花后14天;z85:开花后30天。
z10:First leaf through coleoptile; Z13:Three leaves stage; z23:Three tillers stage; z30:Spike of 1 cm stage; z32:Two nodesstage;z39:Meiosis; z65:Anthesis; z71:2 days after anthesis; z75:14 days after anthesis;z85:30 days after anthesis.
图3小麦HD2基因在不同组织中(A)和不同逆境下(B)的表达模式
Fig.3ExpressionprofilesofHD2genesindifferenttissuesandunderdifferentstresses
2.5 小麦 HD2基因在不同生长发育时期热胁迫下叶片中的表达模式
为研究 HD2基因在小麦不同生长发育时期的叶片响应热胁迫的表达模式,选取出芽3天、出芽7天、分蘖、春化、起身、拔节、挑旗、抽穗、开花、灌浆早期、灌浆晚期和成熟期共12个时期的小麦(品种为农科199)叶片,分别在35 ℃和42 ℃下进行短期(1 h)热胁迫处理,分析其表达量。从转录组数据分析和网络数据库中得到的表达量可以看出, TaHD2-G1-3B2和 TaHD2-G2-3D2在叶片中的表达量很低,几乎为零,所以选取除这两个基因以外的10个 TaHD2基因,设计引物进行qRT-PCR。结果(图4)表明,多数基因在挑旗期和抽穗期热胁迫下表达量明显上升,且 TaHD2-G1-1A基因上升得最明显,表明多数 TaHD2基因可能在小麦生长发育的挑旗期和抽穗期对热胁迫响应具有重要作用。而少数基因,如 TaHD2-G2-5B仅在起身和挑旗期表达量明显上升,其他时期热胁迫下表达量均下降,说明个别基因可能在别的时期热胁迫下发挥重要作用。同时,与RNA-seq数据分析结果比较发现,部分基因,如 TaHD2-G1-3D1,在RNA-seq数据中热胁迫下表达量下调,而在qRT-PCR结果中则在某些时期显著上调,这是因为RNA-seq数据检测的是小麦幼苗时期热胁迫下表达量,与qRT-PCR结果相比,小麦生长发育早期热胁迫下该基因表达也为下调,随着小麦生长发育的进行,该基因在热胁迫下逐渐呈现出不同的表达模式,说明小麦 HD2基因对热胁迫的响应在不同时期具有不同的表现。
3 讨 论
本研究是利用生物信息学方法第一次系统研究小麦中的 HD2基因,共鉴定到12个 HD2基因,相比于目前拟南芥(4个)、水稻(2个)、玉米(4个)和大麦(2个)中 HD2基因个数较多,这可能与其基因组较为庞大有关[24],依据其蛋白肽链C端是否具有锌指结构将其分为两组[8]。蛋白质结构研究表明,这12个基因均具有 HD2基因的典型结构。进化分析结果表明,小麦中的Group 1类型 HD2基因与同是禾本科的玉米和大麦比较相似,而Group 2类型 HD2基因则与拟南芥中同属于Group 2类型 HD2基因的 AtHD2d相似。说明小麦中Group 1和Group 2类型的 HD2基因其进化方面可能有较大区别。共表达网络分析结果表明,小麦 HD2基因可能参与了小麦中DNA和RNA修饰过程。通过研究这些基因的顺式作用元件,发现其上游包含多种胁迫响应相关的元件,表明小麦 HD2基因可能在小麦多种胁迫响应中具有重要作用。在拟南芥中的研究表明, HD2基因可以与染色质重构复合物或其他基因互作,参与逆境胁迫响应过程[19-21]。结合共表达网络分析结果,推测在逆境胁迫中,小麦 HD2基因也可能通过与其他基因互作,参与小麦DNA或RNA修饰,进而参与逆境胁迫响应过程。本研究利用RNA-seq数据,研究了小麦 HD2基因在不同组织下的表达模式,发现位于同一染色体组上的小麦 HD2基因具有相似的表达模式,特别的 TaHD2-G1-3B2表达模式与其他位于3号染色体组上的基因不同,可能的原因是在进化过程中,其功能丢失或产生了新的功能。

X轴上的1~12依次代表小麦出芽3天、出芽7天、分蘖期、春化期、起身期、拔节期、挑旗期、抽穗期、开花期、灌浆早期、灌浆晚期和成熟期。
1-12 on the X-axis represent the 12 growth periods of wheat including 3 days and 7 days after germination, tillering, vernalization, booting, jointing, flagging, heading, flowering, early grain filling, late filling and maturing stages of wheat,respectively.
图4HD2基因在小麦品种科农199不同生长发育时期的相对表达水平
Fig.4RelativeexpressionlevelsofTaHD2genesin12growthperiodsofwheat
研究表明, HD2基因在植物未成熟和成熟期对逆境胁迫的响应具有不同的表现,但是关于植物不同时期的具体不同表现目前尚不清楚[21]。热胁迫是导致小麦产量和质量下降的重要因素,本研究结果表明,小麦 HD2基因在挑旗期和抽穗期热胁迫下表达量上升明显,其可能在这两个时期对小麦热胁迫响应具有重要作用。对于个别基因,如 TaHD2-G1-3A,除了在挑旗期和抽穗期外,其在拔节期、灌浆早期和成熟期热胁迫下表达量也明显上升,表明该基因可能在这三个时期的热胁迫响应也有重要作用。
