大腹园蛛黏液蛋白ASG2 C端功能模块的克隆表达及圆二色谱分析
2018-12-12张露温睿李雪孟清林瑛
张露, 温睿, 李雪, 孟清, 林瑛
(1. 东华大学 生物科学与技术研究所; 2. 东华大学 环境科学与工程学院, 上海 201620)
蜘蛛可产生6种蛛丝和一种黏合物,包括主壶腹腺丝(MaSp)、次壶腹腺丝(MiSp)、鞭状腺丝(FlSp)、葡萄状腺丝(AcSp)、管状腺丝(TuSp)、梨状腺丝(PySp),不同的蛛丝分别具有不同生理功能和材料学性能,在蜘蛛的生命历程中扮演着不同的角色[1-8]。如主壶腹腺丝、鞭状腺丝等,因其优异的强度或弹性等材料学性能在生物材料领域具有极大的潜在应用价值,引起研究者的研究热潮[9-13]。黏合物(ASG)是由聚状腺体(aggregate silk gland)分泌,由ASG1和ASG2两种蛋白组成[14-16]。黏合物能够形成胶滴,以一定距离附着于鞭状腺丝的表面,构成具有极佳黏性的捕获丝,能够黏附猎物,防止其逃脱,对于蜘蛛捕获猎物具有重要作用[15]。不同于上述几种蛛丝,黏合物在天然状态下不是以丝纤维的形态存在,因此对其的结构功能研究和仿生应用研究较少。
但是现有研究者对黏合物的组分进行了探索研究[15],证明其组份ASG1属于节肢动物基因家族,编码围食基质蛋白;而其一个组份ASG2,其基因结构和序列特征却与蛛丝蛋白的基因相似,属于蛛丝蛋白家族,因此ASG2成丝也称为聚状腺蛛丝蛋白(aggregate spidroin 1: AgSp1)。同时也有研究者对AGS2进行了外源重组表达,发现AGS2在剪切力的作用下能够形成丝纤维,也可通过湿纺的方式成丝[14];并且黏合物有其独特的材料学性能,例如一种圆网蜘蛛角类肥蛛(Larinioidescornutus)的一个单一胶滴可以承受400 μN的拉伸力,其可延展至800 μm3[17],所以ASG2也具有作为生物材料的潜在应用价值,并且可能提供一种新型生物材料。因此,对AGS2蛋白的结构功能研究和仿生应用等方面的探索具有重要意义。
由已报道的络新妇蛛(Nephilaclavipes)的ASG2蛋白的cDNA可知[15-16],ASG2蛋白同样可分为N端非重复区(NT)、C端非重复区(CT)和中间重复模块(RP),这与其他6种蛛丝蛋白的氨基酸序列特征相似[1, 3, 18]。随着蛛丝蛋白研究的不断深入,蛛丝蛋白各个模块的结构和功能逐渐明了,对于蛛丝的仿生具有重要的指导意义。研究表明,NT主要作用于蛛丝蛋白的高浓度储存过程[19-20],RP是蛛丝蛋白成丝的负责模块[21-22],而CT则是在蛛丝蛋白的成丝过程中具有重要作用[23-25]。目前,仅报道了MiSp、MaSp、AcSp的CT高级结构,对其功能也进行了阐述[23-26]。研究表明,蛛丝蛋白CT的高级结构虽具有一定的保守性,但是仍然存在一定的差异,也导致了不同蛛丝蛋白的CT的功能不同。而对ASG2 CT的结构功能的相关研究更是少数,因此ASG2 CT编码基因材料的获取、结构功能的研究是非常必要的,这是后续ASG2蛋白仿生应用的理论基础。
因此,为了丰富ASG2 CT的编码基因材料,我们利用锚定PCR方法,在本研究中首次获取了大腹园蛛(Araneusventricosus) ASG2的C端非重复区编码基因AvAGS2CT,并在大肠杆菌中对其进行了重组表达;进一步利用圆二色谱(CD),对AvAGS2CT蛋白的二级结构进行了初步探索分析,这为后续的ASG2 CT高级结构解析和功能研究奠定了基础,例如为探索ASG2 CT在ASG2成丝过程中的作用等提供一定的理论支持。
1 材料与方法
1.1 材料
质粒抽提试剂盒、胶回收试剂盒、PCR产物回收试剂盒等购于生工生物工程股份有限公司(上海,中国);PCR相关试剂购于NEB公司(美国);T4连接酶、限制性内切酶购于天根生化科技有限公司(北京,中国);Thermo Fisher Scientific公司(美国);表达宿主E.coli(DH5α和BL21)购于天根生化科技有限公司(北京,中国);蛋白纯化相关试剂购于Qiagen公司(德国);Western-blot相关试剂购于Invitrogen 公司(美国);引物合成和基因测序反应在上海睿迪生物有限公司进行(上海,中国)。
1.2 克隆构建
1.2.1 目的基因的获取
根据NCBI (https://www.ncbi.nlm.nih.gov/)中一段EST序列(expressed sequence tag sequences) (GenBank: AT006577.1)设计两条同向特异性外侧引物Av glue F1和内侧引物Av glue F2,同时设计接头引物AL和AS(序列见表1)。具体锚定PCR步骤:提取大腹园蛛基因组DNA为模板,加入外侧特异性引物Av glue F1进行单引物扩增,PCR条件如下:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸1 min,72℃再延伸10 min,35个循环;随后对回收的PCR产物进行加尾,利用TdT末端加尾酶进行在PCR产物的3′端加C,反应条件如下:PCR回收产物19 μL,TdT末端加尾酶buffer 9 μL,dCTP 1 μL,TdT末端加尾酶1μL,置于37℃,反应15 min;回收加尾产物,并以此为模板,加入外侧特异性引物Av glue F1和接头引物AL进行常规PCR,PCR条件如下:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸1 min,72℃再延伸10 min,35个循环。取1 μL上述PCR产物作为模板,加入内侧特异性引物Av glue F2和接头引物AS进行常规PCR,PCR条件如下:95℃预变性5 min;95℃变性30 s,56℃退火30 s,72℃延伸1 min,72℃再延伸10 min,35个循环;进行第二次常规PCR;随后对该PCR产物进行琼脂糖凝胶电泳并切胶回收,送上海睿迪生物有限公司进行测序。将上述测序结果与NCBI中已知ASG2序列进行拼接,得到大腹园蛛ASG2 CT的完整编码序列AvASG2CT序列。

表1 引物序列
注:下划线所示为限制性酶切位点
1.2.2 重组质粒的克隆构建
根据上述获得的目标序列设计引物Glue2CT-P1和Glue2CT-P2,以基因组DNA为模板进行PCR,PCR条件如下:95℃预变性5 min;95℃变性30 s,53℃退火30 s,72℃延伸30 s,72℃再延伸10 min,35个循环。对PCR产物进行回收,并进行BamH I和XhoI双酶切;同时对修饰过的pet-32表达质粒载体pet-M (含有6His-tag和凝血酶位点)进行BamH I和XhoI双酶切;利用T4连接酶连接目标插入片段与质粒表达载体得到重组表达质粒pet-M-AvAGS2CT;转化大肠杆菌克隆菌株DH5α,进行平板过夜培养;挑取单克隆进行液体培养,抽取质粒后,再进行双酶切鉴定和PCR鉴定,最后将阳性克隆送往上海睿迪生物有限公司进行测序。
1.3 序列分析
利用ClustalW2对AvASG2CT序列与已知的同源序列进行比对分析,已知的同源序列从NCBI网站(https://www.ncbi.nlm.nih.gov/)获得,其GenBank号等详细信息见表2;利用psipred网站(http://bioinf.cs.ucl.ac.uk/psipred/)对AvASG2CT进行蛋白质二级结构预测;利用Geneious7软件进行进化树(phylogenetic tree)分析。

表2 已报道的AGS2 CT序列
1.4 目标蛋白表达纯化
将重组表达质粒pet-M-AvAGS2CT,转化大肠杆菌表达菌株BL21(DE3),进行平板过夜培养;挑取单克隆,接种于10 mL LB中,37℃、200 r/min进行过夜培养;随后转接于1 L LB中进行扩大培养,37℃、200 r/min,培养至OD600约0.6~0.8,加入终浓度0.3 mmol/L的IPTG,20℃、200 r/min,进行过夜诱导表达;上述所用到的液体LB培养基中均含有终浓度100 μg/mL的Amp (氨苄青霉素)。
4000 r/min、20 min离心收集过夜诱导的菌体,加入50 mL lysis buffer (20 mmol/L Tris,pH 8.0)进行重悬;随后利用高压破碎仪JN-3000 plus (广州,中国)进行菌体破碎,1200 bar;后10 000 r/min、40 min离心收集上清;根据Qiagen镍柱使用说明进行目标蛋白纯化,将上清与Ni-NTA柱子结合,利用wash buffer (20 mmol/L Tris,20 mmol/L 咪唑,pH 8.0),对柱子进行冲洗,利用elute buffer (20 mmol/L Tris,250 mmol/L 咪唑,pH 8.0)对目标蛋白进行洗脱;随后在收集的目标蛋白中加入凝血酶,以切除目标蛋白上的6His-tag,同时透析于2 L 10 mmol/L PB buffer (pH 7.0)中,每2 h换一次buffer,重复3次,以透析去除咪唑。
1.5 目标蛋白检测
利用15%的SDS-PAGE检测目标蛋白的表达纯化情况;利用6His-tag的特异性抗体对目标蛋白进行Western-blot免疫印迹,以对目标蛋白进行定性;Western-blot操作步骤按照标准操作步骤进行,一抗(6His-tag的特异性抗体)以1∶5000加入;特异性的二抗以1∶5000加入;加入Invitrogen的ECL底物进行显色反应;后进入暗室压片。
1.6 圆二色谱测试
对目标蛋白AvAGS2CT进行了圆二色谱(CD)测试,将透析后的目标蛋白以0.5 mg/mL的终浓度利用 (Jasco J-810 spectropolarimeter)进行CD测试,条件如下:25℃,扫描波长190~260 nm,0.1 mm比色皿,wavelength step 1 nm,扫3次平均,得到CD图谱。
2 结果与分析
2.1 目标基因AvASG2CT的获取
为获取大腹园蛛(Araneusventricosus)黏合蛋白(聚合腺丝)ASG2的CT的编码基因,利用其同源序列十字园蛛(Araneusdiadematus)的AGS2部分编码序列(GenBank No KU132350.1)在NCBI中进行序列搜索,找到一段EST序列(GenBank No.AT006577.1),该EST序列属于大腹园蛛的cDNA文库;通过序列比对分析,两个序列的同源性可达89%,因此推测该段EST序列为大腹园蛛ASG2的部分编码基因。所以,根据该段EST序列设计特异性引物,进行单引物扩增,利用接头引物,进行两轮常规PCR扩增。由图1-A可见,目标条带被特异性扩增。但是由于模板是将单引物扩增产物,利用TdT末端加dCTP后所得到的,所以PCR扩增得到的条带大小不一;因此,将图1-A中较亮的条带约900 bp胶回收后,进行测序反应。

A:单引物扩增后的第二轮PCR结果图,M: DNA ladder;lane 1~6:第二轮PCR结果。B:以基因组为模板PCR扩增AvASG2CT序列结果图,M: DNA ladder;lane 1-3:PCR平行样;lane 4:阴性对照
图1AvASG2CT基因序列获取PCR结果图
Fig 1 The PCR results of theAvASG2CTgene obtaining

黑色框所示为AvASG2CT的终止密码子;红色框所示为AATAAA保守元件
图2单引物扩增获得的AvASG2CT下游编码序列
Fig 2 The downstream sequence of theAvASG2CT
from the single primer PCR
图2展示了上述测序结果,分析序列可知,在开放阅读框的后方发现了终止密码子(图2中黑色方框所示),且在其下游序列发现了AATAAA保守元件(图2中红色方框所示),其为转录成mRNA ployA的保守性元件[27]。因此,可以初步确定获得了大腹园蛛ASG2 CT的下游完整编码序列。
将测序结果与NCBI中已知的序列(GenBank No.AT006577.1)进行拼接后,得到完整的AvASG2CT编码序列,其氨基酸序列如图3中三角所示。随后,根据该编码序列设计特异性引物Glue2CT-P1和Glue2CT-P2,以基因组为模板,进行PCR扩增,对该序列进行回归验证,如图1(B)所示,得到了特异性的目标条带,条带大小与理论值398 bp相符;将该PCR产物克隆到质粒载体pet-M中得到pet-M-AvAGS2CT,挑取阳性重组子进行测序,将得到的序列与上述单引物扩增得到序列进行比对分析可知,两次得到的序列完全一致,因此可确定成功获取了大腹园蛛AvASG2CT的完整编码序列。

圆柱示为 5 个 α-helix (H1-H5);AvASG2CT序列为三角形所示
图3不同蜘蛛种属的ASG2 CT序列比对分析
Fig 3 The sequence align of the CT of ASG2 from different spider species
将获得的AvASG2CT序列与现今已报道的AGS2 CT序列进行比对分析可知, 不同种属的蜘蛛的ASG2 CT,在初级结构上具有较高的保守性,同源性可达55%。其中,本次获得的AvASG2CT序列与十字园蛛(Araneusdiadematus)ASG2 CT(图3中序列A.d.ASG2)的序列保守性可达92%,与黑寡妇蜘蛛(Latrodectushesperus) ASG2 CT(图3中序列L.h.ASG2)的序列保守性可达44.8%,与络新妇蛛(Nephilaclavipes) ASG2 CT(图3中序列N.c.ASG2)的序列保守性可达63.2%,与格罗萨肥腹蛛(Steatodagrossa) ASG2 CT(图3中序列S.g.ASG2)的序列保守性可达41.6%。
AvASG2CT蛋白序列由三角形所示
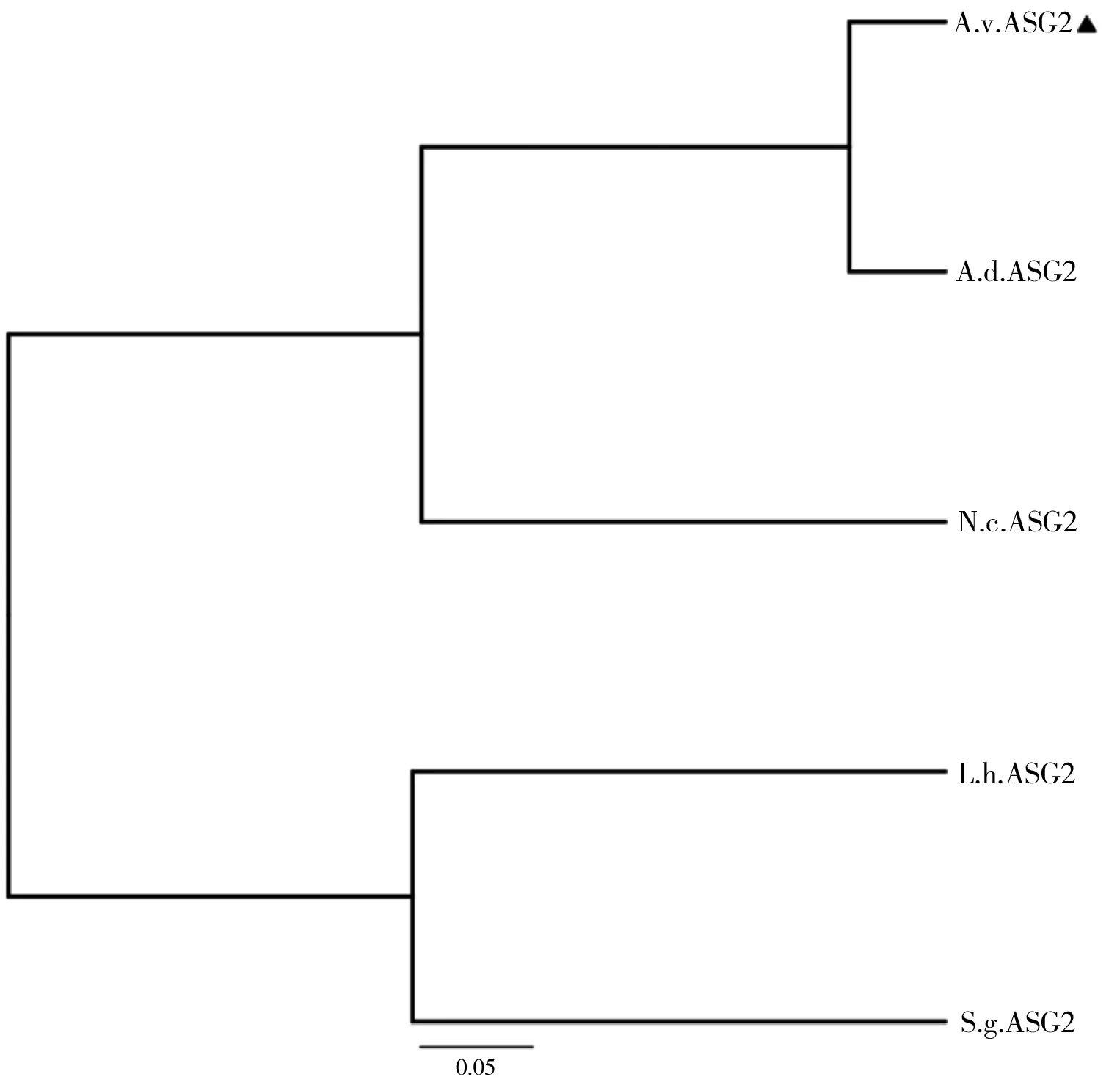
图4不同种属蜘蛛的ASG2 CT进化树分析
Fig 4 The phylogenetic tree of CT of ASG2 from different spider species
同时,将获得的AvASG2CT与已报道的其他种属蜘蛛的ASG2 CT进行了系统进化树分析。由系统进化树分析结果(图4)可知,AvASG2CT与十字园蛛(Araneusdiadematus)的亲缘关系最为相近,与上述序列保守性分析一致。因此,通过上述基因组PCR验证及序列比对分析和系统进化树分析可确定获得的AvASG2CT序列即为大腹园蛛AGS2 CT的编码序列。
2.2 AvASG2CT蛋白的克隆表达
将重组质粒pet-M-AvAGS2CT转化大肠杆菌BL21,外源表达AvAGS2CT蛋白。pet-M质粒载体源于改造过的pet-32系列载体,其含有纯化标签6His-tag,可用于镍柱纯化和免疫印迹分析;且6His-tag标签下游即为凝血酶位点,可用于切除标签,以去除标签对蛋白质结构功能的影响。
利用镍柱对目标蛋白AvAGS2CT进行亲和纯化,纯化结果如图5中SD-PAGE (Coomassie strained)所示,lane I为诱导后总蛋白样,在14.4 ku marker大小处,与诱导前总蛋白样lane N相比,出现大量表达的条带,与目标蛋白AvAGS2CT理论值15.3 ku相符,说明AvAGS2CT蛋白成功在大肠杆菌BL21中得到大量表达,且绝大部分在上清中(lane S),沉淀中几乎没有目标蛋白的存在(lane P),说明目标蛋白以可溶的形式存在于上清中,同时也说明菌体破碎得较为彻底;用含有20 mmol/L咪唑的wash buffer对镍柱中的非特异性结合的杂蛋白进行冲洗,如lane W所示,泳道中既没有杂蛋白的存在也没有出现目标蛋白,说明杂蛋白洗脱效果较好;随后利用含有250 mmol/L咪唑的elution buffer对目标蛋白进行洗脱收集,如lane E1所示,所获得的目标蛋白纯度可达90%以上。由序列分析可知,目标蛋白AvAGS2CT序列中含有一个半胱氨酸Cys,推测可形成分子间二硫键,因此制备了非还原样E1′(不含有还原剂DTT等),如lane E1′所示,确实有部分目标蛋白AvAGS2CT形成了二聚体。为去除6His-tag,以减少其对目标蛋白AvAGS2CT结构功能的影响,利用凝血酶在透析过程中,对纯化标签进行切除,如lane T所示,去除标签后目标蛋白符合理论值大小13.7 ku,表明6His-tag成功从目标蛋白被切除;目标蛋白经过镍柱亲和纯化和标签切除,最终的产量约75 mg/mL。经过透析和标签切除的目标蛋白样品用于后续的CD测试。
同时,为了对目标蛋白AvAGS2CT(未切除6His-tag的目标蛋白样E1)进行定性分析,利用6His-tag的特异性的抗体,对其进行了Western-blot检测。如图5所示(Anti His),经过免疫印迹成功检测到了目标条带的存在,且条带位置大小与理论值相符,因此,可进一步证明目标蛋白AvAGS2CT成功在体外得到表达纯化。
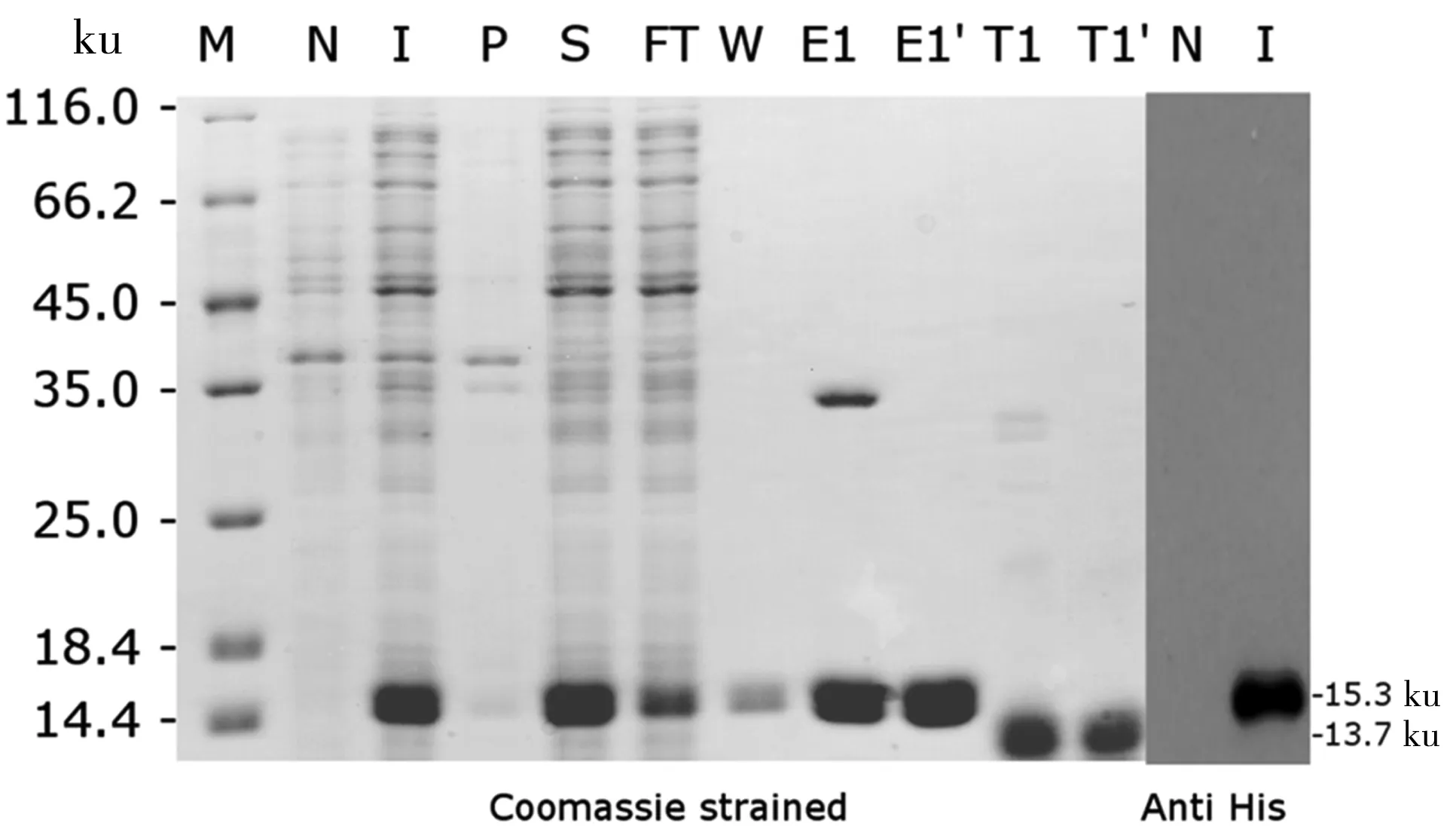
M:蛋白质marker;N:诱导前;I:诱导后;P:沉淀;S:上清;FT:穿柱液;W:冲洗;E1:洗脱样;E1′:还原样;T1:去标签样;T1′:去标签还原样
图5AvAGS2CT蛋白表达的SDS-PAGE和Western-blot分析
Fig 5 SDS-PAGE and Western-blot analysis of the expression of AvAGS2CT
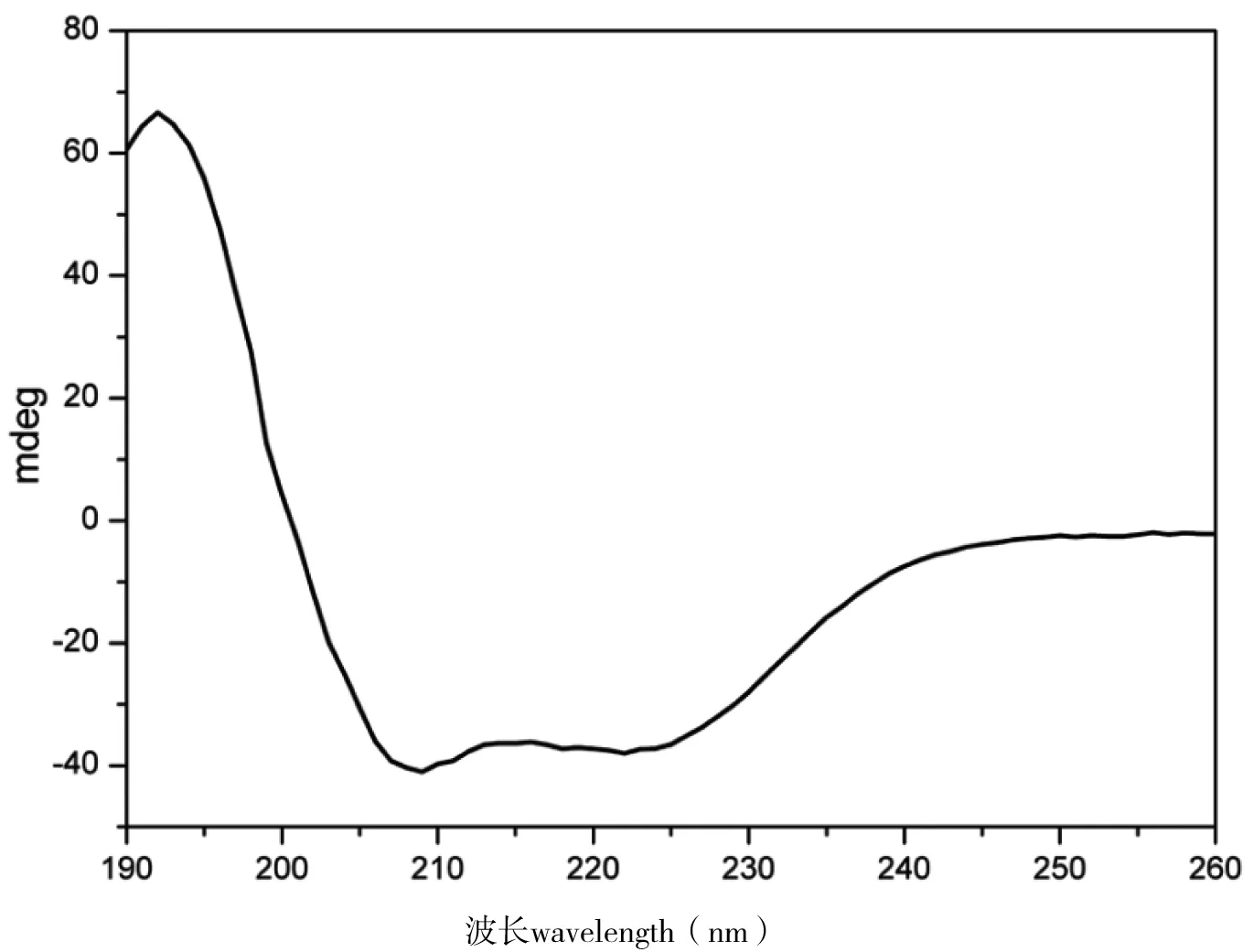
图6 AvASG2CT的CD图谱
2.3 AvASG2CT蛋白二级结构分析
为分析AvASG2CT蛋白的二级结构,首先对其进行预测,由预测结果可知,AvASG2CT蛋白包含5个α-helix (H1-H5),图3中红色圆柱所示。随后,对AvASG2CT蛋白进行CD测试,以检测其二级结构。其CD图谱显示(图6),AvASG2CT蛋白在193 nm处有正吸收峰,在208 nm和222 nm处有负吸收峰,均为α-helix的特征吸收峰;该图谱显示AvASG2CT蛋白在溶液中以α-helix的构象存在,与预测结果相符。
3 讨论与结论
蛛丝蛋白的末端重复模块NT和CT,在蛛丝蛋白的高浓度储存和成丝过程中扮演着重要角色。目前,仅有MaSp (主壶腹腺丝蛋白)的NT的高级结构和功能得到解析,研究表明其单体包含5个α-helix,以同向平行二聚体的形式,在pH值依赖条件下,在蛛丝蛋白储存和成丝过程中发挥作用[20, 28]。而蛛丝蛋白的CT则主要是在成丝过程中发挥作用,已报道的CT结构表明,不同蛛丝蛋白的高级结构具有一定的保守性,其单体均包含5个α-helix,以同向平行的方式发挥功能;但是其结构仍具有一定的差异,且功能也各不相同。如,MaSp的CT二聚体以盐键和二硫键维持结构,能够影响主壶腹腺丝蛋白重复模块的成丝质量,融合CT的重复模块形成的丝纤维更为有序[24];MiSp的CT二聚体以分子间疏水作用力维持其结构,在次壶腹腺丝蛋白的成丝过程扮演着晶核的作用,能够触发丝纤维的形成[25];AcSp的CT二聚体同样以盐键等分子间作用力维持结构,对葡萄状腺丝蛋白重复模块具有调控作用,但是有无CT,葡萄状腺丝蛋白重复模块形成的丝纤维没有较大的差异[29]。因此,可以看出虽然CT的高级结构具有一定的保守性,但是其结构和功能却不尽相同;所以研究不同蛛丝蛋白的CT结构功能研究是非常重要的,这是蛛丝蛋白的仿生应用的所必须的。
但是迄今为止,关于ASG2的研究非常少,尤其是关于ASG2的结构功能研究和仿生应用。目前已经证明,ASG2属于蛛丝蛋白类[15],且已有研究者尝试对ASG2进行重组表达,表明ASG2具有形成丝纤维的潜能[14]。由已发表的络新妇蛛(Nephilaclavipes) ASG2的cDNA序列可知[14, 16],ASG2的重复模块不同于MaSp含有大量的polyA模块,也不同于鞭状腺蛛丝蛋白(FlSp)含有大量的GPGGX和GGA模块,造成重组的MaSp或FlSp外源表达非常困难,且表达产量较低,而ASG2的重复模块不含上述序列,推测其表达产量会有所提高,且材料学性能方面可能相对于其他种蛛丝也可能会有新的发现,因此,ASG2具有作为一种新的仿生蛛丝材料的潜在应用价值。为了ASG2后续的仿生应用,ASG2的结构功能研究是非常必要的,尤其是对ASG2末端非重复功能模块NT和CT的结构功能的研究,是探索ASG2成丝机理的首要条件。
为了获取大腹园蛛ASG2 CT的编码基因,首先根据ASG2的同源基因在EST文库中进行了同源搜索,确定了大腹园蛛ASG2 CT的一段编码序列,并根据该序列设计特异性引物,进行了单引物扩增,利用接头引物经过巢式PCR,最终获得了大腹园蛛ASG2 CT的下游完整编码序列。为了保证序列可靠性,再次根据获得的序列涉及特异性引物,以基因组为模板,进行PCR验证,测序结果表明,两次得到的ASG2 CT编码基因序列完全保持一致。同时经过后续不同种属蜘蛛ASG2 CT的同源性比对分析及进化树分析,可以充分确定本次实验所获取大腹园蛛ASG2 CT的编码基因的可靠性,丰富了ASG2 CT的基因序列资源;同时对AvASG2CT蛋白进行外源表达纯化,可用于后续的ASG2成丝机理及仿生研究。
现有的研究表明,蛛丝蛋白的CT结构包含5个α-helix,对大腹园蛛ASG2 CT即AvASG2CT的二级结构进行预测,表明其也包含5个α-helix;同时其CD图谱呈现标准的α-helix结构特征峰,表明AvASG2CT蛋白在pH 7.0的磷酸盐buffer中维持着α-helix结构,与已报道的CT结构保持一致。本研究仅对AvASG2CT蛋白的二级结构进行了初步探索,但是其高级结构解析、二聚化机制及在成丝过程中所扮演的角色等都需要进一步的探索。
本研究首次获得了大腹园蛛(Araneusventricosus) ASG2 CT的完整编码基因AvASG2CT,通过单引物扩增和巣式PCR,获得了大腹园蛛ASG2 CT的完整编码基因,并经过基因组PCR验证、同源序列比对分析和进化树分析,确定了ASG2 CT编码基因AvASG2CT的可靠性;随后对AvASG2CT进行克隆表达,利用镍柱进行亲和纯化,及凝血酶对亲和标签进行切除,最终其在大肠杆菌BL21中的产量可达75 mg/L;同时,本研究对大腹园蛛ASG2 CT的二级结构进行了初步的探索,AvASG2CT蛋白的CD图谱显示,AvASG2CT蛋白的二级结构在pH 7.0的磷酸盐buffer中主要呈现α-helix结构;这是首次对ASG2 CT的二级结构进行了探索,目前尚无ASG2 CT结构功能等相关研究的报道。本研究为ASG2 CT的研究提供了基因材料,为ASG2 CT高级结构解析和功能研究,以及后续ASG2蛛丝蛋白的成丝机理研究和仿生应用奠定基础。
