二次离子质谱测定珊瑚氧同位素的制靶技术评价
2018-12-10邹洁琼韦刚健邓文峰陈雪霏张彦强夏小平
邹洁琼,韦刚健,邓文峰,陈雪霏,杨 晴,张彦强,夏小平
(1.中国科学院广州地球化学研究所,同位素地球化学国家重点实验室,广东 广州 510640;2.中国科学院大学,北京 100049)
珊瑚骨骼的氧同位素组成是记录其生长时期海水温度(SST)的重要替代指标。在特定海域以及限定的气候环境条件下,根据珊瑚生长过程中氧同位素组成的变化可重建SST演化记录。近年来,国内外研究者成功重建了月、季节、年际到年代际等不同时间尺度上的海水表层温度[1-4]。随着分析技术的发展,研究者们发现,在短时间尺度上(日-周分辨率)造礁珊瑚氧同位素组成与温度解耦,无法重建海水表层温度[5-7]。因此,海水温度与珊瑚氧同位素分馏机理成为国内外学者关注的重点,而珊瑚高分辨率氧同位素的准确测定是研究短时间尺度海水温度与珊瑚氧同位素分馏机理、探讨氧同位素重建高分辨率古气候记录合理性的唯一技术手段。
目前,二次离子质谱是进行微区原位珊瑚氧同位素组成的主要仪器,测定过程中,制约分析准确度和精度的主要因素是珊瑚基体效应(IMFcoral)。以往的研究重点关注了珊瑚基体效应的计算和变化规律[5],但是二次离子质谱对珊瑚样品的分析是表面分析,制靶技术对珊瑚氧同位素分析测试的影响在该研究中却被忽视了。与锆石、金红石、文石等无机矿物晶体相比,珊瑚样品具有特殊性。首先,珊瑚骨骼生长错综复杂,发育较多孔隙[8]。若是取样的珊瑚薄片厚度较厚,在真空灌注树脂胶的过程中,受制于环氧树脂胶的黏度,树脂胶并不能完全填充孔隙,导致样品靶面不连续,影响氧同位素测试结果。其次,珊瑚骨骼的生长速率存在各向不均一性[9],在深度上存在时间差。若二次离子质谱分析测试的样品面与传统氧同位素分析取样面在深度上相差过大的话,由于氧同位素动力学分馏的差异[10]和珊瑚内部季节性变化的生命效应[11],可能会影响珊瑚基体效应规律研究的客观性和准确性,从而影响氧同位素分析结果的可靠性。
鉴于珊瑚氧同位素不均一性,本工作拟设计取样厚度和取样深度的对比实验,利用CAMECA IMS1280-HR二次离子质谱仪分析不同取样厚度和取样深度珊瑚样品的氧同位素组成,并与传统氧同位素分析方法结果对比,获得对应的珊瑚基体效应(IMFcoral);然后通过对比实验中珊瑚基体效应的相对变化情况,来评估取样厚度和取样深度对珊瑚氧同位素分析的影响,并提出对应的解决策略。
1 样品及分析方法
1.1 珊瑚样品处理
珊瑚样品10AR2(P.lutea):2010年采自澳大利亚大堡礁北部Arlington环礁(16°38′S,146°06′E),水深约4 m,用水下钻机沿其最大生长方向钻取的岩芯。
将岩芯切成厚度约7 mm的薄板,通过X射线拍照获取其生长纹层。然后,将珊瑚薄板置于10%的H2O2中浸泡24 h去除有机质,用去离子水将珊瑚薄片超声3次后,于室温下自然风干。以上处理工作均在中国科学院广州地球化学研究所同位素地球化学国家重点实验室完成。
1.1.1不同取样厚度珊瑚样品的制备 取一部分风干后的珊瑚薄板待磷酸酸化法测定其氧同位素组成,再使用SJ-160型慢速锯沿其最大生长轴切出厚度分别为3 mm和5 mm的珊瑚片2007-A和2007-B。本次对比实验所分析的珊瑚测量面是被金刚石锯片切开相对的2个面,即2007-A和2007-B取样深度均为3 mm。
1.1.2不同取样深度珊瑚样品的制备 取一部分风干后的珊瑚薄板待磷酸酸化法测定其氧同位素组成。为了探讨珊瑚的取样深度对基体的影响,使用SJ-160型慢速锯沿着最大生长轴方向,即分别从距离珊瑚表层0 mm和3 mm处切取珊瑚片。为了避免珊瑚厚度的影响,珊瑚的取样厚度均为3 mm。
珊瑚树脂靶的制作流程示于图1。将切好的珊瑚片在10 kPa真空下,使用Buehler EpoxiCureTM2(20-3430-128)环氧树脂胶和Buehler EpoxiCureTM2(20-3432-032)树脂固化剂(树脂∶固化剂=5∶1)进行第一次真空灌注环氧树脂胶。静置24 h后,将固化的树脂靶放入45 ℃烘箱中烘干5 h以上,取出。使用Buehler IroMet 5000型切割机,沿图1中标注的切割线进行切割,切取的厚度大约为1 mm。使用800目金刚石磨盘将切好的珊瑚片磨平磨薄至100~300 μm,以保证珊瑚骨骼在显微镜下的最佳显微形态,在此过程中使用流动的18 MΩ电导率的去离子水作为润滑剂。将切好的100~300 μm珊瑚片粘在直径为22 mm的双面胶上,在0.01 kPa真空下,使用上述的环氧树脂和固化剂进行第二次真空灌注环氧树脂胶。为减少划痕,使用Buehler 4 000目金刚石砂纸磨平树脂靶,并使用Buehler AutoMet300型抛光机,1 μm Buehler金刚石抛光膏对第2次灌胶的珊瑚树脂靶进行轻微的表面抛光。为了获得较平整的样品靶面,隔1~2个月,再次使用1 μm金刚石悬浮液抛光[12]。

图1 珊瑚树脂靶制作流程示意图Fig.1 Production process schematic drawing of the coral bar
1.2 二次离子质谱氧同位素分析流程
文石珊瑚样品的氧同位素微区原位分析在同位素地球化学国家重点实验室的二次离子质谱(SIMS)实验室完成,采用的仪器型号为CAMECA IMS1280-HR。本实验采用的133Cs+离子源一次离子强度为2~3 nA,通过10 kV加速电压聚焦和光栅扫描,在样品表面形成直径为20 μm的束斑。所产生的二次离子经-10 kV加速电压提取,通过静电场和磁场后分离出18O-和16O-,分别用法拉第杯接收器L’2和H1接收。测定18O/16O时设定的质量分辨率(MRP)为2 400,采用NMR提高磁场稳定性。为了获得比较稳定的18O/16O值,将样品表面预剥蚀时间设定为30~60 s。测试过程中参考物质设置如下:1个Carrara大理岩、1个NBS-18、8个未知珊瑚样、1个NBS-18、1个Carrara大理岩,并依次循环。结果以PDB标准给出,单点获得的18O/16O比值内部精度优于0.2‰(2SE),标准物质Carrara大理岩和NBS-18参考物质测试数据的标准偏差为0.4‰(2SD)。
1.3 传统氧同位素分析流程
珊瑚粉末样品氧同位素分析在同位素地球化学国家重点实验室GV Isoprime Ⅱ型稳定同位素质谱仪(IRMS)上进行,该仪器配备了MultiPrep®前处理系统。取约1 mg珊瑚粉末与102% H3PO4在90 ℃下真空中反应,将释放出的CO2导入质谱仪测定18O/16O值,结果以PDB标准给出,其分析误差优于0.08‰(1σ)。详细的分析流程参照邓文峰等的报道[19]。
2 结果与讨论
2.1 珊瑚基体效应的计算
在离子探针二次离子激发过程中,因离子化效率和传输效率的差异,二次离子质谱检测器所测得的18O-/16O-和样品真实的18O/16O不同[13],即存在仪器质量分馏效应(IMFinst):
(1)
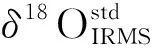
(2)

IMFcoral=δ18OSIMS-δ18OIRMS
(3)
式中:δ18OSIMS为方解石标准物质校正后的珊瑚待测样品SIMS的测量值,δ18OIRMS为珊瑚样品IRMS的测量值。
2.2 有机质的影响
珊瑚骨骼的主要组成除矿物文石之外,还有不大于3%(wt)的有机物质。在样品处理时,用10%H2O2对珊瑚薄板进行浸泡。珊瑚质地疏松,双氧水较易渗透进入珊瑚骨骼溶解有机物质,但是有机质是否仍有残留还需进一步评估。Rollion-Bard等[15]在对有机物进行原位微区碳氧同位素分析过程中发现,在5 nA一次束流下,有机物质16O-的计数是5×105cps,并且有机物质的δ18Oraw(未经过仪器分馏校正)与16O-计数呈明显的负相关。在2 nA一次束流的轰击下,10AR2样品16O-的计数为(2.1~2.8)×109cps。如果存在有机物质的残留,10AR2样品的δ18Oraw(未经过仪器分馏校正)与16O-计数应该呈现负相关。测试10AR2样品的实验结果示于图2,在图2中并没有发现δ18Oraw(未经过仪器分馏校正)与16O-计数具有相关性。因此,在本次对比实验中,可认为有机质的影响并不明显。
2.3 取样厚度对珊瑚基体效应的影响
实验结果表明,在取样深度和取样厚度保持一致的情况下,切取的珊瑚片2007-A和2005-D的IMFcoral在误差范围内一致,详细数据列于表1。在取样深度保持一致的情况下,当切取的珊瑚片2007-A厚度为3 mm时,IMFcoral为-3.36‰;当切取的珊瑚片2007-B厚度为5 mm时,IMFcoral为-4.38‰。随着取样厚度的变化,IMFcoral从-3.36‰变化到-4.38‰,变化幅度为1.02‰。可见,在误差范围内,取样厚度对珊瑚基体效应的干扰非常明显。
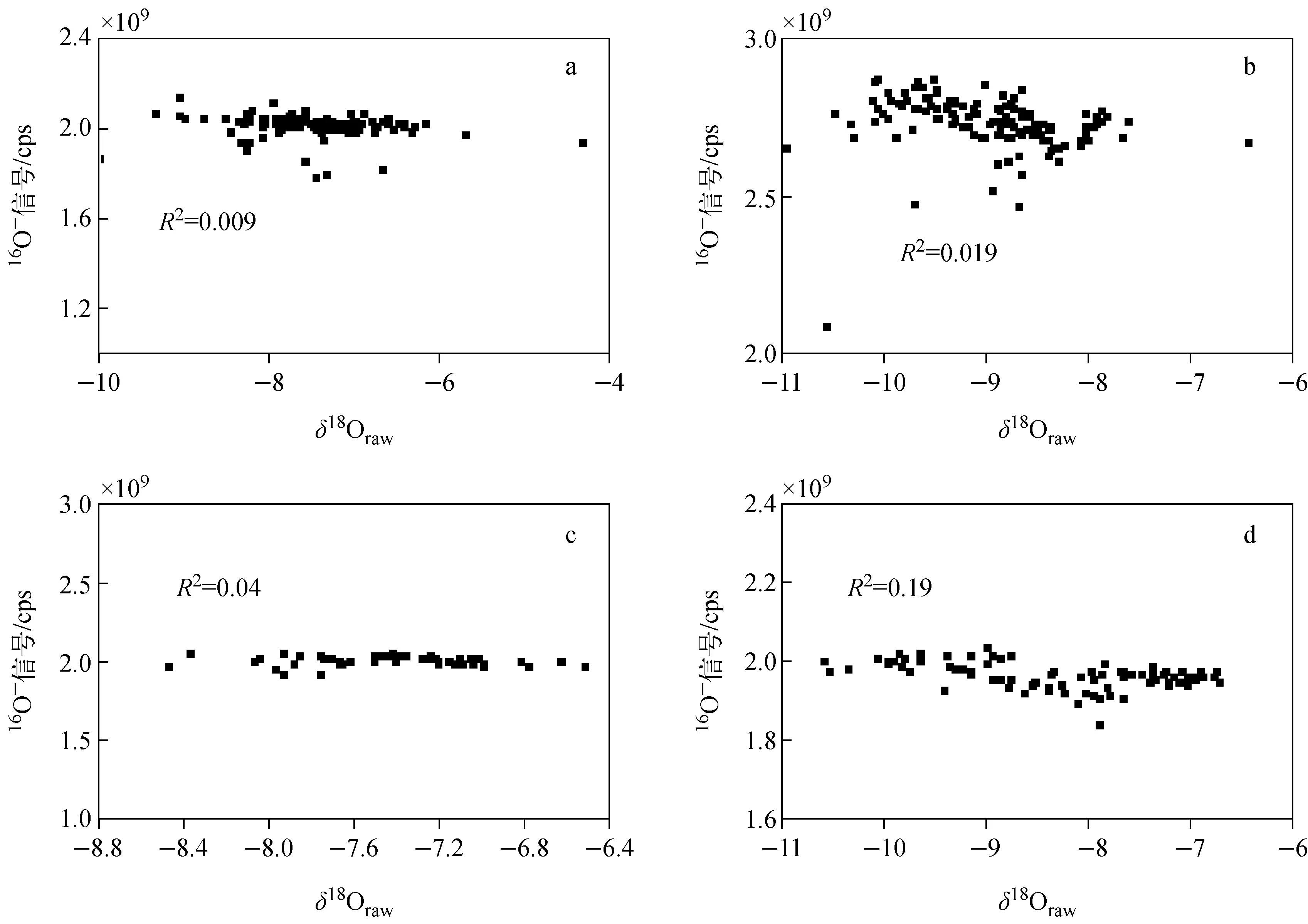
注:a.2007-A;b.2007-B;c.2005-C;d.2005-D图2 10AR2珊瑚样品的δ18Oraw值(未分馏校正)与16O-信号对比图Fig.2 Comparison between the δ18Oraw of the 10AR2 sample and the signal of 16O-

珊瑚片Coral pit取样厚度Samplethickness/mm取样深度Sampledepth/mm氧同位素δ18OPDB/‰气体质谱IRMS二次离子质谱SIMS珊瑚基体效应IMFcoral/‰靶面气泡Surfacebubbles2007-A332007-B532005-C302005-D33-4.82-5.05-8.18(n=114)-3.36无-9.2(n=127)-4.38若干-7.8(n=49)-2.75无-8.5(n=79)-3.45无
由于在传统氧同位素分析方法中并未发现1.02‰的变化幅度,分析其在珊瑚氧同位素分析中产生的原因,一方面可能是数据重现性低。珊瑚片2007-A和2007-B在二次离子质谱分析过程中,分析点在最大生长轴方向上的位置基本保持一致,但是最大生长轴存在大约2 mm左右的宽度范围,在宽度方向上的位置很难保持一致。如果在宽度2 mm的范围内,珊瑚存在极大不均一性,那么珊瑚片2007-A和2007-B可能会出现较大的差异。但是,本实验室对95 mm长珊瑚不同宽度位置对氧同位素分析的影响进行了长期监控,结果示于图3。可见,在误差范围内,并没有发现因不同宽度位置而出现1.02‰的变化幅度。在制靶过程中,取样的厚度不超过3 mm,取样深度保持一致,本实验在不同宽度位置上获得的珊瑚氧同位素的重现性较好。

注:δ18O1代表宽度位置1;δ18O2代表宽度位置2图3 珊瑚样品δ18OSIMS不同宽度位置上的长期重现性Fig.3 Duplicate ion microprobe δ18O measurements performed in the same ion probe spots during different horizontal orientation
另一方面,与文石、方解石等碳酸盐矿物不同,珊瑚骨骼生长错综复杂,发育较多孔隙。当切取的珊瑚薄片较厚时,在真空灌注树脂胶的过程中,由于受到液态环氧树脂胶的黏度和真空度的双重制约,液态环氧树脂胶可能无法完全填充所有孔隙,在珊瑚树脂靶的表面留下多个气泡或者孔洞,示于图4。
在二次离子质谱对珊瑚进行氧同位素测定时,表面的这些气泡或者孔洞可能会影响样品面电场的均匀对称分布特征[16]。在后期抛、磨样品靶的过程中,含有有机物的抛光物质、空气和H2O可能会残存在靶面的气泡和孔洞之中[17],而这些残存的物质在高真空条件下会被缓慢地释放[16],可能给珊瑚基体效应的准确估算带来影响。为了进一步验证上述结论,本实验分析了距离气泡远近不同的文石标准物质BB-AR的氧同位素组成。结果表明,BB-AR标准物质氧同位素出现了明显的差异。距离气泡为10、60和300 μm的δ18OSIMS值分别为-9.3‰、-8.1‰和-7.7‰,文石基体效应(IMFAragonite)分别为-1.51‰、-0.31‰和-0.09‰。该结果证实二次离子质谱测定珊瑚氧同位素时,若存在较多的气泡或者孔洞,会给珊瑚基体效应的准确估算带来误差。因此,在制作珊瑚样品靶过程中,应尽可能地降低气泡或者孔洞的数量。结合表1和图4,当珊瑚片取样厚度小于3 mm时,可以减少靶面形成的气泡或孔洞,从而有效地降低它们对珊瑚基体效应造成的影响。
2.4 取样深度对珊瑚基体效应的影响
在取样厚度保持一致的情况下,珊瑚片2005-C从距IRMS取样面0 mm开始取样时,IMFcoral为-2.75‰,与Allison和Rollion-Brad等[5,18]估算的珊瑚IMFcoral=-2.8‰在误差范围内一致;而珊瑚片2005-D从距IRMS取样面3 mm开始取样时,IMFcoral为-3.45‰。因距离IRMS取样面的深度不同,IMFcoral从-2.75‰变化到-3.45‰,变化幅度为0.7‰,明显超出了仪器测量的误差范围。该结果说明,取样深度对氧同位素分析测试的影响非常明显。
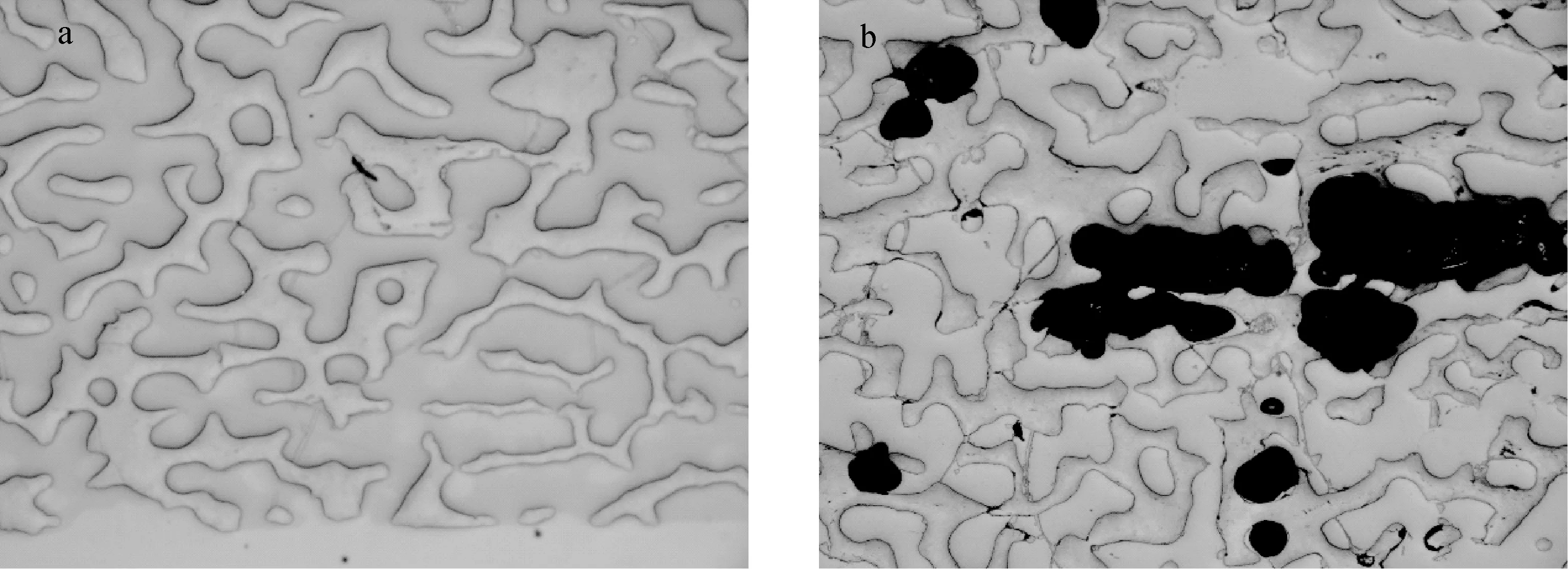
注:a.2007-A厚度3 mm五倍镜;b.2007-B厚度5 mm五倍镜图4 不同厚度对比图Fig.4 Different thickness of the coral
与锆石、金红石、方解石等矿物不同,珊瑚在不同方向上钙化速率的差异会造成氧同位素分馏,即珊瑚本身δ18OIRMS值在不同方向上存在差异。虽然珊瑚片2005-C和2005-D在最大生长轴方向上代表的是2005年生长的,但由于其深度上存在差异,与珊瑚片2005-C相对应的珊瑚本身δ18OIRMS值和珊瑚片2005-D所对应的δ18OIRMS值的时间可能存在差异。对于珊瑚来说,最大生长轴方向上的生长速率最快,以最大生长轴的生长速率为50 μm/天计算,深度方向上3 mm的差值,在时间上至少相差60天。珊瑚氧同位素组成往往具有较强的季节性变化,60天的时间差若是在夏季,此时与珊瑚共生的虫黄藻的光合作用能力增加,珊瑚钙化速率加快,珊瑚本身δ18OIRMS值呈明显地亏损;若是在冬季则正好相反,珊瑚生长速率慢,δ18OIRMS值相对夏季发生富集。正是由于季节性生物活动的差异,珊瑚片2005-C和2005-D分别对应的δ18OIRMS值存在原始的差异,在使用公式(3)进行计算时,很可能会导致珊瑚基体效应出现明显的差异。
因此,若SIMS分析面和IRMS分析面存在深度方向上的差异,由于珊瑚本身δ18OIRMS值存在差异,会导致珊瑚基体效应偏离正常值,对研究珊瑚基体效应的一般性规律造成明显的干扰。为了规避深度上的时间效应和珊瑚生命效应叠加的影响,在珊瑚氧同位素测试过程中,SIMS分析面和IRMS分析面应该尽量保持一致。
3 结论
通过对比实验发现,取样厚度和取样深度对珊瑚基体效应造成0.7‰~1.02‰的干扰,但两者的产生机制并不相同。切取的珊瑚过厚,在真空灌注树脂胶的过程中,靶面容易形成多处气泡,从而对珊瑚氧同位素分析测试造成明显的干扰。从珊瑚不同深度取样,深度上的时间效应和珊瑚的生命效应相互叠加造成珊瑚基体效应偏离正常值。在制靶过程中,取样的厚度不超过3 mm,取样深度与传统氧同位素取样面保持一致,可以较好地规避取样厚度和取样深度产生的影响。
致谢:感谢中国科学院广州地球化学研究所二次离子质谱实验室在10AR2样品原位氧同位素测试中给予的支持!
