地表灌溉对沉积含水层中碘迁移释放过程的影响
2018-12-06周海玲苏春利李俊霞
周海玲,苏春利,李俊霞
1.中国地质大学环境学院,武汉 430074 2.中国地质大学生物地质与环境地质国家重点实验室,武汉430074
0 引言
碘是维持生物生长发育必须的微量元素,人体内2/3的碘存在于甲状腺中,高碘或缺碘引起的人类或动物的各种疾病已成为一个全球性公共卫生问题[1-4]。在我国,碘缺乏问题曾经十分突出,之后随着研究工作的深入,如采取食盐加碘为主的防治手段,碘缺乏问题得到了很好的控制[5]。然而,近年来高碘问题却日益凸显,自20世纪70年代末期,在河北省发现高碘性甲状腺肿病以来,其他地区也陆续有一些关于高碘性甲状腺肿的报道,高碘饮用水所带来的一系列健康问题逐渐引起重视[6-9]。目前发现的内陆浅层原生高碘地下水分布区包括大同盆地[10]、河套平原[5]、晋中[11]等。其中,晋中地区浅层地下水中碘质量分数高达4 117 μg/L[11],远超我国饮用水的标准限值(150 μg/L)[12]。浅层地下水常常是当地居民生产生活的主要水源,尤其是干旱地区,而这些地质成因造成的原生劣质地下水(高盐、高砷、高氟、高碘等)的出现加剧了这些地区水资源的供需紧张[13-15]。目前,世界范围内针对高碘性甲状腺肿及有关碘的生物地球化学行为特征的研究主要集中于滨海地区及国家,如瑞典、丹麦等[10,16],而内陆地区则鲜有报道。
自然界中碘的主要存在形态为碘化物、碘酸盐和有机碘。碘离子对土壤矿物较低的亲和力使其可以在土壤中迁移转化为其他两种形态[17-18]。碘在土壤中的迁移转化受许多水化学参数和铁氧化物的影响,如温度、pH、氧化还原电位(ORP)、有机质和其他氧化还原对[19-20]。已有研究表明,铁矿物通常可作为碘的赋存载体[21-23],微生物可诱导可造成铁氧化物/氢氧化物发生还原溶解,进而造成碘释放,从而在地下水中发生富集[24]。生物活动(浮游生物/细菌)可将表层海水中的碘酸根(在部分海域可稳定赋存)转化为碘离子[25]。在厌氧条件下,微生物的硝酸盐还原作用也会影响碘的循环,地下水中硝酸盐丰富时,微生物会优先利用NO3-作为电子受体而非IO3-[26]。而当硝酸盐被全部消耗后,微生物可将Fe(Ⅲ)还原为Fe(Ⅱ)[27]。Sun等[28]提出向地下水中注入硝酸盐可影响铁氧化物/氢氧化物的还原溶解,进而影响地下水系统中碘的迁移释放。
有研究[9,29]表明,天然有机物会通过吸收/吸附作用和一些微生物活动控制碘的行为,碘可被强烈地吸收并保存于富含有机质的沉积物中。在有机质存在的情况下,一些增加晶格间距的低结晶铁氢氧化物频繁形成,使碘优先被吸附[30]。微生物作用下,有机物的降解和铁的氧化物/氢氧化物的还原溶解可能是影响碘释放到水相的主要地球化学过程。
周期性灌溉活动不仅会导致外源物质输入,如硝酸盐、有机质等,引起浅层地下水环境发生周期性波动[31-32],还会对地下水水化学组成产生影响[33]。在灌溉垂向补给过程中,地表水可将农业活动产生的部分可溶性组分冲刷至浅层地下水中。有研究[34]表明,大同盆地地下水中NO3-及SO42-的高值点主要分布在浅层地下水中,同时由于这些电子受体的输入促进了浅含水层中微生物的活动,使得富碘有机质发生降解,从而使其吸附的碘释放至地下水中,形成高碘地下水;另一方面,部分区域选取深层富碘水作为灌溉水源,进而造成浅表地下水系统中碘的直接输入。前期研究[10,35]表明,地下水环境,特别是氧化还原环境是影响与控制不同碘形态迁移转化的重要因素。
论文选取我国典型内陆干旱高碘地下水分布区大同盆地,对其浅层地下水环境中碘的迁移富集规律进行微宇宙实验研究,探究在不同外源物质输入条件下碘的迁移释放规律,以期认识控制碘迁移富集的生物地球化学过程,为区域供水安全提供指导作用。
1 材料和方法
1.1 土壤样品采集
选取大同盆地中心原生高碘地下水分布区,钻凿深约300 m的钻孔,根据岩性变化采集沉积物样品。样品采集间隔为1.5 m。样品用聚乙烯管封装,封口蜡封,尽可能减少沉积物与空气的接触时间,并于4 ℃下避光保存。
1.2 外源物质输入拟合实验
1.2.1 菌种选取与培养
课题组前期研究[36]表明,在大同盆地地下水系统中存在铁矿还原菌。据此,本实验选取典型铁还原菌奥奈达希瓦氏菌MR-1(ShewanellaoneidensisMR-1, 文中简称MR-1)为代表性菌种,该菌种取自中国地质大学(武汉)生物地质与环境地质国家重点实验室,该菌为兼性厌氧,且适宜生长的培养基较为广泛。采用的培养基为LB(Luria-Bertani)培养基:酵母膏5.0 g/L,蛋白胨10.0 g/L,NaCl 10.0 g/L。固体培养基按1.5%~2.0%的比例加入琼脂粉,121 ℃灭菌30 min。菌种扩大培养前,将0.1 mL的MR-1菌液接种至装有100 mL无菌培养基的血清瓶中,密封摇匀,置于恒温培养箱中培养2 d,用无菌水将菌液清洗至厌氧瓶中,接种液待用。
1.2.2 实验方案
由于大同盆地中部浅层地下水以Na-HCO3型水为主[37-38];因此,浅层沉积物DXZ04和深层沉积物DXZ147实验组采用15.5 mmol的NaHCO3溶液(pH=8)为母液,外源硝酸盐输入实验组采用15.5 mmol NaHCO3与5.3 mmol NaNO3的混合液(pH=8)为母液,按水土比10:1的比例对沉积物样品DXZ04和DXZ147分别在厌氧条件下进行微观处理实验,即1.5 g灭菌沉积物至15 mL 母液中,在棕色血清瓶中完成条件下的微宇宙实验。具体实验方法见表1。每组实验包括3个环境,具体如下:
1)空白组:1.5 g沉积物添加至15 mL 母液中。
2)MR-1单一作用:1.5 g沉积物添加至15 mL母液中,同时添加微生物MR-1。
3)MR-1和有机质共同作用:1.5 g沉积物添加至15 mL 母液中,同时添加30 mmol乳酸钠及微生物MR-1。
上述实验条件均为厌氧环境,所添加样品及试剂均已进行高温高压灭菌处理,并同时完成重复对照实验。将批量样品置于32 ℃的摇床中200 r/min振荡培养,实验周期为10~20 d,采样频率为1个/d。具体实验见表1。
1.2.3 测试分析
1)固相
原状沉积物样品自然风干后研磨,过0.125 mm筛孔,用于测定其pH,总碘、总有机碳质量分数,测试分析方法参照文献[39]和[11]。
离心后所得的沉积物样品完成微生物可利用态Fe(II)及Fe总提取测试分析[40-42]:将5 mL 0.5 mol HCl加入0.1 g湿状沉积物中,震荡1 h,离心后用邻菲啰啉显色法测定其上清液Fe(Ⅱ)和Fe总质量分数。
将所得湿状沉积物烘干后装于无菌离心管中,采用X射线衍射仪(XRD, D8-Focus, Bruker AXS)分析其矿物组分。上述所有测试分析均在中国地质大学(武汉)生物地质与环境地质国家重点实验室完成,分析结果重现性好,偏差为±5%。
2)液相
采用高速离心机将样品进行离心,分离上清液。采用便携式水质分析仪HACH完成液相pH及ORP监测,随后用 0.22 μm滤膜过滤,测定其氨氮、亚硝酸盐氮、Fe(Ⅱ)、Fe总、碘形态、总碘及NO3-质量浓度。Fe(Ⅱ)、Fe总采用国标邻菲啰啉显色法(Fe总测试前用盐酸羟胺将三价铁还原为二价铁),在510 nm处用DR2800紫外可见光分光光度计测量其吸光度[43]。总碘质量浓度采用电感耦合等离子质谱仪(ICP-MS,Aglient 7700)进行测定,检出限为0.3 μg/L。碘形态采用高效液相色谱-质谱联用技术(HPLC-ICP-MS, AG20 analytical column, ICS-1500, Dionex; Aglient 7700)进行测试,碘酸根离子和碘离子的检出限分别为0.035 μg/L和0.025 μg/L。NO3-采用离子色谱法(Metrohm 761 Compact)进行测试。氨氮和亚硝酸盐氮用DR2800型便携式分光光度计进行测定,测试范围分别为0.020~2.500 mg/L和0.002~0.300 mg/L。
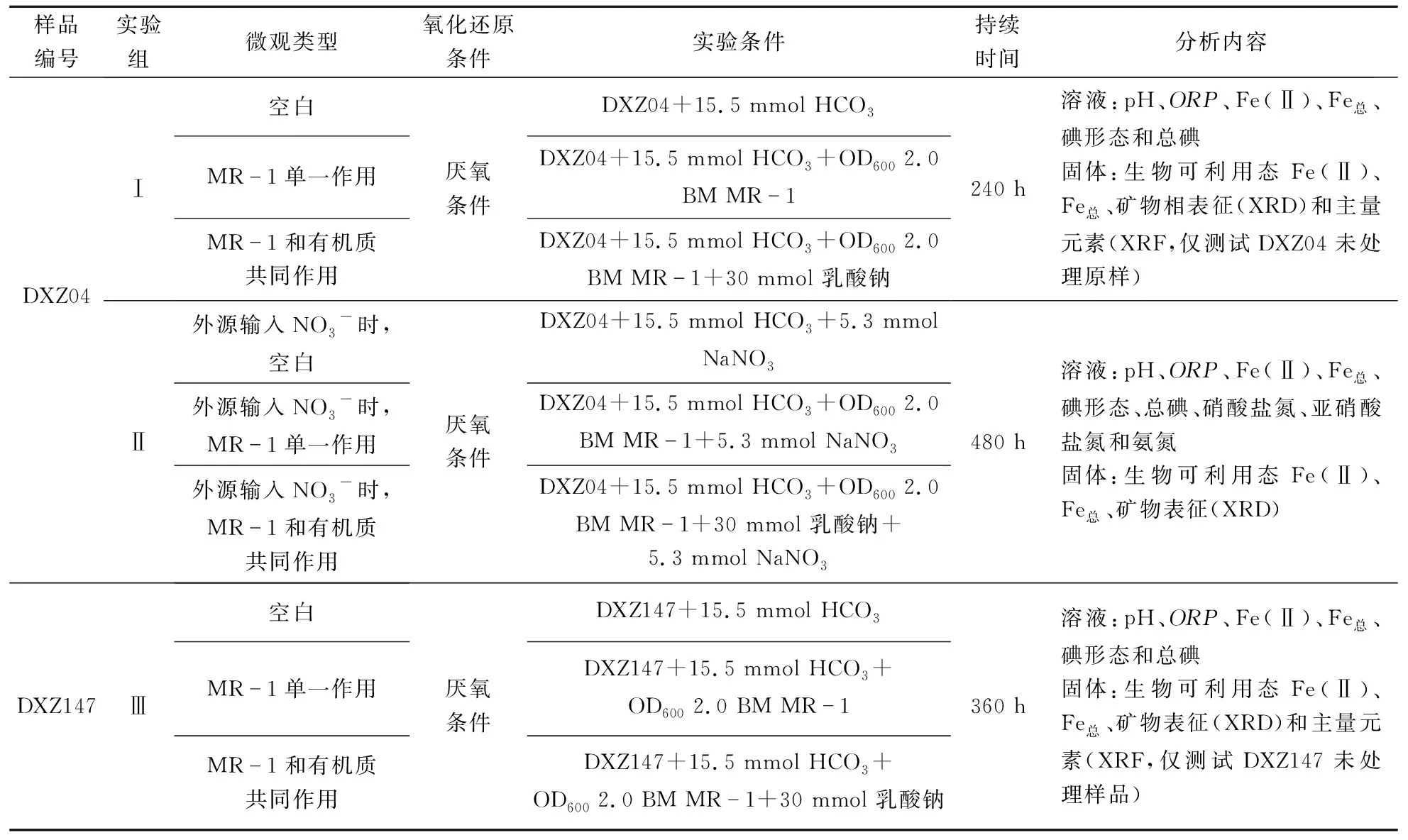
表1 实验条件及分析内容
2 结果与讨论
2.1 沉积物理化性质
研究区浅层沉积物(<25 m)中总碘质量分数的变化范围为0.055~7.691 μg/g,中间值为0.265 μg/g。碘质量分数较高的沉积物均分布于深度小于5 m的浅层表环境,明显高于我国土壤平均碘质量分数(2.20 μg/g)[44]与全球土壤平均质量分数相近(约5.1 μg/g)[45];TOC质量分数高值区分布于深度17~24 m区域,以偏黏土质中砂为主。
实验选取富碘浅层沉积物DXZ04和深层沉积物DXZ147为实验对象,完成不同外源物质(有机质和硝酸盐)输入条件下的室内微观拟合实验。样品理化性质见表2。

表2 大同盆地沉积物样品特性
2.2 不同深度沉积物中外源有机质输入的影响
2.2.1 浅层沉积物
浅层沉积物实验结果见图1。理论上,厌氧条件下,无外源有机质输入时,微生物会利用沉积物自身有机质作为电子供体还原铁氧化物/氢氧化物矿物,使液相中Fe(Ⅱ)质量浓度升高,使吸附于矿物上的碘随之释放,造成液相中碘质量浓度升高。实验结果表明,MR-1单一作用实验组相对于空白组Fe(Ⅱ)质量浓度有微弱的升高,但均低于0.50 mg/L(图1a,b),同时固相Fe(Ⅱ)/Fe总也呈现微弱的上升趋势(图1c),但却无明显的碘释放现象(图1d);表明微生物可利用浅层沉积物自身有机质为电子受体还原铁的氧化物/氢氧化物矿物,但还原程度较低。
随着时间的推移,MR-1和有机质共同作用实验组中Fe(Ⅱ)质量浓度呈逐渐升高的趋势(图1a),同时,固相中Fe(Ⅱ)/Fe总明显高于其他两组(图1c);说明在外源添加有机质条件下,MR-1对固相中铁矿物的还原作用较为明显。同时,吸附于铁矿物上的碘被释放至液相中;表明在浅层沉积物中,铁的氧化物/氢氧化物矿物是碘的主要载体之一。图1e表明碘主要以碘离子的形态存在于液相中。
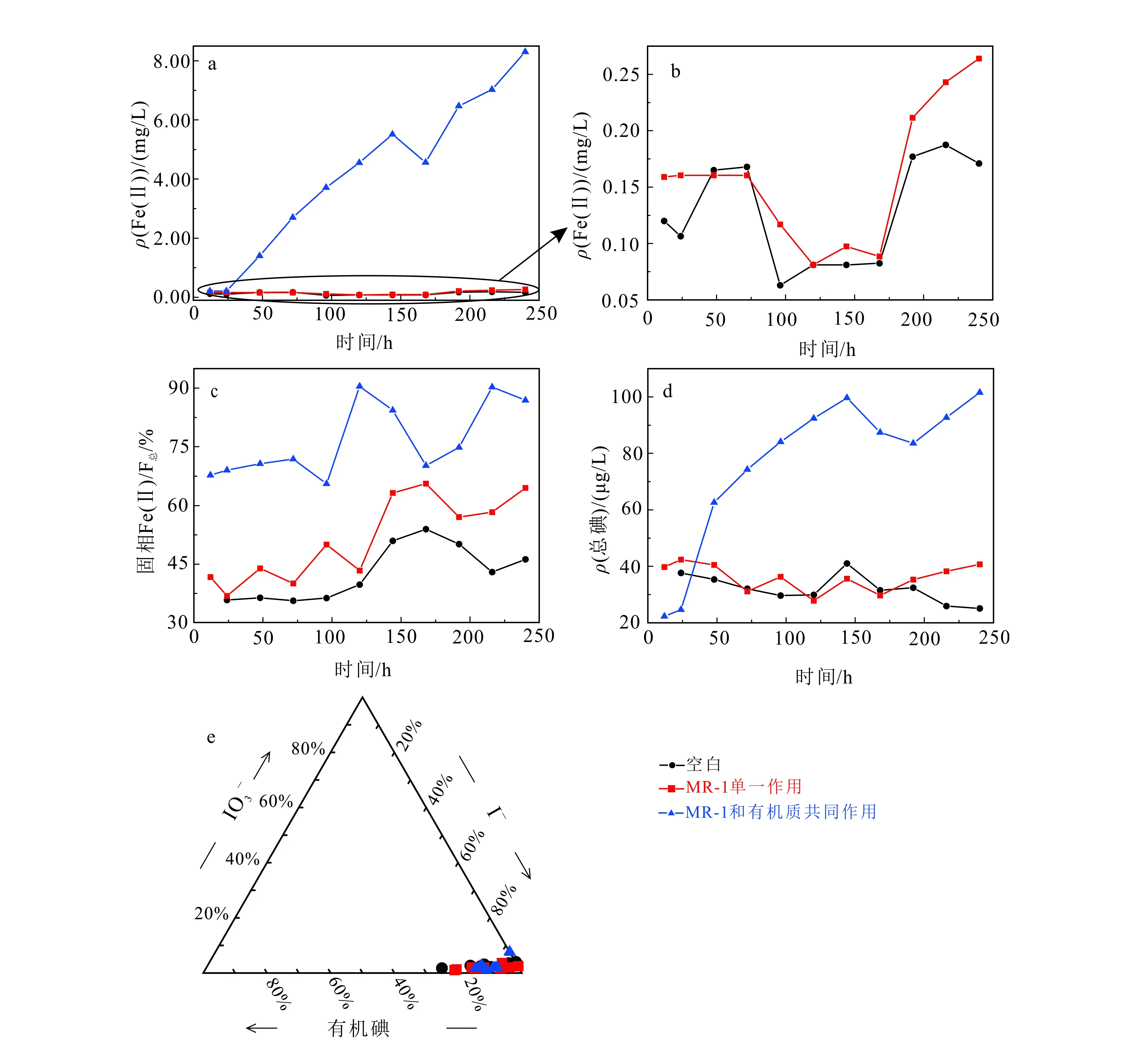
a,b.液相Fe(Ⅱ)质量浓度;c.固相Fe(Ⅱ)/Fe总;d.液相总碘质量浓度;e.液相中碘的存在形态。b为a的局部放大图。图1 浅层沉积物DXZ04微观实验Fig.1 Microscopic experimental results of shallow sediment DXZ04
矿物相表征结果(图2)表明:浅层沉积物中黏土矿物相以伊利石为主,铁氧化物矿物主要以针铁矿为主;在MR-1单一作者或MR-1和有机质共同作用后,沉积物中伊利石衍射峰变小甚至消失。这可能是由于微生物利用伊利石黏土矿物中铁氧化物矿物为电子受体,将其还原为Fe(II),进而造成溶解性Fe(Ⅱ)及碘离子的释放。由此推测,在浅层沉积物中伊利石黏土矿物吸附的铁氧化物矿物相应该是碘的搭载介质。
2.2.2 深层沉积物
深层沉积物实验结果如图3所示。厌氧条件下,当MR-1单一作用时,液相中Fe(Ⅱ)质量浓度与空白组无明显变化(图3a)。理论上微生物可利用沉积物自身有机质作为电子供体将沉积物铁氧化物/氢氧化物矿物还原溶解,造成液相中Fe(Ⅱ)质量浓度升高,同时将吸附于矿物上的碘释放至液相中;而实验结果并未发现明显的碘释放现象(图3c),表明深层沉积物中有机质质量浓度低,较难被微生物直接利用。
在厌氧环境中,当MR-1和有机质共同作用时:液相中Fe(Ⅱ)质量浓度随时间的推移呈较明显的升高趋势(图3a);固相中Fe(Ⅱ)/Fe总也高于其他两组(图3b);但其碘质量浓度虽高于其他两组,却无明显升高的趋势(图3c)。表明沉积物中铁氧化物/氢氧化物矿物被还原,造成Fe(Ⅱ)的释放,但在微生物作用下还原铁矿物的过程中碘释放量较低,且碘的形态均以碘离子为主(图3d),这与课题组前期研究结果一致[10]。

图2 浅层沉积物DXZ04 X射线衍射(XRD)分析结果图 Fig.2 XRD analysis results of shallow sediments DXZ04
不同条件下深层沉积物的矿物表征结果如图4所示,各实验组中铁矿物相均以针铁矿、赤铁矿和黄铁矿为主,次生黏土矿物质量分数低,且矿物组成变化不明显,这可能是造成液相中Fe(Ⅱ)和总碘质量分数明显低于浅层沉积物实验组的原因之一(图1和3)。同时也说明深层沉积物中有机质较难被微生物利用或利用效率较低。
2.3 浅层沉积物中外源NO3-输入的影响
前期研究[10]表明,在浅层环境中,地表人为灌溉活动影响深度为25~30 m,同时可造成浅层环境氧化还原环境的变化及部分外源物质(如有机质和硝酸盐)的输入,由此可造成浅层环境中的碘发生迁移释放。本研究主要讨论厌氧条件下有机质及硝酸盐的输入对浅层土壤中碘的迁移释放的影响。
由图1和图5分析可知,在外源输入硝酸盐条件下,其液相Fe(Ⅱ)、固相Fe(Ⅱ)/Fe总及液相碘的变化趋势大致相同,但可看出Fe(Ⅱ)质量浓度低于未添加硝酸盐实验组。这可能是由于在外源添加NO3-情况下,MR-1会优先利用NO3-做电子受体,而非Fe(Ⅲ);而当NO3-被全部消耗后,MR-1厌氧条件下NO3-可能通过反硝化作用还原为NO2-,也可能作为氮源被微生物还原,以NH4+形式存在。从图6b可以看出,当MR-1单一作用时,液相中NH4+浓度随时间的推移逐渐增加,随之趋于稳定;说明硝酸盐可作为微生物生长的氮源而被其直接利用,从而促进微生物活性,但其对浅层沉积物碘的释放并没有直接影响(图5c)。从图6a可知,在厌氧条件下,外源硝酸盐在MR-1和有机质共同作用下,NO3-会在短时间内被微生物消耗完,所以外源硝酸盐对浅层沉积物碘的释放的影响是有限的。

a.液相Fe(Ⅱ)质量浓度;b.固相Fe(Ⅱ)/Fe总l;c.液相总碘质量浓度;d.液相中碘的存在形态。图3 深层沉积物DXZ147微观实验结果 Fig.3 Microscopic experimental results of deep deposit DXZ147
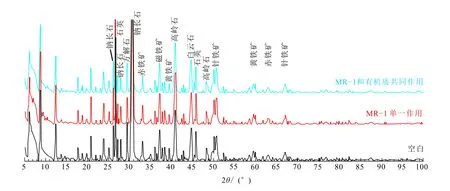
图4 深层沉积物DXZ147 XRD分析结果图Fig.4 XRD analysis results of deep deposit DXZ147
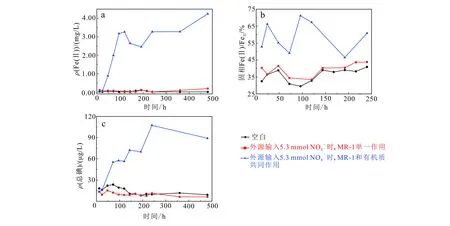
图5 外源输入NO3-时浅层沉积物DXZ04微观实验结果 Fig.5 Microscopic experimental results of shallow sediment DXZ04 with NO3- inputs

d为c的局部放大图。图6 外源输入NO3-条件下,液相NO3-、NO2-、NH4+和总氮浓度变化Fig.6 Concentration of NO3-, NO2- , NH4+ and the total nitrogen in liquid phase with the NO3- inputs
矿物相表征结果(图2)表明,外源添加NO3-的情况下,MR-1单一作用实验组中的伊利石并未消失,只有MR-1和有机质共同作用条件下的伊利石被水解;同时该实验组中的Fe(Ⅱ)和碘质量浓度的变化与伊利石的水解情况一致(图5a、c)。说明在外源添加NO3-条件下,微生物会优先利用NO3-作为电子受体,而非Fe(Ⅲ);而当硝酸盐被全部消耗后,微生物可将Fe(Ⅲ)还原为Fe(Ⅱ)。
3 结论
1)伊利石黏土矿物吸附的含铁矿物相是浅层地下水环境中碘的主要搭载介质。周期性灌溉活动可诱发地下水系统中氧化还原环境发生周期性变化。厌氧条件下,外源有机质的输入会促进奥奈达希瓦氏菌MR-1对Fe(Ⅲ)的还原溶解,从而使搭载在铁矿物相中的碘得以释放,从而形成高碘地下水。
2)在外源添加NO3-情况下,浅层沉积物中Fe(Ⅲ)的还原会受到一定的抑制,这是由于微生物会优先利用NO3-作为电子供体而非Fe(Ⅲ)。而当硝酸盐被全部消耗后,微生物可将Fe(Ⅲ)还原为Fe(Ⅱ)。因此人为引入的硝酸盐可在一定程度上抑制沉积物中铁矿物的还原。
