甘肃省定西市马铃薯疮痂病新病原Streptomyces galilaeus的分离、鉴定及生物学特性研究
2018-12-05崔凌霄杨成德魏立娟薛莉张俊莲
崔凌霄 杨成德 魏立娟 薛莉 张俊莲


摘要
对甘肃省定西市安定区的马铃薯疮痂病病原进行了分离、鉴定和生物学特性研究。结果表明,菌株5T-1具有较强致病性,菌落表面呈灰色,有金属光泽,平均直径为4.68 mm,可产生黄褐色素,孢子圆形或圆柱形,孢子丝松散,革兰氏染色呈阳性。5T-1的16S rDNA序列与加利利链霉菌Streptomyces galilaeus菌株的相似度为99%,结合形态特征将菌株5T-1鉴定为Streptomyces galilaeus,为甘肃省新报道病原菌。菌株5T-1生长最适温度为30℃,最适光照条件为全黑暗,最适pH为8.5,最佳碳源和氮源分别为肌醇和天冬氨酸。该研究结果为甘肃省马铃薯疮痂病诊断和综合防治提供了依据。
关键词
马铃薯疮痂病; 病原; 16S rDNA序列分析; 鉴定; 生物学特性
中图分类号:
S 435.32
文献标识码: A
DOI: 10.16688/j.zwbh.2018109
Isolation, identification and biological characterization of Streptomyces galilaeus,
a new pathogen of potato scab in Dingxi City, Gansu Province
CUI Lingxiao YANG Chengde WEI Lijuan XUE Li ZHANG Junlian2
(1. Laboratory of Biocontrol Engineering of Crop Pests and Diseases in Gansu Province, College of
Plant Protection, Gansu Agricultural University, Lanzhou 730070, China; 2. Gansu Key Lab of
Crop Improvement & Germplasm Enhancement, Lanzhou 730070, China)
Abstract
The pathogen of potato scab from Anding District of Dingxi City in Gansu Province was isolated and identified, and its biological characteristics were also determined. The results showed that the strain 5T-1 was highly pathogenic. The colony was gray with a metallic luster and the average diameter of 4.68 mm, which could produce yellow brown pigment. The spores were round or cylindrical and spores silk was loose. Gram staining is positive. The similarity of 16S rDNA sequence of 5T-1 to that of Streptomyces galilaeus was 99%. Combining with the morphological characteristics, the strain 5T-1 was identified as S.galilaeus. It is a newly reported pathogen in Gansu Province. The optimal temperature for strain growth was 30℃. The optimal illumination conditions were darkness and the optimal pH value was 8.5. The best carbon source and nitrogen source were inositol and aspartic acid, respectively. The results provide a basis for the diagnosis and integrated control of potato scab in Gansu Province.
Key words
potato scab; pathogen; 16S rDNA sequence analysis; identification; biological characteristics
马铃薯为继玉米、小麦和水稻之后的世界第四大粮食作物[1],分布广,种植便捷,产量高,是备受人们喜爱的经济作物之一。甘肃省是国内马铃薯种植大省,尤其定西马铃薯更是世界闻名。但是,随着种植面积扩大,重茬严重,致土传病害严重发生,特别是马铃薯疮痂病近年来成为甘肃省定西市薯块主要病害之一。马铃薯疮痂病在世界各地马铃薯种植区普遍发生[2],其在薯块上形成褐色木栓化病斑,发病严重时,病斑成片,严重影响薯块品质和商品性。据报道,引起马铃薯疮痂病的病原为链霉菌,国内外报道的种主要有Streptomyces scabies、S.acidiscabies、S.turgidiscabies、S.europaeiscabiei、S.bobili、S.reticuliscabiei和S.griseus等[2-6],其中S.scabies发现最早,分布最广。我国不同省份报道的疮痂链霉菌存在差异,内蒙古自治区有S.scabies、S.galilaeus和S.bobili[7],甘肅省有S.scabies和S.griseus[8],黑龙江省有S.scabies、S.turgidiscabies和S.acidiscabies[9]。近年来,不断有新的疮痂致病种被发现,说明马铃薯疮痂病致病菌分布复杂且存在多样性,但有关S.galilaeus在甘肃省引起马铃薯疮痂病未见报道,且该种与内蒙古报道的种在生物学特性等方面是否一致也需要进一步证实。因此,本研究对分离自甘肃省定西市安定区马铃薯疮痂病新病原S.galilaeus进行形态观察及16S rDNA鉴定,并对其生物学特性进行了测定,以期为该病害的诊断和综合防治提供依据。
1 材料与方法
1.1 供试材料
供试马铃薯疮痂病病薯采自甘肃省定西市安定区。燕麦琼脂培养基(OMA):燕麦片30 g、琼脂18 g和蒸馏水1 000 mL;胰蛋白胨大豆肉汤培养基(TSB):胰蛋白胨15 g、大豆蛋白胨5 g、氯化钠5 g和蒸馏水1 000 mL;水琼脂培养基(WA):18 g琼脂和蒸馏水1 000 mL。
1.2 试验方法
1.2.1 病原菌的分离和保存
将甘肃省定西市安定区具有马铃薯疮痂病典型症状的病薯用自来水冲洗干净,无菌解剖刀切取带有疮痂病斑的块茎病健交界处5 mm×5 mm×5 mm的小组织块,无菌条件下,用0.1%升汞表面消毒20 s,无菌水冲洗3次,无菌滤纸吸取多余水分,移至燕麦琼脂培养基(OMA)平板上,每皿4块,置于32℃培养箱中培养5 d,挑取组织块周围的菌落划线,置于相同条件下纯化,所得纯化菌株编号,置于4℃冰箱保存备用。
1.2.2 致病性测定
对分离到的菌株采用小薯片法、萝卜片法和离体薯块接种法进行致病性测定,具体方法参考文献[6]进行。
1.2.3 病原菌形态学及生物学特性
病原菌分别接种于OMA平板,于32℃下培养5 d后观察培养性状。对OMA平板上活化培养18~24 h后的病原菌进行革兰氏染色,观察菌体形态,并在显微镜下拍照。将燕麦培养基上32℃培养7 d的病原菌,置于不同温度、光照、pH、碳源和氮源等條件下分别培养,7 d后用十字交叉法测量10个单菌落直径,计算菌落平均直径,用SPSS 19.0软件分析并确定其最佳生长条件。
1.2.4 16S rDNA序列分析
DNA提取:取2 mL在TSB中培养48 h的菌悬液,加入2 mL离心管中,室温12 000 r/min离心1 min,弃上清液,收集菌体。向菌体沉淀中加入200 μL溶菌酶溶液,37℃水浴30 min (每10 min颠倒混匀1次)至混合液澄清,再加入20 μL proteinase K溶液混匀后加220 μL缓冲液GB,振荡15 s,70℃水浴10 min,溶液应变清澈,简短离心以去除管盖内壁水珠,再加入220 μL无水乙醇,充分振荡混匀15 s,再简短离心以去除管盖内壁水珠。将上一步所得溶液和絮状沉淀均加入吸附柱中,12 000 r/min离心30 s,弃废液,将吸附柱放入收集管中,向吸附柱中分别加入500 μL缓冲液GD和600 μL漂洗液PW,每次离心30 s,之后再离心2 min,弃废液,将吸附柱置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液,后将吸附柱转入离心管中,向吸附膜的中间部位悬空滴加100 μL洗脱缓冲液TE,室温放置2~5 min,12 000 r/min离心2 min得到DNA产物,并将其收集到1.5 mL离心管中,置于-20℃保存。
PCR扩增:采用链霉菌16S rDNA通用扩增引物,引物由武汉金开瑞生物工程有限公司合成。引物序列27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR反应体系为25 μL:1492R 2 μL、27F 2 μL、DNA 2 μL、ddH2O 19 μL。 PCR反应条件为:94℃预变性1 min;94℃变性30 s,48℃退火30 s,72℃延伸1 min,30个循环;最后72℃延伸8 min。通过1%琼脂糖凝胶电泳检测PCR产物。
将扩增出的16S rDNA片段送武汉金开瑞生物工程有限公司测序。将所得序列校对后,在NCBI的GenBank中进行BLAST比对,选取与各菌株相似性高的链霉菌菌株的16S rDNA序列,用MEGA 7.0软件中的邻接法构建系统发育树,明确其分类地位。
1.3 数据分析
采用SPSS 19.0、MEGA 7.0和Excel 2010等软件对试验数据进行统计分析,利用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 疮痂病菌的分离和致病性测定
2.1.1 病原菌的分离
将采集的具有疮痂典型症状的马铃薯,按照不同病斑表现症状进行分类编号,平状病斑为P,凸状病斑为T,凹状病斑为A,通过组织分离和划线纯化共分离到20株分离物,依次编号为:3A2-2、3P1-1、3P2-1、3P3-4、4A-7、4A-16、4A-1前、4A-3前、4P-2、4P-3、4P-8、5A-1、5T-1、5P-1、5P-6、5P-7、61-6、62-3、62-4和62-5等。
2.1.2 致病性测定
采用小薯片法和萝卜片法对分离到的20株分离物进行致病性测定,结果表明,菌株5T-1菌饼接种到小薯片和萝卜片上,72 h后,发病率分别为100%和80% (表1),观察到小薯片和萝卜片表面变褐(图1)。采用离体薯块接种法,结果表明菌株5T-1能使薯块发病率达100% (表1),接种处出现明显的褐色病斑(图1),70 d后病斑面积扩大,并且根据柯赫氏法则再次分离到菌株5T-1。以上三种方法证明分离到的菌株5T-1具有致病性,并且对照没有表现出发病症状,说明菌株5T-1为甘肃省马铃薯疮痂病的病原菌。
图1 马铃薯疮痂病菌菌株5T-1的致病性测定
Fig.1 Pathogenicity determination of isolate 5T-1 of potato scab pathogen
表1 马铃薯疮痂病菌菌株5T-1致病性统计
Table 1 Statistics of pathogenicity for the isolate 5T-1 of potato scab pathogen
2.2 病原菌鉴定
2.2.1 形态学特征
菌株5T-1的菌落为圆形,表面呈灰色,有金属光泽,菌落平均直径为4.68 mm,孢子丝松散,孢子圆形或圆柱形。在OMA培养基上菌落灰色,有黄褐色素产生,革兰氏染色呈阳性(图2)。
图2 马铃薯疮痂病菌菌株5T-1形态特征
Fig.2 Morphology of isolate 5T-1 of potato scab pathogen
2.2.2 病原菌16S rDNA序列分析
采用链霉菌16S rDNA通用引物,对已提取菌株5T-1的DNA进行PCR扩增,扩增出16S rDNA片段长度约1 500 bp,并将该16S rDNA扩增产物送武汉金开瑞生物公司测序,测序结果在GenBank数据库中进行BLAST比对,选择同源性大于98%的菌株和已报道的从马铃薯上分离的疮痂链霉菌典型菌株Streptomyces galilaeus(EU8417141)、S.bottropensis(KR476476.1)、S.diastatochromogenes(AB026218.1)、S.turgidiscabies(KU975443.1)、S.griseus(EF192235.1)和S.scabiei(AY207603.1),用ClustalX软件进行多重比较和用MEGA 7.0软件中的邻接法构建系统发育树。结果表明,从甘肃省马铃薯疮痂病薯上分离到的致病菌株5T-1与S.galilaeus(EU841714.1)菌株亲缘关系最近(图3),序列相似度为100%,结合形态学特征,将其鉴定为加利利链霉菌Streptomyces galilaeus。
图3 基于16S rDNA序列构建的马铃薯疮痂病菌系统发育树
Fig.3 Phylogenetic tree of potato scab pathogen on the basis of 16S rDNA sequence
2.3 菌株5T-1生物学特性测定
2.3.1 温度对加利利链霉菌5T-1生长的影响
加利利链霉菌5T-1在温度为30℃条件下培养,7 d后,菌落直径达4.56 mm,显著高于其他温度(P<0.05)(图4),即该菌株最适生长温度为30℃。
图4 温度对加利利链霉菌菌株5T-1生长的影响
Fig.4 Effect of temperature on mycelial growth of
Streptomyces galilaeus isolate 5T-1
2.3.2 光照对加利利链霉菌5T-1生长的影响
加利利链霉菌5T-1在32℃、全黑暗条件下培养,7 d后,菌落直径达5.18 mm,显著高于其他光照条件(P<0.05) (图5),L∥D=12 h∥12 h的光照条件下,其生长状况最差,即该菌最适光照条件为全黑暗。
图5 光照条件对加利利链霉菌菌株5T-1生长的影响
Fig.5 Effect of light condition on mycelial growth of
Streptomyces galilaeus isolate 5T-1
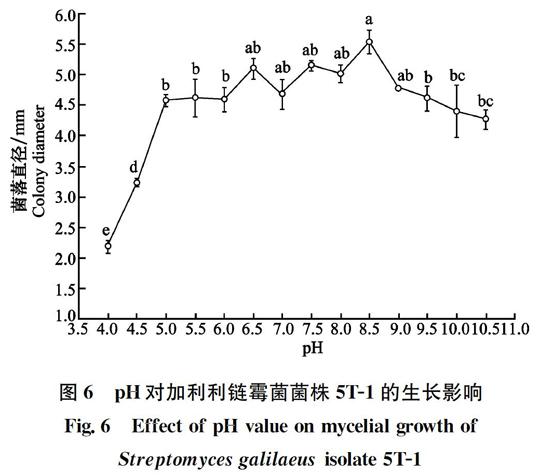
2.3.3 pH对加利利链霉菌5T-1生长的影响
将加利利链霉菌5T-1置于不同pH条件下,32℃培养。结果表明,该菌在pH 4~10.5范围内均可生长,其中pH 6.5~9范圍内生长较好,且显著高于其他pH条件(P<0.05)。7 d后,pH为8.5时该菌菌落直径最大,达5.53 mm (图6)。因此,该菌在偏碱的环境下生长良好,最适生长pH为8.5。
2.3.4 碳源对加利利链霉菌5T-1生长的影响
将加利利链霉菌5T-1置于不同碳源条件下,32℃培养。结果表明,该菌在供试碳源培养基上均可生长,其中在果糖培养基上生长较差,第7天时菌落直径仅为2.93 mm,当碳源为肌醇和甘露醇时,菌落生长速度最快,第7天时菌落直径分别达5.56 mm和4.81 mm,显著高于其他供试碳源(P<0.05),表明该菌可以利用多种碳源,并且最佳碳源为肌醇,其次为甘露醇(图7)。
图6 pH对加利利链霉菌菌株5T-1的生长影响
Fig.6 Effect of pH value on mycelial growth of
Streptomyces galilaeus isolate 5T-1
图7 碳源对加利利链霉菌菌株5T-1生长的影响
Fig.7 Effect of C-source on mycelial growth of Streptomyces galilaeus isolate 5T-1
图8 氮源对加利利链霉菌菌株5T-1生长的影响
Fig.8 Effect of N-source on mycelial growth of
Streptomyces galilaeus isolate 5T-1
2.3.5 氮源对加利利链霉菌5T-1生长的影响
将加利利链霉菌5T-1置于不同氮源条件下,32℃培养。结果表明,该菌在天冬氨酸和组氨酸培养基上生长速度较快,第7 天时菌落直径分别为3.32 mm和2.2 mm,当氮源为蛋氨酸和酪氨酸时,菌落生长速度显著低于天冬氨酸和组氨酸(P<0.05),第7天时菌落直径仅为1.33 mm和1.11 mm,但均可生长,表明该菌可以利用多种氮源,并且最佳氮源为天冬氨酸(图8)。
3 结论与讨论
迄今为止,国内外对马铃薯疮痂病病原研究报道很多,尤其国外研究较为深入,已报道的马铃薯疮痂病病原菌种类有20余种[9],大部分为链霉菌属,其中S.scabies[10],S.acidiscabies[2,11]和S.turgidiscabies[12]分布最为广泛。国内已报道的也有10余种,且存在地理差异,甘肃目前有S.scabies和S.griseus两种病原菌[8]。研究普遍认为链霉菌的种类受种植环境和气候因素影响较大,其分布存在明显的地域性,不同种植区域间病原菌种类不同[13]。本文主要对甘肃省定西市马铃薯疮痂病薯的病原进行分离、致病性测定和鉴定,确定5T-1为致病菌株,并通过形态特征及16S rDNA序列分析,将其鉴定为加利利链霉菌Streptomyces galilaeus,该菌引起甘肃省马铃薯疮痂病为首次报道。
加利利链霉菌5T-1生长的最适温度为30℃,与马铃薯疮痂病在25~30℃温度范围内易发病且发病严重的报道[14]一致。有关马铃薯疮痂病病原光照条件的研究未见报道,本研究结果表明该菌最适光照条件为全黑暗,半光照条件对其生长有一定抑制作用,此与疮痂病发生于土壤中,全黑暗的条件相符。马铃薯疮痂病病菌在不同pH培养基上生长情况存在差异,pH在6~10范围内菌株均可生长,最适生长pH为8.5,与文献报道的链霉菌更适合在碱性条件下生长[13]一致;当pH<5时,该菌生长速度慢。因此,酸性土壤可减轻马铃薯疮痂病的发生。加利利链霉菌5T-1能在含甘露醇的培养基上生长,且生长较好,与已报道的该菌不能利用甘露醇为碳源的结果[15]不一致,其原因可能是与菌株的自身特性及适应性有关。研究表明,该菌可以利用多种碳源和氮源,并且最佳碳源为肌醇和甘露醇,32℃培养7 d后,菌落直径分别达5.56 mm和4.81 mm;最佳氮源为天冬氨酸,32℃培养7 d后,菌落直径为3.32 mm。
本研究仅对甘肃省定西市安定区的马铃薯疮痂病病原进行了研究,有关甘肃省其他地方可能存在的病原还有待进一步研究。
参考文献
[1] HADI M R, BALALI G R. The effect of salicylic acid on the reduction of Rhizoctonia solani damage in the tubers of Marfona potato cultivar [J]. American-Eurasian Journal of Agricultural & Environmental Sciences, 2010, 7(4): 492-496.
[2] LORIA R, BUKHALID R A, FRY B A. Plant pathogenicity in the genus Streptomyces [J].Plant Disease,1997,81:836-846.
[3] PARK D H, YU Y M, KIM J S, et al. Characterization of Streptomycetes causing potato common scab in Korea[J]. Plant Disease, 2003, 87: 1290-1296.
[4] WANNER L A. A survey of genetic variation in Streptomyces isolates causing potato common scab in the United States [J]. Phytopathology, 2006, 96: 1363-1371.
[5] KREUZE J F, SUOMALAINEN S, PAULIN L, et al. Phylogenetic analysis of 16S rRNA genes and PCR analysis of the necl gene from Streptomyces spp. causing common scab, pitted scab, and netted scab in Finland [J].Phytopathology, 1999, 89: 462-469.
[6] 趙伟全,杨文香,李亚宁,等.中国马铃薯疮痂病菌的鉴定[J].中国农业科学,2006,39(2):313-318.
[7] 张萌,赵伟全,于秀梅,等.中国马铃薯疮痂病病原菌16S rDNA的遗传多样性分析[J].中国农业科学,2009,42(2):499-504.
[8] 康蓉,王生荣.甘肃马铃薯疮痂病病原初步鉴定[J].植物保护,2013,39(3):78-82.
[9] 邢莹莹,吕典秋,魏琪,等.黑龙江省部分地区马铃薯疮痂病菌种类及致病性鉴定[J].植物保护,2016,42(1):26-32.
[10] GOYER C, BEAULIEU C. Host range of streptomyces strains causing common scab [J]. Plant Disease, 1997, 81(8): 901-904.
[11] LAMBERT D H, LORIA R. Streptomyces acidiscabies sp. nov.[J]. International Journal of Systematic Bacteriology, 1989, 39(4): 393-396.
[12] MIYAJIMA K, TANAKA F, TAKEUCHI T. Streptomyces turgidiscabies sp. nov. [J]. International Journal of Systematic Bacteriology, 1998, 2(2): 495-502.
[13] 杨梦平,王瑞仙,杜魏甫,等.云南省马铃薯疮痂病致病链霉菌种类组成研究[J].植物病理学报,2018,48(4):445-454.
[14] 李拴曹,李存玲.马铃薯疮痂病的发生与防治[J].陕西农业科学,2016,62(1):76-77.
[15] 张萌,刘伯,于秀梅,等.中国马铃薯疮痂病菌生物学特性分析[J].中国农业科学,2010,43(12):2603-2610.
(责任编辑: 杨明丽)
