早期腹腔穿刺引流对重症急性胰腺炎大鼠腹腔巨噬细胞表型极化的影响
2018-12-03刘若鸿刘春雨张誉凡孙红玉汤礼军
刘若鸿,刘春雨,张誉凡,孙红玉,汤礼军
重症急性胰腺炎(severe acute pancreatitis,SAP)是一种以胰腺局部和全身炎症反应为特征的疾病[1],其病情危重,病死率在30%以上[2]。伴发全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)和多器官功能衰竭(multiple organ dysfunction syndrome,MODS)是SAP患者死亡的重要原因[3]。因此,在病情早期对已经激活的炎症瀑布反应进行有效控制,恢复机体免疫稳态是改善SAP患者预后的关键。SAP患者多伴有胰腺炎相关腹水(pancreatitis associated ascitic fluids,PAAF),研究证实,PAAF内含有多种毒性成分,如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)等炎症因子和脂肪酶、淀粉酶、游离脂肪酸、内毒素等毒性物质,对SAP病程中炎症的发展有重要影响[4-6]。本课题组前期研究发现,通过腹腔穿刺引流(abdominal paracentesis drainage,APD)排出患者腹腔的PAAF,可安全有效地改善SAP病情,降低后续侵入性治疗和疾病重症化的概率[7-9]。同时,动物模型证实,APD能改善肠屏障功能,防止肠道细菌移位[10-12],减轻肾、肺等器官的损伤[13-14]。但APD在SAP早期炎症反应中的具体作用尚不明确。
巨噬细胞作为一种具有高度可塑性的细胞[15],可根据所处微环境的不同在促炎的M1极化表型和抑炎的M2表型之间相互转换[16-18]。研究证实,巨噬细胞在SAP的发生和演进过程中扮演着重要角色,特别是腹腔巨噬细胞能与PAAF发生广泛的相互作用,既能受腹腔环境的影响改变自身的极化表型,又可在腹腔内持续释放炎症因子,改变腹腔内的炎症环境[19-20]。然而APD能否通过改变腹腔环境,增加M2型巨噬细胞比例,进而发挥缓解SAP病情的作用尚不明确。
本研究观察APD大鼠与SAP大鼠胰腺损伤情况、全身炎症反应程度以及腹腔巨噬细胞极化表型和细胞因子表达的差异,探讨APD对腹腔巨噬细胞表型极化的影响,以期为采用APD策略治疗SAP提供理论依据。
1 材料与方法
1.1 材料 健康成年雄性SPF级SD大鼠36只,体重200~250g,购自成都达硕实验动物有限公司。动物麻醉机及动物用异氟烷购自深圳市瑞沃德生命科技有限公司,牛磺胆酸钠购自北京索莱宝科技有限公司,ELIAS试剂盒购自贝塞维斯生物科技有限公司,RNA提取试剂盒购自美国Axygen公司,反转录试剂盒购自中国宝生物工程有限公司,qPCR试剂盒购自美国Bio-Rad公司。引物由上海生工生物工程有限公司设计并合成。
1.2 动物分组及模型制备 36只SD大鼠采用随机数字表法分为SAP组、APD组和假手术对照组(Sham组),每组12只,给予12h昼夜交替光照。大鼠术前12h禁食水,术后禁食,自由饮水。造模前予异氟烷吸入全身麻醉。SAP组和APD组采用文献报道的方法[21],用微量注射泵向胰胆管内逆行注射5%牛磺胆酸钠溶液,用量为0.1ml/100g体重。APD组造模成功后立即于右下腹开孔,置入引流管并外接负压引流球后关腹[11]。Sham组大鼠不注射药物,并在腹腔内置入一段引流管后关腹。各组大鼠于术后在背部皮下按40μl/g用量注射37℃生理盐水补液。大鼠均于造模后12h取材,采用腹腔灌洗法提取巨噬细胞,并采集血液和胰腺组织。腹腔巨噬细胞在提取后分为两份,一份立即用于流式细胞仪分析,另一份提取RNA后用于qPCR检测;血液标本3000r/min离心15min后留取上清,–80℃储存;胰腺组织置于4%多聚甲醛中固定24h后包埋切片。
1.3 胰腺病理组织学分析 沿胰胆管纵行切取固定后的胰腺组织,用石蜡包埋后制成4μm厚切片,常规HE染色后光镜下观察,根据文献报道的评分方法[22],从水肿、坏死、出血、炎细胞浸润4个维度,由2名病理医师进行病理损伤评分,每张切片随机选取5个高倍视野评分后取平均值,结果取各项评分平均值的和。
1.4 ELISA检测 采用ELISA法检测大鼠血清淀粉酶、脂肪酶含量以验证SAP模型是否建立成功,检测血清促炎因子IL-1β、TNF-α和抑炎细胞因子IL-10、转化生长因子β(transforming growth factor β,TGF-β)浓度以分析APD对SAP大鼠全身炎症水平的影响。ELIAS检测的具体步骤严格按说明书进行,采用全自动酶标仪(Thermofisher,美国)进行结果判定。
1.5 细胞提取与流式细胞术分析 大鼠麻醉后,排尽腹水,再按文献[23]报道的方法,向腹腔内注射20ml预冷PBS,按摩腹腔20s后用20ml注射器抽取到抗凝管中静置10min。以PBS洗涤后用Alexa-Fluor647-conjugated anti-CD68(Bio-Rad,美国)、PECY7-conjugated anti-TNF-α(Thermofisher,美国)、FITC-conjugated anti-CD163(Bio-Rad,美国)等荧光一抗进行染色,分别作为巨噬细胞共同表面标志和M1、M2型巨噬细胞特异性标志。以上操作均在冰上完成。使用FACS Calibur(BD Biosciences,美国)流式细胞仪进行检测并用FlowJo (FlowJo,美国)软件分析检测结果。
1.6 腹腔细胞RNA提取与qPCR检测 使用AxyPrep总RNA制备试剂盒。按照说明书所述步骤从洗涤好的上述腹腔细胞中提取总RNA,使用微量核酸仪(NanoDrop Technologies,美国)检测260nm及280nm处的吸收峰并测定浓度,取100ng RNA用反转录试剂盒按说明书方法反转录得到cDNA,并保存在–80℃。
应用SYBR Green Master Mix扩增上述cDNA并分析对应mRNA表达,以GAPDH RNA为内参,GAPDH引物为商品化的大鼠内参基因NAPDH引物(BBI Life Science,中国)。所有样品均设3个复孔。TNF-α、诱导型一氧化氮合酶(iNOS)、CD206、CD163的引物序列见表1。

表1 大鼠目标基因及内参引物序列Tab.1 Target genes and internal reference primers of rats
1.7 统计学处理 采用SPSS 23.0软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 APD对胰腺组织病理损伤及胰腺炎血清指标的影响 HE染色结果显示,建模后12h,SAP组大鼠胰腺组织明显水肿,腺泡细胞广泛空泡化、坏死,腺泡结构严重破坏,胰腺间质内可见大量炎细胞浸润及严重出血,呈严重的组织损伤状态,而APD组大鼠胰腺组织表现为局限性水肿,空泡化和坏死的腺泡细胞明显减少,腺泡组织基本完整,胰腺间质内可见少量红细胞渗出和炎细胞浸润,炎症和组织损伤明显减轻(图1A)。APD组大鼠胰腺组织病理评分为(5.90±0.99)分,明显低于SAP组的(9.70±1.22)分,差异有统计学意义(P<0.05,图1B)。
ELISA检测结果显示,造模成功后,SAP组和APD组的血清淀粉酶浓度分别为(1.302±0.052)ng/ml和(0.906±0.102)ng/ml,脂肪酶浓度分别为(12.251±0.458)U/L和(10.118±1.019)U/L,均高于Sham组的(0.346±0.041)ng/ml和(5.985±0.734)U/L,且SAP组的血清淀粉酶、脂肪酶浓度明显高于APD组,差异均有统计学意义(P<0.05,图1C、D)。
2.2 APD对SAP大鼠全身炎症水平的影响 ELISA检测结果显示,与SAP组比较,APD组大鼠血清促炎因子TNF-α、IL-1β浓度明显降低,而抗炎因子IL-10、TGF-β浓度明显升高,差异均有统计学意义(P<0.05,图2)。
2.3 APD对腹腔巨噬细胞极化表型的影响 选择CD68作为巨噬细胞标志,TNF-α作为M1型巨噬细胞的标志,CD163作为M2型巨噬细胞的标志,应用流式细胞仪对各组大鼠腹腔灌洗液进行检测发现,APD组大鼠腹腔灌洗液中CD163阳性细胞所占比例为26.06%,明显高于SAP组(7.05%),而APD组大鼠腹腔灌洗液中TNF-α阳性细胞所占比例为5.46%,明显低于SAP组(69.4%),差异均有统计学意义(P<0.05),即APD组大鼠腹腔灌洗液中M1型巨噬细胞数量明显减少,M2型巨噬细胞数量明显增加(图3)。
2.4 APD对腹腔细胞炎症因子mRNA表达的影响qPCR检测结果显示,APD组腹腔细胞中M2相关蛋白CD163、CD206的基因表达水平明显高于SAP组(P<0.05),而M1相关蛋白TNF-α、iNOS的基因表达水平各组间差异无统计学意义(P<0.05,图4)。
3 讨 论
由于含有大量毒性物质,PAAF一直以来都被认为在急性胰腺炎的发生发展中发挥了重要作用。大量研究指出,PAAF中含有的脂质代谢产物能通过干预巨噬细胞功能的调控,上调炎症因子的表达,加剧胰腺炎病情[4],PAAF中的血红蛋白能上调HIF/VEGF信号通路,介导炎症反应和肺损伤[24-25],更为重要的是,有研究证实,PAAF能诱导巨噬细胞表达促炎因子,并抑制抑炎信号通路的激活[5]。本课题组在充分体液复苏和营养支持治疗的基础上,建立了早期APD治疗重症急性胰腺炎的策略,在临床和动物模型中证实APD能通过排出PAAF缓解胰腺炎病情[4-11]。此外,还发现APD能抑制SAP过程中的炎症反应,促进胰腺腺泡细胞凋亡[13],并通过降低肠道XDH/XOD的动员,减轻胰腺炎相关性肺损伤[14],通过减少肠道细菌移位,改善肠屏障功能,缓解胰腺炎肠道损伤[11]。然而,APD对SAP早期炎症反应的作用尚未得到阐明。
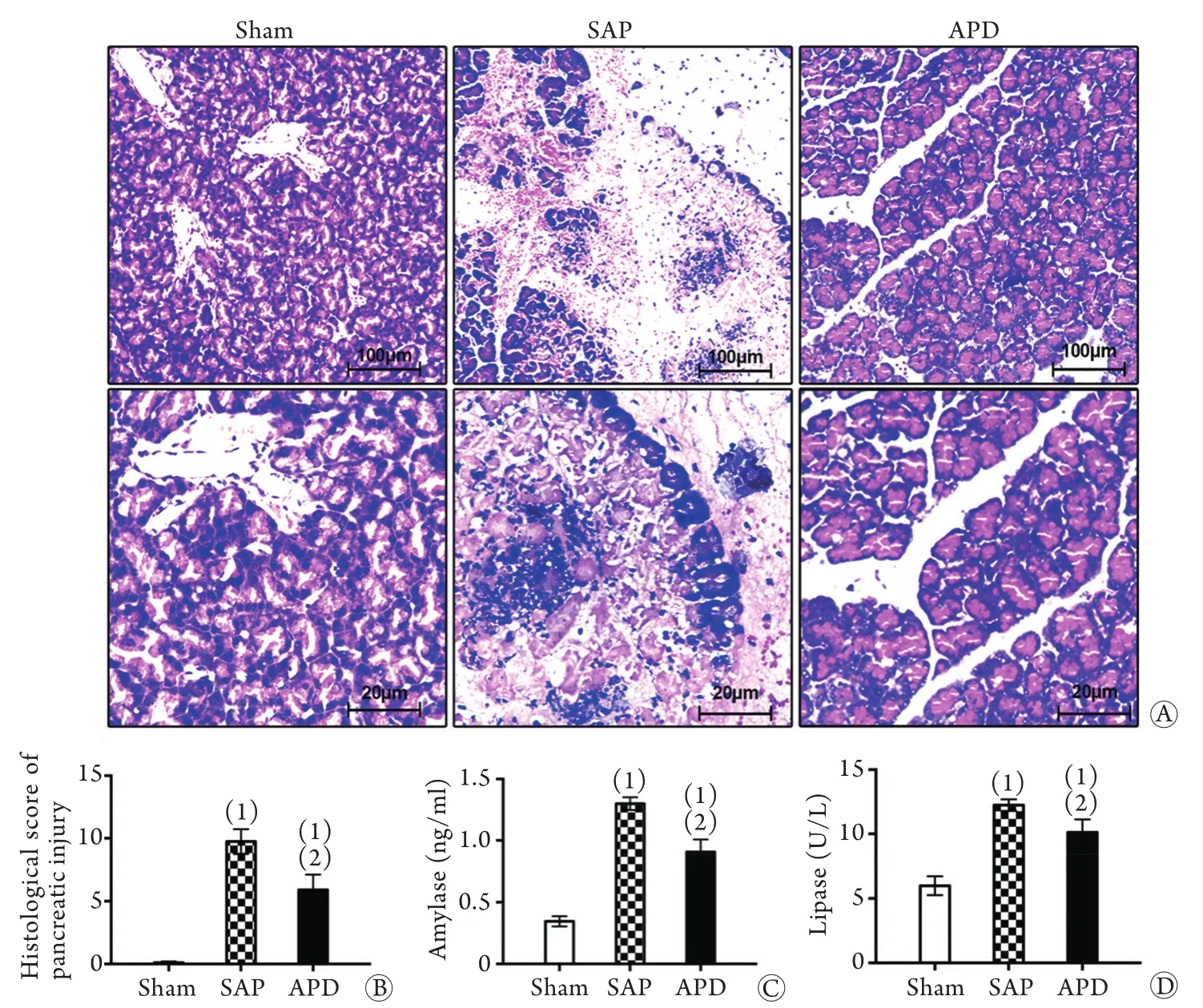
图1 APD对胰腺组织病理损伤及胰腺炎血清指标的影响Fig.1 Effect of APD on histopathological injury of pancreas and the level of pancreatitis biomarker in serum
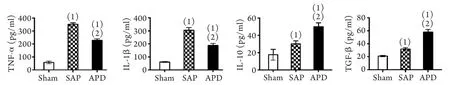
图2 APD对SAP大鼠血清抗炎和促炎细胞因子浓度的影响Fig.2 Effect of APD on the serous contents of anti- and pro- inflammatory cytokines
本研究发现,APD能通过抑制促炎因子及诱导抑炎因子的表达,改善SAP病情。众所周知,IL-10和TGF-β是重要的抑炎因子,其表达上调在炎症消退过程中发挥了重要作用[26-27]。本研究还发现,APD组大鼠血清IL-10和TGF-β浓度明显高于SAP组,且反映SAP严重程度的血清指标血淀粉酶、脂肪酶浓度以及胰腺组织病理损伤评分均明显降低。
为了探讨APD大鼠血清炎症因子表达谱改变的机制,本研究检测了各组大鼠腹腔巨噬细胞表型的差异。腹腔巨噬细胞是腹腔内主要的固有免疫细胞,M1型巨噬细胞通过识别、吞噬、加工抗原,并将加工后的抗原递呈给获得性免疫细胞而引发炎症,同时分泌大量促炎因子,而M2型巨噬细胞能通过多种机制减低抗原呈递,并抑制获得性免疫细胞的激活,分泌抑炎因子而发挥抑炎作用。此外,有研究证实,M1和M2型巨噬细胞能在一定条件下相互转化[17-18,28]。本研究分别以TNF-α和CD163作为M1型和M2型巨噬细胞的标志,并以CD68作为巨噬细胞的共同标志[29],采用流式细胞术检测了两种不同表型腹腔巨噬细胞所占的比例,结果显示,APD组大鼠腹腔CD163阳性巨噬细胞比例明显高于SAP组,这一结果在qPCR实验中也被证实,APD组大鼠腹腔细胞中M2相关蛋白CD163、CD206的基因表达水平明显高于SAP组,表明APD能增加腹腔巨噬细胞中M2型所占的比例。
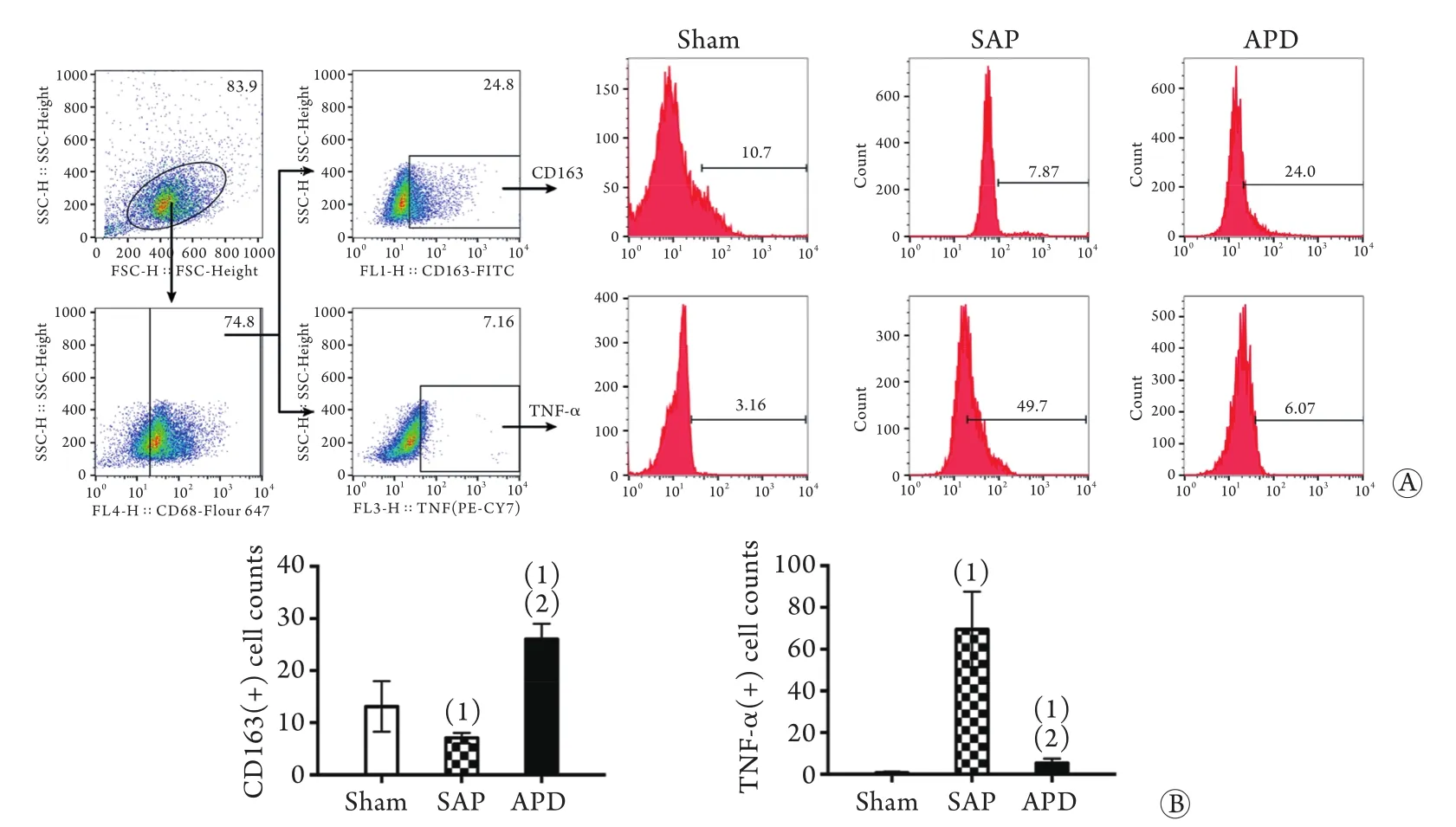
图3 APD对腹腔巨噬细胞极化状态的影响Fig.3 Influence of APD on the polarization of peritoneal macrophages

图4 APD对腹腔细胞M1、M2相关蛋白mRNA表达的影响Fig.4 Effect of APD on the mRNA expression of M1 and M2 associated proteins
此外,本研究发现尽管APD组大鼠腹腔中M1型巨噬细胞少于SAP组,但其M1相关蛋白TNF-α、iNOS的基因表达水平与SAP组比较无明显差异。由于巨噬细胞并不是只存在M1和M2两种表型,而是在这两种表型之间维持动态的平衡。同时,二者细胞因子的表达也是连续转变和相互叠加的[30]。因此,笔者推测部分介于M1和M2两种极化状态之间的巨噬细胞仍在分泌促炎因子,腹腔穿刺操作给APD大鼠造成的额外损伤可能也是其炎症因子分泌增加的原因之一。但是就增长的幅度来看,M2相关蛋白增长的幅度远大于M1相关蛋白,因此仍可认为APD能使SAP大鼠腹腔细胞的炎症状态向抗炎的M2方向倾斜。
虽然本研究未对巨噬细胞表型转变的分子机制进行深入分析,但一项近期研究显示,在早期引流排出PAAF后,胰腺炎大鼠腹水中的IL-1β、IL-6、IL-8和TNF-α等炎症因子水平降低,抗炎因子IL-10水平明显升高[31]。IL-10是巨噬细胞表型调控中的重要细胞因子,Shouval等[26]研究证实,在促M1和促M2两种环境中敲除IL-10受体基因均能促进促炎因子的表达。更为重要的是,在去除M2型巨噬细胞培养基中的IL-10后,M2型巨噬细胞的生物标志物明显降低,表明IL-10在M2型巨噬细胞表型的诱导和维持中是必需的。上述研究表明,通过排出腹腔促炎因子,增加IL-10等抑炎因子的浓度,能营造有利于巨噬细胞向M2方向极化的腹腔炎症环境。此外,腹腔M2型巨噬细胞能否迁移到损伤的胰腺并发挥作用,以及腹腔M2型巨噬细胞分泌的细胞因子能否进入循环发挥抗炎作用仍需进一步研究。
综上所述,本研究结果表明,APD通过排出SAP腹腔内的PAAF,增加腹腔M2型巨噬细胞数量,使其细胞因子表达向抗炎因子方向倾斜,从而发挥降低系统性炎症水平,减轻胰腺病理损伤,缓解SAP病情的作用。
