Fe2+和EDTA对厌氧氨氧化工艺快速启动及菌群特性的影响
2018-11-30唐政坤李军张硕李光蕾李行
唐政坤,李军,张硕,李光蕾,李行
(沈阳建筑大学市政与环境工程学院,沈阳 110168)
引言
厌氧氨氧化菌是一种自养菌,其生长缓慢,世代时间长达11d,生长速率非常慢,只有在高达1010个/mL以上的细胞密度时,才能显现出厌氧氨氧化活性[1]。对于快速实现厌氧氨氧化菌的富集和厌氧氨氧化反应器的启动,国内外大多数研究是通过接种硝化污泥、厌氧污泥或厌氧氨氧化颗粒污泥较快地实现了Anammox的启动,这些研究的缺点是都需要运用到成熟的厌氧菌,而本研究认为快速启动Anammox的关键仍旧在于对环境条件的调控,如果能通过普通活性污泥快速启动此工艺,将减少工艺启动成本,使得Anammox工艺在实际工程应用中具有普适性。
在查阅大量文献后,发现Fe2+很有可能成为厌氧氨氧化反应器启动过程中的缺乏关键元素,其中Van Niftrik等[2]研究表明,厌氧氨氧化体单元内含有丰富的 Fe元素,并且厌氧氨氧化体内还含有大量血红素[3],Fe2+也正是血红素的重要组成物质,同时毛念佳[4]等人直接证明铁离子对厌氧氨氧化菌的富集有促进作用,彭厦[5]在研究金属离子对厌氧氨氧化效能影响时发现,铁离子都可以促进反应器脱氮效率的提高,并且可以刺激Anammox菌的生长并判断亚铁离子很有可能在厌氧氨氧化菌代谢过程中起到了电子供体的作用。然而有实验证明Fe2+随着废水进入反应器中,易与反应器中的磷、钙离子共同作用形成不溶物,不易被厌氧氨氧化菌所吸收利用。另有实验[6]证明Fe(Ⅱ)EDTA能够与NO在水中形成络合物,增加了NO的溶解度,可促进厌氧氨氧化还原NO生成N2。
本文以普通活性污泥为培养对象,利用EDTA与Fe2+形成稳定的螯合物,研究Fe2+和EDTA的添加以及它们的浓度变化对厌氧氨氧化工艺启动快慢的影响,并且在生物特性方面加以鉴定,为快速启动厌氧氨氧化工艺做出理论指导。
1 材料与方法
1.1 实验装置
实验装置采用UASB(上流式厌氧污泥床)反应器(如图1)。UASB反应器总有效体积8.3L、沉淀区有效体积为5.2L、反应区体积为3.1L,活性污泥接种于反应区内。反应区内径7cm,外设2cm厚的套管实现水浴循环,保证反应区微生物所需温度。进水流速通过蠕动泵来调控。装置的运行条件:温度为30℃~35℃,进水pH值为6.8~7.2。

图1 工艺流程及试验装置图
1.2 实验用水与接种污泥
活性污泥取自辽宁抚顺三宝屯污水处理厂的二沉池回流污泥,MLSS为7865mg/L。实验进水模拟生活污水中的主要成分,主要以NH4Cl和NaNO2组成,以NaCO3为碳源,另外添加MgSO4·7H2O、CaCl2、FeSO4·7H2O、KH2PO4和微量元素。表1和表2是具体成分浓度。

表1 厌氧氨氧化反应器配水成分
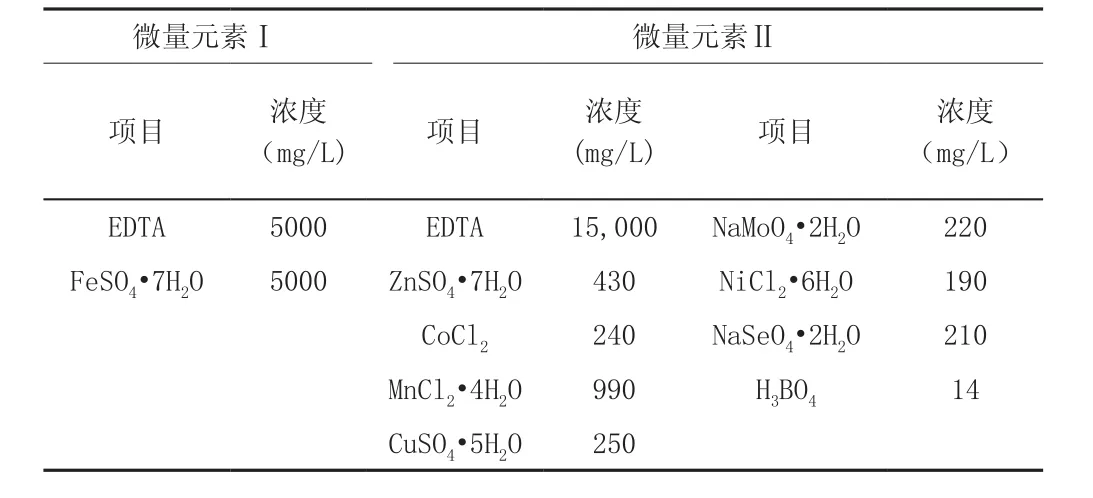
表2 厌氧氨氧化反应器配水微量元素成分
1.3 常规分析项目与检测方法
常规分析项目见表3。颗粒污泥粒径采用湿式筛分法[7],采用的筛子孔径为0.5、0.9、1.5、2、3mm。

表3 常规分析项目与方法
1.4 变性梯度凝胶电泳(DGGE)分析[8]
1.4.1 DNA提取
取2个污泥颗粒样品,样品编号为:1、2;跑胶顺序为:1、1、1、2、2、2。采用FastDNATMSPIN Kit For Soil提取样品基因组DNA,以样品基因组DNA为模板,采用厌氧氨氧化细菌引物[12]Pla46rc和Amx820扩增样品16SrRNA高变区序列见表4。
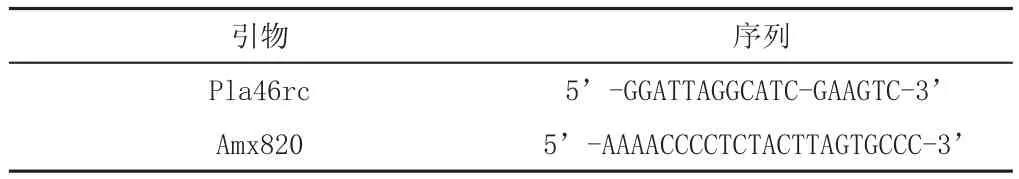
表4 引物信息
1.4.2 PCR扩增
PCR扩增体系(50μL)组成为:10×PCR buffer5μL;dNTP(2.5mM)3.2μL;rTaq(5U/μL)0.4μL;Pla46rc(20μM)1μL;Amx820(20μM)1μL;模板DNA 50ng;补ddH2O至50μL。PCR扩增条件为:94℃、5min;94℃、30s;56℃、45s;72℃、1min、33个循环;72℃、5min。PCR产物采用OMEGA公司DNA Gel Extraction Kit纯化回收。
1.4.3 DGGE分析
取10μLPCR的产物进行变性梯度凝胶电泳(DGGE)分析。电泳条件为:变性梯度10%~30%、浓度8%的聚丙烯酰胺凝胶,电泳缓冲液为1×TAE,电压100V、温度60℃、电泳17小时。变性梯度凝胶电泳(DGGE)完毕后、采用银染法[9]染色,最后完成DGGE图谱中优势条带的回收与测序。
1.4.4 实验方法
表5所示为厌氧氨氧化启动阶段的进水调控策略,先以与生活污水指标接近的低氨氮浓度进行启动。通过逐步提高进水基质浓度和缩短HRT两种方式,提升负荷,加快AAOB的聚集,同时淘洗出其余菌群;为探究Fe2+、EDTA对厌氧氨氧化启动的影响,实验中,在第42天将Fe2+和EDTA浓度分别由0.018mmol/L及0.017mol/L 提升至0.05mmol/L及0.034mol/L,最后进行菌种鉴定。

表5 厌氧氨氧化反应器运行操作条件变化
2 结果与分析
2.1 厌氧氨氧化污泥特性变化
实验分两个阶段:不提升Fe2+和EDTA的浓度(0~42d);提升Fe2+和EDTA的浓度(42d以后)。控制进水NH4+-N和NO2--N负荷在0.05kg/m3·d左右,如图2,开始启动反应器的前4d,出现出水氨氮浓度高于进水的现象,随着时间的推移,NH4+-N和NO2--N的出水浓度逐渐降低。如图3,前14d,NH4+-N去除率维持在6%~10%,在14~42d内一直维持在45%左右;NO2--N去除率呈逐步上升趋势,在反应器启动的前9d,去除率就增至80%左右。分析认为,从污水处理厂取回的污泥在曝气一天预处理后接种于反应器内,突然的缺氧环境对微生物的活性产生了一定的抑制,尤其是一些自养菌没有了有机碳源后,无法适应环境而死亡解体发生氨化现象,释放出了储存在内部的氨氮,使得初期出水氨氮含量略高于进水。启动初期的污泥中含有较为丰富的种群,如硝化细菌、反硝化细菌等,而污泥中残余的有机物正好被反硝化菌利用,并以亚硝态氮为电子受体,发生了发硝化作用,才导致前期亚硝态氮出水浓度一直较低,这些现象与路青等[10]的研究结果一致。图2和图5显示反应器的NH4+-N与NO2--N浓度在启动初期维持较低,相应的TN容积负荷也较低。容积负荷在这个阶段主要维持在0.1~0.12kg/m3·d。在前40d,反应器中的AAOB还没有很好地集聚,整体菌群的活性也较低。因此在较低的容积负荷下,去除负荷也不高,TN维持在0.02~0.03kg/ m3·d,最高也仅达到0.044kg/m3·d,这与图3中较低的去除率相对应。进一步说明初期阶段是微生物对环境的适应期。从14~41d内,NH4+-N和NO2--N去除率在18%~30%之间变化,并且呈现出两者被同时去除的趋势。可以看出,该阶段AAOB正在适应外部环境,没有很好地富集,不是优势菌种。由于前期实验没有对进水箱和反应器进行消氧处理,一定程度上抑制了AAOB的生长活性。
第42d开始用氮气对反应器和进水箱进行消氧处理,满足AAOB所需的绝对厌氧环境。同时,为进一步加快启动过程,提高配水微量元素溶液中Fe2+和EDTA的螯合剂浓度。在实验中,将Fe2+和EDTA浓度分别由0.018mmol/L与0.017mol/L提升至0.05mmol/L与0.034mol/L。由于生物在生长过程中需要的很多蛋白本身含有铁元素,因此可以说铁元素是生物生长代谢中的重要物质[11]。对于厌氧氨氧化菌体内富含血红素[12],并且成熟的AAOB颗粒污泥呈现出的鲜红色,这些足可以判断,足够的铁元素可以加强AAOB的生长,提高Fe2+浓度会加强AAOB的代谢能力。在自然界铁多以氧化物形态存在,经常成为微生物生长代谢的限制因子[13]。在低温厌氧产甲烷的研究中,发现金属离子螯合剂与Ni等微量元素能形成稳定的螯合物[14],从根本上提升了金属元素的溶解度,微生物对于微量元素的利用率也得到提高,由于微量营养元素中的EDTA本身就是良好的金属离子螯合剂,EDTA与Fe2+的螯合作用能够提高Fe2+的溶解性,使得微生物对亚铁离子的利用率提高。
从图3和图5可看出,在采用了多种措施后的第46d开始,反应器效能提升明显,到第57d时,NH4+-N去除率从26%提升至93%左右;NO2--N去除率从26%提升至了98%左右,TN去除负荷从0.03kg/m3·d到0.11kg/m3·d,是未提升Fe2+和EDTA浓度时的3倍。考虑到此阶段TN容积负荷(0.13~0.15kg/m3·d)。可以认为进水基质中的NH4+-N和NO2--N几乎被完全去除。随着菌种对环境的适应以及对环境条件的优化,AAOB活性有了明显提升,反应器效能提升明显。两种主要代谢产物同时被AAOB高效去除,厌氧氨氧化效果明显,这是Anammox启动成功的一个重要标志。从图4的进出水pH值变化角度也能体现出这一点。厌氧氨氧化在反应过程中会消耗氢离子,即表明此反应实际上是产碱反应[15],出水pH值略高于进水也是Anammox启动成功的另一个重要标志,随着驯化的进行,出水pH值与进水pH值变化曲线的“分离”现象愈发明显。在活性增强阶段,出水pH值从7.6提升至8.2左右,Anammox最佳生长pH值为6.7~8.3[16],而本实验pH值7.8~8.4的偏弱碱性环境正是AAOB生长最适宜的范围。综上所述,反应器启动成功。

图2 厌氧氨氧化启动阶段氨氮、亚硝态氮浓度变化
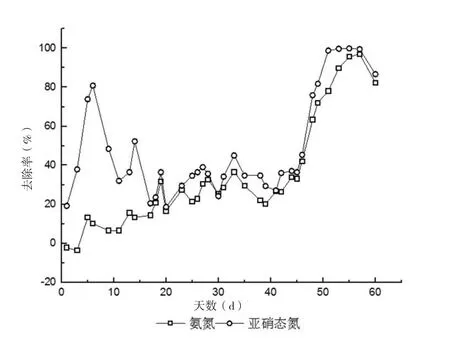
图3 厌氧氨氧化启动阶段氨氮与亚硝态氮去除效能变化
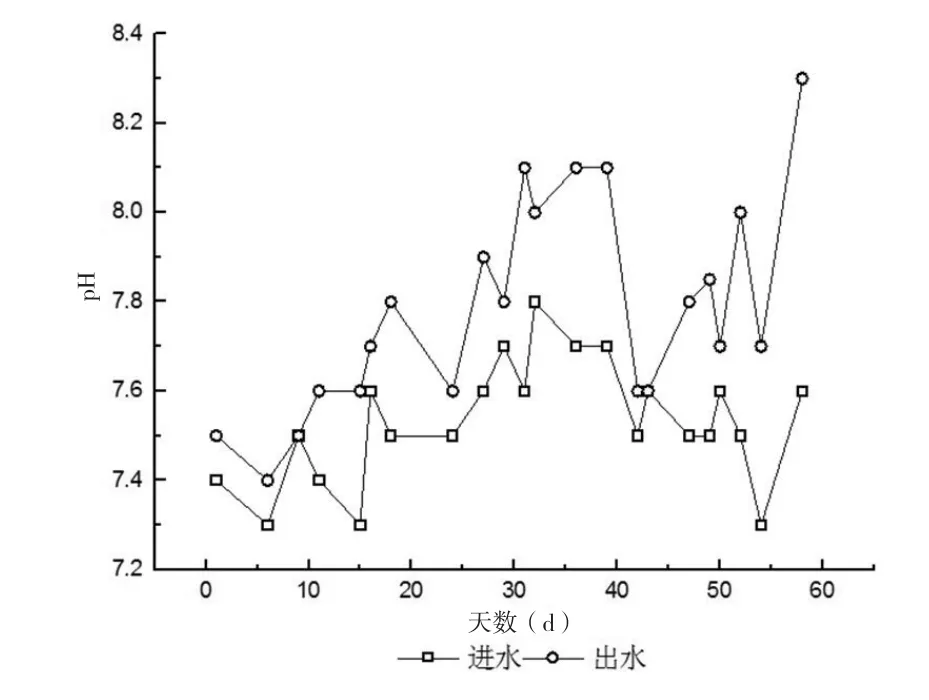
图4 厌氧氨氧化启动阶段进出水pH变化

图5 厌氧氨氧化启动阶段负荷变化
2.2 菌种生物鉴定
为进一步探究Anammox反应器中的生物特性,以Anammox反应器中颗粒污泥作为样本,在反应器污泥底部和顶部同时取样,并分别编号为:1、2;跑胶顺序为:1、1、1、2、2、2。采用PCR-DGGE技术[17]对反应体系进行菌种鉴定。
2.2.1 DNA提取结果
采用FastDNATMSPIN Kit For Soil提取样品基因组DNA,以Pla46rc/Amx820为引物扩增16SrRNA序列,得到目的DNA片段(如图6)用于DGGE分析。
图6 DNA提取图
2.2.2 PCR产物的变性梯度凝胶电泳(DGGE)
样品16SrRNA PCR产物的变性梯度凝胶电泳(DGGE)分析结果如图7。
图7 GC-PCR图

图8 电泳图和量化分析胶图

表6 戴斯系数比较PCR-DGGE图谱的相似性(%)

表7 序列比对分析结果
从图8的电泳图(a)和量化分析胶图(c)中可以看出,分别取自反应器顶部的样品1和底部的样品2,一共出现了10个条带。其中从电泳图(a)可明显看出,在样品1和2中,条带9最为明显清晰,应该是此反应系统中的主要菌群,因此作为主要电泳条带进行回收分析。另外,从量化分析图中可明显观察到,样本1中的9号条带更大也更为清晰;而样本2中出现的条带数更多,说明反应器中的主要菌群即AAOB主要集中在底部,优势菌种占据的生态位明显,而顶部的菌群多样性稍好一些。表6显示着PCR-DGGE图谱具体相关性。主要菌种,说明Anammox菌在逐渐发生着演变,并且最终确定Anammox系统中的菌种为(浮霉菌门)Candidatus Jettenia caeni。该菌种属于Anammox菌群中的Candidatus Jettenia属,被归入浮霉状菌科(Planctomycetes)。该属的Anammox菌是以荷兰微生物学家Mike S. M. Jetten命名的。Candidatus Scalindua多存在于海洋[19、20]。从收录的AnAoB的系统发育树可知,污泥样品中Anammox菌的Brocadia菌属逐渐成为为优势菌属 同时也有anammoxidans菌属和少量的Anammoxoglobus菌属。本实验菌种鉴定所得出的Anammox菌种类较少,主要菌种只有1种,整个反应体系的特异性较强。一方面可以说明,前期的驯化策略有效保证了Anammox菌群的优势地位,不适应系统环境的菌属被淘汰。Kartal[21]等研究表明, 这种细菌能在颗粒团聚体中检测到,不适宜在絮体污泥中生长,并且以往的研究结果[22]表明,在一种特定生境中, Anammox菌多样性较弱,一般占据优势的菌种为单一种属;另一方面,很多研究者初期驯化中都加入了COD,使得反应体系中的异养菌群得以生长,最终得出的微生物种类也就更多。收录的5属8种AnAOB的系统发育关系[18]见图9。
2.2.3 主要电泳条带的序列测定
DGGE凝胶条带回收后,以Pla46rc/Amx820为引物进行PCR扩增,获得目的DNA片段。PCR产物纯化后连接到pMD18-T载体上,转化至DH5α感受态细胞中,筛选阳性克隆测序。
将测序结果与GenBank中的序列进行比对,得到条带所代表的细菌类型。每个回收条带选取3个克隆进行了序列测定,如表7。
从表7可知,在厌氧氨氧化工艺成功启动后,污泥颗粒经过PCR-DGGE实验,相似度99%的菌株为反应器中的
3 结论
(1)在实验第42d,将Fe2+和EDTA浓度分别由0.018mmol/L与0.017mol/L提升至0.05mmol/L与0.034mol/L,配合氮气消氧等措施,经过15d就成功启动了Anammox,脱氮效能高效稳定,NH4+-N与NO2--N去除率稳定在90%以上。
(2)PCR-DGGE技术对系统中的Anammox菌进行了菌种鉴定,最终表明反应器中的AAOB菌为Candidatus Jettenia caeni。该菌种属于Anammox菌群中的Candidatus Jettenia属,被归入浮霉状菌科(Planctomycetes)。
