运用二力平衡原理 解析渗透装置的相关问题
2018-11-29徐宏伟浙江省海亮高级中学浙江绍兴311800
徐宏伟 (浙江省海亮高级中学 浙江绍兴 311800)
1 渗透装置
1.1 渗透
扩散是分子或离子从高浓度处向低浓度处运动的现象。水分子通过膜的扩散称为渗透。通过两者的概念分析,可知渗透要发生需要符合两个条件:①具有一层半透膜;②这层半透膜两侧的溶液具有浓度差。
1.2 渗透装置
演示渗透现象的实验装置简称为渗透装置(图1),一般由球形漏斗、烧杯、半透膜和球形漏斗内外不同的溶液组成。为了使实验现象比较明显,一般情况下溶液a溶质物质的量浓度大于溶液A溶质物质的量浓度(溶剂分子都为水),且溶质分子不能穿过半透膜。故一段时间之后即如图1右侧图像所示,漏斗内液面上升。
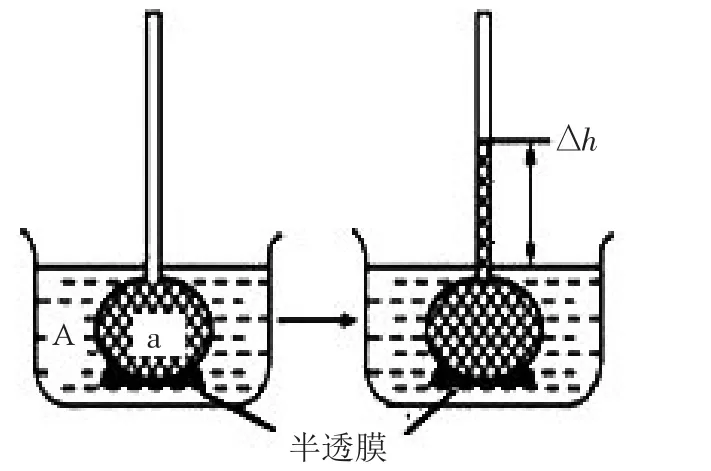
图1 渗透作用示意图
2 渗透装置的力学分析
若从微观上来分析半透膜两侧水分子的进出,学生可以判断出漏斗内液面上升的趋势。但当液面不再发生变化,即达到渗透平衡时,如何来判断内外溶液的溶质物质的量浓度大小,学生就比较难以理解。教师可以以半透膜两侧的液面为对象,进行宏观上的力学分析。在垂直方向上半透膜两侧的液面除了受到相等重力和支持力之外,还受到半透膜两侧溶质的物质的量浓度差产生的渗透压力和由液面高度差产生的静压力。渗透压力促使水分子从溶质物质的量浓度低的一侧跨膜扩散至溶质物质的量浓度高的一侧,静压力则促使水分子从液面高的一侧跨膜扩散至液面低的一侧。
2.1 渗透压力
溶液渗透压,简单的说,是指溶液中溶质微粒对水的吸引力,其本质是一种压强。1886年,荷兰理论化学家范托夫从理论上推导出溶液的渗透压力与溶液浓度和热力学温度的关系为:π=cRT(其中π是渗透压,c为溶质的物质的量浓度,R为气体常数,T为热力学温度)。溶液渗透压力F=πs(s为半透膜面积),将π=cRT代入即得到渗透压力F=cRTs。半透膜两侧渗透压力F的差值与溶质物质的量浓度差相关,简单地表示为FΔc,方向是由溶质物质的量浓度较低一侧指向溶质物质的量浓度较高一侧。
2.2 静压力
静压力F,是由于液面高度差所导致的,其可表示为静压力F=ρghs(ρ为溶液密度,g重力加速度,h液面高度,s为半透膜面积)。半透膜两侧静压力F的差值与液面高度差相关,简单得表示为FΔh,其方向是由液柱高度较高的一侧指向液面较低的一侧。
2.3 液面变化及平衡后浓度差分析
由于溶质分子不能穿过半透膜,开始时溶液a溶质物质的量浓度大于溶液A溶质物质的量浓度,即渗透压力Fa大于FA,即存在FΔc,其方向从溶液A向溶液a,而此时两液面高度差为0,即静压力FΔh=0,所以半透膜两侧水分子只受到了方向向上的渗透压力F的作用。因此水分子总体上表现为从溶质物质的量浓度较低溶液A跨膜扩散至溶质物质的量浓度较高溶液a,从而引起漏斗液面上升。
随着水分子由溶液A不断地跨膜扩散至溶液a,即由烧杯向漏斗扩散,引起烧杯内溶液A溶质物质的量浓度逐渐上升,而漏斗内溶液a溶质物质的量浓度逐渐下降,因而方向向上的渗透压力FΔc逐渐变小。而漏斗内液面的逐渐升高,使得漏斗和烧杯液面高度差逐渐变大,引起方向向下的静压力FΔh逐渐变大,当二力平衡即FΔc=FΔh时,出现理论上的液面静止的渗透平衡现象,即图1右侧图像所示。由FΔc=FΔh很容易分析得到当渗透平衡时,溶液a的溶质物质的量浓度依然大于溶液A的溶质物质的量浓度。
3 例析
图2表示渗透作用装置图,其中半透膜为膀胧膜(蔗糖分子不能通过,水分子可以自由通过)。图中溶液A、B、a、b均为蔗糖溶液,其物质的量浓度分别用MA、MB、Ma、Mb表示,且MA>MB,Ma=Mb>MA。一段时间达到平衡后,甲装置、乙装置液面上升的高度分别为h1、h2,溶液a、b的物质的量浓度分别为M1、M2,则( )
A.hl>h2,M1<M2B.hl<h2,M1=M2
C.hl>h2,Ml>M2D.hl<h2,Ml>M2
解析:由题可知Ma=Mb>MA>MB,即漏斗内蔗糖溶液溶质的物质的量溶度大于烧杯内,且甲装置的溶质物质的量浓度差小于乙装置的溶质物质的量浓度差,即甲装置的FΔc小于乙装置FΔc,所以乙装置漏斗内水分子进入的多,液面上升的高,即hl<h2。达到渗透平衡后,根据FΔc=FΔh,由于甲装置高度差Δh较小,其Δc也较小,即Ma改变较小,同理Mb改变较大,所以Ml>M2。

图2 渗透作用装置图
4 小结
通过力学分析,应用学生较熟悉的二力平衡原理,将原本一个比较抽象的问题具体化,用定量分析的方法,能够让学生很好地理解渗透装置液面变化的原因,并且进行渗透平衡后半透膜两侧溶液溶质的物质的量大小的比较。
