葡萄糖变温红外光谱研究
2018-11-28胡瑞省张之奎董丽华王擘政陈丽云郑雨倩于宏伟
胡瑞省,张之奎,王 欣,董丽华,王擘政,陈丽云,郑雨倩,于宏伟
(1.石家庄学院 化工学院,河北 石家庄 050035;2.石家庄鹏海制药股份有限公司,河北 石家庄 050600)
0 引言
葡萄糖(C6H6O6)是自然界分布最广且最为重要的一种单糖[1-4].葡萄糖在运动医学领域具有重要地位,是活细胞的能量来源和新陈代谢中间产物[5].葡萄糖的热稳定性是科研工作者非常关心的性质,但常规的分析仪器很难研究不同温度下葡萄糖的结构变化.而变温红外光谱技术则可以很好地解决以上问题.变温红外光谱技术广泛应用于有机物热稳定研究工作[6,7],特别是高分子纺织材料的热稳定性研究方面,本课题组在这一方面进行了大量基础性研究[8-10],但葡萄糖的变温红外光谱却未见相关文献报道.因此本研究采用变温红外光谱技术(包括:变温一维红外光谱和变温二阶导数红外光谱)开展了葡萄糖的热稳定性研究,为葡萄糖的使用提供了有益的科学借鉴.
1 实验部分
1.1 材料
葡萄糖(分析纯,天津市永大化学试剂有限公司).
1.2 仪器
Spectrum 100型红外光谱仪(美国 PE公司);Golden Gate型单反射变温附件(英国Specac公司),WEST 6100+型变温控件(英国Specac公司).
1.3 方法
1.3.1 红外光谱仪操作条件
红外光谱以空气为背景,测温范围293~393 K.
1.3.2 红外光谱数据获得
红外光谱(包括:一维及二阶导数红外光谱)的数据获得采用Spectrum v 6.3.5软件.
2 分析与讨论
2.1 葡萄糖变温红外光谱研究
在4 000~600 cm-1频率范围内开展了葡萄糖的变温红外光谱研究[11,12].实验发现,葡萄糖官能团的红外吸收频率主要集中在 3 600~3 000,3 000~2 850,1 800~1 700,1 500~1 300,1 300~1 100,1 100~900,900~600 cm-1等7个频率区间,以下分别在这7个频率区间内开展了葡萄糖变温红外光谱的研究,包括:变温一维红外光谱和变温二阶导数红外光谱的研究.
2.1.1 3 600~3 000 cm-1频率范围内葡萄糖变温红外光谱研究
首先开展了3 600~3 000 cm-1频率范围内葡萄糖变温一维红外光谱的研究,见图1(a).实验在此频率范围内(293 K)发现了一个很大的包峰,主要归属于葡萄糖OH伸缩振动模式(νOH-glucose),随着测定温度的升高,葡萄糖νOH对应的红外吸收强度显著增加.进一步研究了葡萄糖变温二阶导数红外光谱,见图1(b),其谱图分辨能力有了很大的提高,其中3 442 cm-1频率处(293 K)的红外吸收峰归属于葡萄糖中含有结晶水的红外吸收模式(νHOH-glucose),而3 386 cm-1频率处(293 K)的红外吸收峰归属于葡萄糖羟基伸缩振动模式(νOH-1-glucose).而随着测定温度的升高,葡萄糖νHOH-glucose和νOH-1-glucose对应的红外吸收峰消失.实验分别在3 411 cm-1(393 K;νOH-1-anhydrousglucose)和3 402 cm-1(393 K;νOH-2-anhydrousglucose)频率处发现了两个新的红外吸收峰归属于νOH.这主要是因为测定温度的升高,导致葡萄糖中结晶水消失,因此νHOH对应的红外吸收峰消失,而葡萄糖分子间原有的氢键连接模式发生改变,因此νOH对应的红外吸收频率发生改变.
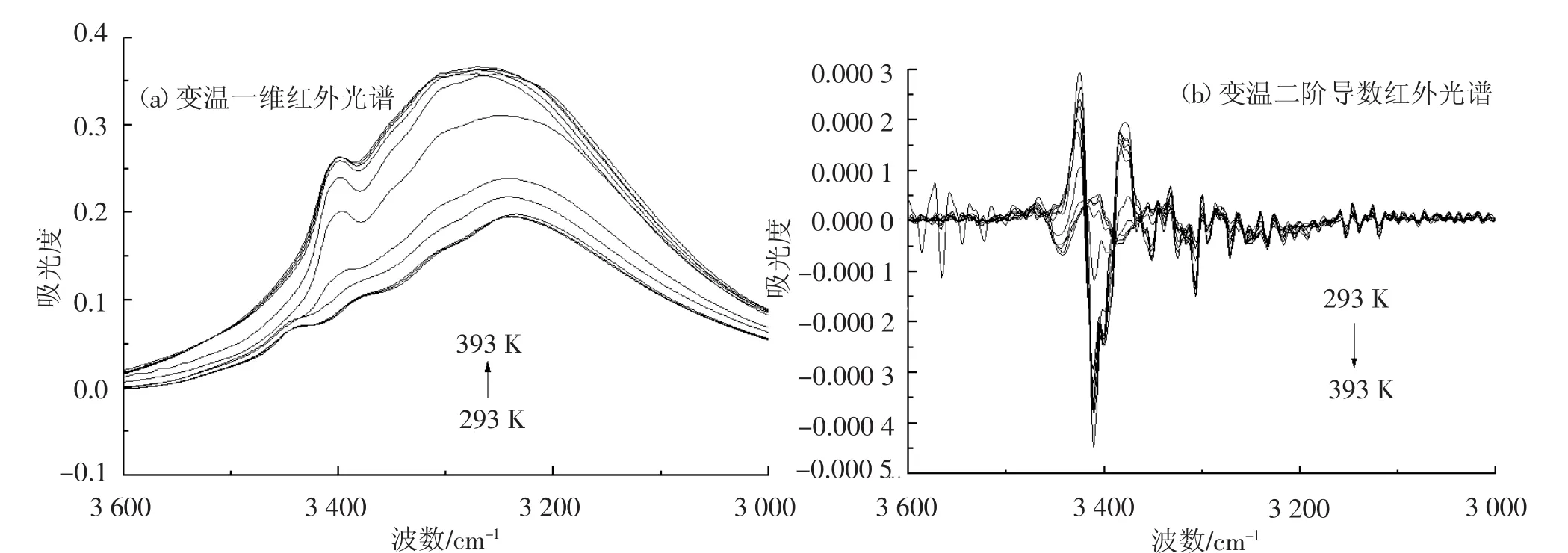
图1 葡萄糖变温红外光谱(3 600~3 000 cm-1)
2.1.2 3 000~2 850 cm-1频率范围内葡萄糖变温红外光谱研究
在3 000~2 850 cm-1频率范围开展了葡萄糖变温一维红外光谱的研究,见图2(a).其中2 937 cm-1频率处(293 K)的红外吸收峰归属于葡萄糖CH2不对称伸缩振动模式(νasCH2-glucose),2 903 cm-1频率处(293 K)的红外吸收峰归属于葡萄糖CH伸缩振动模式(νCH-glucose).随着测定温度的升高,实验在2 943 cm-1和2 913 cm-1频率处发现了两个新的红外吸收峰,这主要是因为随着测定温度的升高,葡萄糖进一步脱去了结晶水,其中2 943 cm-1频率处(393 K)的红外吸收峰归属于无水葡萄糖CH2不对称伸缩振动模式(νasCH2-anhydrousglucose),2 913 cm-1频率处(393 K)的红外吸收峰归属于无水葡萄糖CH伸缩振动模式(νCH-anhydrousglucose),相应的变温二阶导数红外光谱则得到了同样的红外光谱信息,见图2(b).
2.1.3 1 800~1 700 cm-1频率范围内葡萄糖变温红外光谱研究
在1 800~1 700 cm-1频率范围开展了葡萄糖变温一维红外光谱的研究,见图3(a),没有得到有价值的红外光谱信息.而相应的变温二阶导数红外光谱的分辨能力要优于相应的变温一维红外光谱,见图3(b).其中在393 K的条件下,在1 776 cm-1(νC=O-1-gluconicacid),1 752 cm-1(νC=O-2-gluconicacid)和1 736 cm-1(νC=O-3-gluconicacid)频率处发现了3个红外吸收峰,主要归属于不同相态下葡萄糖酸C=O的伸缩振动模式(νC=O-gluconicacid),这主要是因为温度的升高,葡萄糖脱水并进一步氧化为葡萄糖酸.显然葡萄糖热稳定性较差,过高的温度会加速葡萄糖的氧化反应.
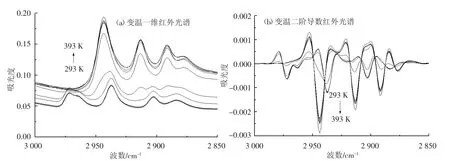
图2 葡萄糖变温红外光谱(3 000~2 850 cm-1)

图3 葡萄糖变温红外光谱(1 800~1 700 cm-1)
2.1.4 1 500~1 300 cm-1频率范围内葡萄糖变温红外光谱研究
在1 500~1 300 cm-1频率范围内,开展了葡萄糖变温红外光谱的研究,见图4.研究发现,葡萄糖的变温二阶导数红外光谱的分辨能力要优于相应的变温一维红外光谱.其中1 423 cm-1频率处(293 K)的红外吸收峰主要归属于葡萄糖CH2弯曲振动模式(δCH2-glucose);1 374 cm-1频率处(293 K)的红外吸收峰主要归属于葡萄糖OCH弯曲振动模式(δOCH-glucose);1 331 cm-1频率处(293 K)的红外吸收峰主要归属于葡萄糖CCH弯曲振动模式(δCCH-glucose);而1 315 cm-1频率处(293 K)的红外吸收峰主要归属于葡萄糖COH弯曲振动模式(δCOH-glucose);而随着测定温度的升高,在1 424,1 379,1 370,1 338,1 329 cm-1频率处发现了5个新的红外吸收峰.其中1 424 cm-1频率处(393 K)的红外吸收峰主要归属于无水葡萄糖CH2弯曲振动模式(δCH2-anhydrousglucose);1 379 cm-1和1 370 cm-1频率处(393 K)的裂分双峰主要归属于无水葡萄糖OCH弯曲振动模式(δOCH-anhydrousglucose);1 338 cm-1和1 329 cm-1频率处(393 K)的裂分双峰主要归属于无水葡萄糖CCH弯曲振动模式(δCCH-anhydrousglucose).研究发现,1 500~1 300 cm-1频率范围内,333 K同样是个临界温度,当测试温度高于333 K时,葡萄糖的特征红外吸收峰频率、峰型及强度均发生了明显的改变.
2.1.5 1 300~1 100 cm-1频率范围内葡萄糖变温红外光谱研究
在1 300~1 100 cm-1频率范围内,开展了葡萄糖变温红外光谱的研究(图5).研究发现葡萄糖的变温二阶导数红外光谱的分辨能力同样要优于相应的变温一维红外光谱.其中1 249 cm-1(δO-C-H-1-glucose)、1 233 cm-1(δO-C-H-2-glucose)、1 209cm-1(δO—C—H-3-glucose)频率处(293 K)的红外吸收峰归属于葡萄糖O—C—H变型振动模式(δO—C—H-glucose);1 155 cm-1频率处(293 K)的红外吸收峰归属于葡萄糖环上 C—O 伸缩振动模式(νC—O-glucose);而1 109 cm-1频率处(293 K)的红外吸收峰归属于葡萄糖COH中C—O的伸缩振动模式(νC—O—COH-glucose).随着测定温度的升高,葡萄糖在1 222,1 201,1 142,1 107 cm-1频率处出现了4个新的红外吸收峰.其中1 222 cm-1(δO—C—H-1-anhydrousglucose)和1 201 cm-1(δO—C—H-2-anhydrousglucose)频率处(393 K)的红外吸收峰归属于无水葡萄糖O—C—H变形振动模式(δO—C—H-anhydrousglucose);1 142 cm-1频率处(393 K)的红外吸收峰归属于无水葡萄糖糖环上 C—O 伸缩振动模式(νC—O-anhydrousglucose);而1 107 cm-1频率处(393 K)的红外吸收峰归属于无水葡萄糖COH中C—O的伸缩振动模式(νC—O—COH-anhydrousglucose).
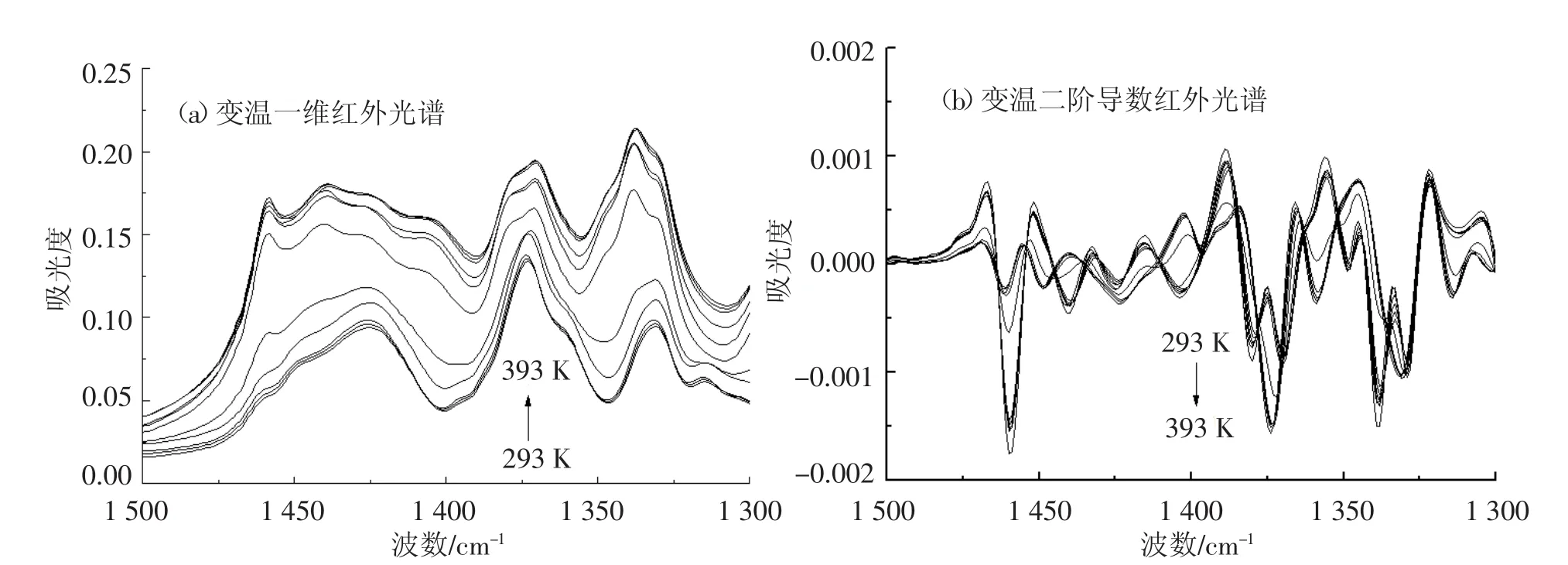
图4 葡萄糖变温红外光谱(1 500~1 300 cm-1)
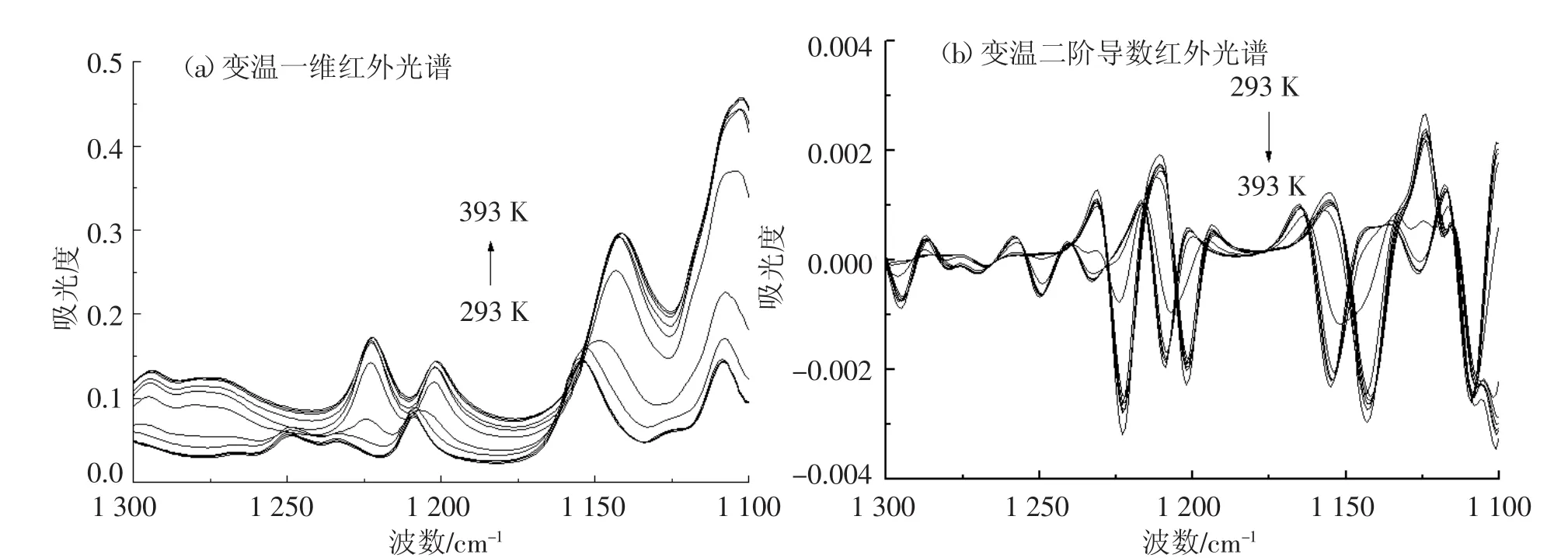
图5 葡萄糖变温红外光谱(1 300~1 100 cm-1)
2.1.6 1 100~900 cm-1频率范围内葡萄糖变温红外光谱研究
在1 100~900 cm-1频率范围内,开展了葡萄糖变温红外光谱的研究(图6).其中,葡萄糖变温二阶导数红外光谱的分辨能力要优于相应的变温一维红外光谱.其中1 093 cm-1(δC—C—HandO-C-H-1-glucose)、1 071 cm-1(δC-C-HandO—C—H-2-glucose)、1 047 cm-1(δC—C—HandO—C—H-3-glucose)频率处(293 K)的红外吸收峰归属于葡萄糖C—C—H和 O—C—H 联合作用的变角振动模式(δC—C—HandO—C—H-glucose);1 010 cm-1频率处(293 K)的红外吸收峰归属于葡萄糖C—O—H变形振动模式(δC—O—H-glucose);而915 cm-1频率处(293 K)的红外吸收峰归属于葡萄糖不对称环振动模式(νas-glucose-bone). 随着测定温度的升高,在 1 100,1 076,1 046,1 012,914 cm-1频率处发现了 5 个新的红外吸收峰,其中1 100 cm-1(δC—C—HandO—C—H-1-anhydrousglucos)、1 076 cm-1(δC—C—HandO—C—H-2-anhydrousglucos)、1 046 cm-1(δC—C—HandO—C—H-3-anhydrousglucos)频率处(393 K)的红外吸收峰归属于无水葡萄糖 C—C—H 和 O—C—H 联合作用的变角振动模式(δC—C—HandO—C—H-anhydrousgluco)s;1 012 cm-1频率处(393K)的红外吸收峰归属于无水葡萄糖C—O—H变形振动模式(δC—O—H-anhydrousgluco)s;而914cm-1频率处(393 K)的红外吸收峰归属于无水葡萄糖不对称环振动模式(νas-anhydrousglucos-bon)e.
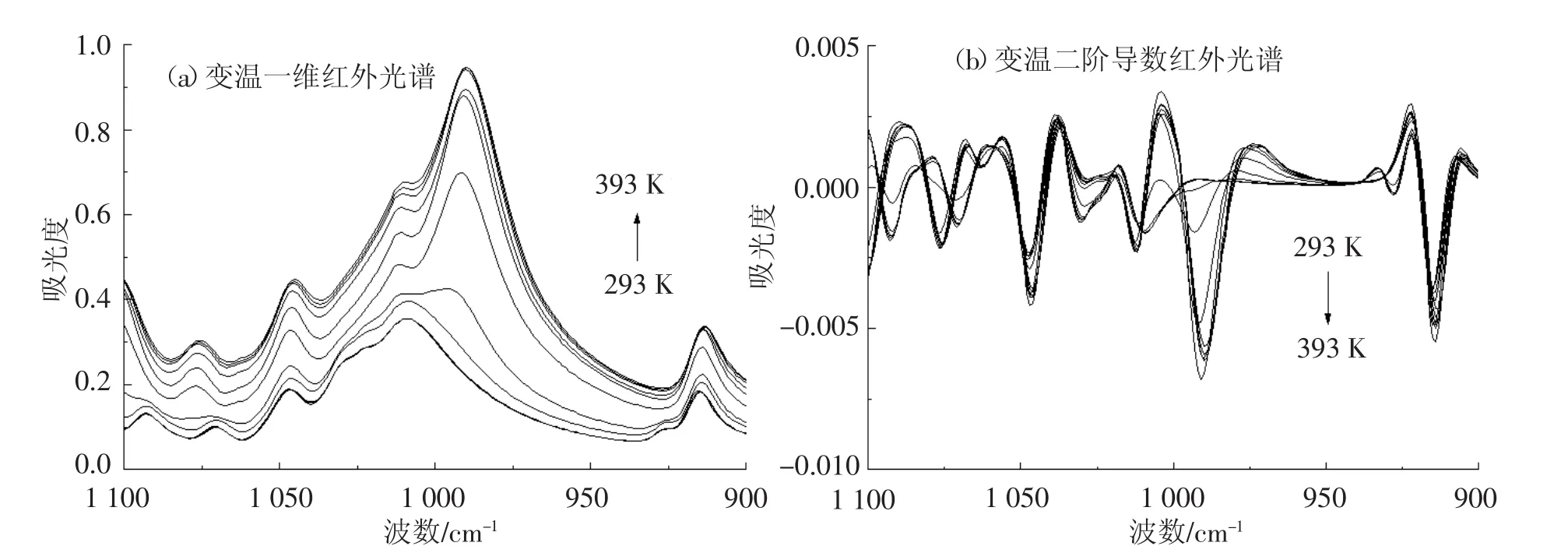
图6 葡萄糖变温红外光谱(1 100~900 cm-1)
2.1.7 900~600 cm-1频率范围内葡萄糖变温红外光谱研究
在900~600 cm-1频率范围内,开展了葡萄糖变温红外光谱的研究(图7),其中851 cm-1频率处(293 K)的红外吸收峰归属于葡萄糖α-端基异构的O—C—H变角振动模式(δO—C—H-glucose);770 cm-1频率处(293 K)的红外吸收峰归属于葡萄糖环的对称伸缩振动模式(νs-glucose-bone);715 cm-1频率处(293 K)的红外吸收峰归属于葡萄糖νC—C和 νC—O联合作用模式(νC—CandC—O-glucose). 随着测定温度的升高,在 837 cm-1和 773 cm-1频率处发现了两个新的红外吸收峰,其中837 cm-1频率处的(393 K)红外吸收峰归属于无水葡萄糖α-端基异构的O—C—H变角振动模式(δO—C—H-anhydrousglucose);773 cm-1频率处(393 K)的红外吸收峰归属于无水葡萄糖糖环的对称伸缩振动模式(νs-anhydrousglucose-bone).进一步研究了葡萄糖变温二阶导数红外光谱,见图7(b),得到了同样的红外光谱信息.
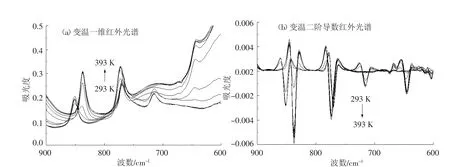
图7 葡萄糖变温红外光谱(900~600 cm-1)
2.2 葡萄糖热变机理
由于葡萄糖变温二阶导数红外光谱的分辨能力要优于相应的变温一维红外光谱,所以在293~393 K的温度范围内重点开展了葡萄糖变温二阶导数红外光谱的研究(表1),以进一步研究葡萄糖热变机理.
由表1数据可知,在293~393 K的温度范围内,随着测定温度的升高,葡萄糖主要官能团对应的红外吸收峰频率、强度及峰形均发生了明显改变,而333 K是一个临界温度.这主要是因为,温度的升高使葡萄糖部分或完全失去结晶水,因此相应的外吸收峰频率、强度及峰型均发生了明显改变.此外,随着测定温度的升高,在1 800~1 700 cm-1的频率范围内,发现了νC=O对应的红外吸收峰.实验则进一步证明,随着测定温度的升高部分葡萄糖脱水生成无水葡萄糖,并进一步氧化为葡萄糖酸.

表1 葡萄糖变温二阶导数红外光谱数据(293~393 K)
3 结论
在293~393 K的测定温度范围内,开展了葡萄糖的变温红外光谱研究.实验发现,葡萄糖主要官能团包括:νHOH-glucose、νOH-1-glucose、νasCH2-glucose、νCH-glucose、δCH2-glucose、δOCH-glucose、δCCH-glucose、δCOH-glucose、δO-C-H-glucose、νC-O-glucose、νC-O-COH-glucose、δC-C-H and O-C-H-glucose、δC-O-H-glucose、νas-glucose-bone、δO-C-H-glucose、νs-glucose-bone、νC-Cand C-O-glucose等红外吸收模式.随着测定温度的升高,葡萄糖主要官能团对应的红外吸收峰频率、强度及峰形均发生了明显改变,而333 K是一个临界变化温度.
