美国猪伪狂犬病监测程序手册(1.3版)—引言、样本收集程序
2018-11-27美国农业部动植物卫生检验局兽医处
文│美国农业部动植物卫生检验局兽医处
译校│张淼洁 张倩 翟新验(中国动物疫病预防控制中心)
一、引言
A 宗旨。本文件概述了伪狂犬病国家监测计划的实施程序。该计划的目标为强化监测,包括快速检测、证明无疫、监控国际或国内的伪狂犬病毒(PRV)来源。
本文件旨在阐明:满足PRV监测目标的必要程序;何时将疑似或潜在的伪狂犬病例提交至AVIC进行调查;什么是高风险的猪群,应在何时采集样本;沟通原则;将样本送至何地;样本实验室检测指南;报告和记录检测样本的必要信息;样本提交指南。
B PRV说明。伪狂犬病也被称为奥耶斯基氏病,是一种在经济上非常重要的猪病,首次出现于20世纪60年代末期。猪群是伪狂犬病病毒(PRV)的首要宿主和储存宿主,因此,猪群也是主要的传染源。除猪以外,感染PRV的其他物种通常会经历剧烈瘙痒,并会在48小时内死亡。有时,在其他物种身上观察到的唯一症状就是猝死。马、鸟类和人类被认为能抵抗PRV感染。
美国农业部(USDA)动植物卫生检验局(APHIS)在20世纪70年代末和80年代初开始执行根除PRV的计划,并于2004年在商业猪中根除了PRV,但是非商业猪和野猪群中仍然存在PRV感染。可在PRV监测计划(附件H)中查阅与病理学、临床症状、传染病学、诊断及PRV监测合理性相关的更多信息。
C 监测计划概览。本计划旨在确定被视为PRV传染高风险的猪群数量和诊断样本。监测目标为能够快速检测到进入商业猪群中的病毒。目标猪群包括:疑似伪狂犬病例的调查和诊断;提交至诊断实验室的病猪组织的抗原检测;提交至诊断实验室的猪病例的随机血清学检测;被定义为高风险猪群的血清学检测;已知同野猪接触猪群的血清学检测;选择性宰杀的屠宰场公猪、母猪的血清学检测;市场动物的肌红蛋白检测;存在PRV的野猪。
上述监测流程支持监测计划的目标。PRV监测计划(附件H)中列出了各个流程。下文列出了与每个采样流程相关程序的一般方法。
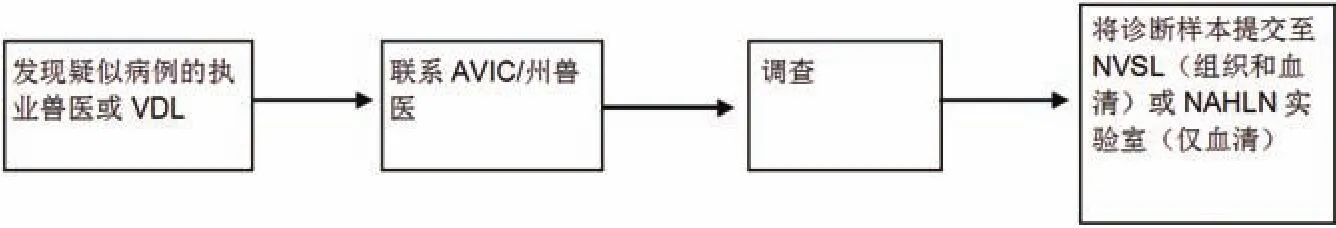
(1)疑似PRV病例的调查与诊断。结合猪群历史、临床症状和诊断信息来完成对PRV感染的诊断。应向AVIC以及州动物卫生官(SAHO)或指定人员报告出现PRV症状的临床病猪。
适合这一类别的疑似猪病例包括:高死亡率(接近100%)并伴随中枢神经系统组织学病变,或很少观察到的与PRV一致的病变;出现呼吸症状、繁殖障碍的母猪;出现呼吸症状的断奶仔猪,伴有中枢神经系统症状或死亡率上升等情况。
符合以上特征的所有猪群应提交至各州的AVIC/SAHO(附件C)。
AVIC或指定人员将决定是否授权进行全面调查。若授权进行调查,且仅从农场采集了血清,需将血清及伪狂犬病监测数据表(附件D)提交至PRV国家动物卫生实验室网络(NAHLN)实验室。若同时采集了血清和组织,将样本提交至国家兽医局实验室(NVSL)进行分析。应在所有样本上粘贴NVSL条形码。关于开展调查的更多信息,请查阅VS Memo 580.4
注:第二部分:详细的样本收集程序中列出了为调查疫病而获取条形码和采集样本的程序(图1)。
◎图1
(2)提交至诊断实验室的病猪组织的检测。本流程中除血清外,其他组织的检测需在检测验证成功后进行。
本流程涉及由执业兽医提交至PRV NAHLN实验室的任何发病猪。当病例满足以下条件时,扁桃体、大脑和肺的样本可用于进行PRV抗原PCR检测(一旦验证),血清可用于PRV血清检测:商业猪或繁殖期出现急性呼吸道症状或神经症状的猪样本;与母猪流产相关的样本。
NAHLN实验室应使用所有检测样本上的NVSL条形码。由于此类样本由执业兽医提交,因此实验室需在样本上粘贴条形码。检测到PRV可疑或阳性PCR结果的NAHLN实验室将样本转寄至NVSL进行确人。检测血清的NAHLN实验室应遵照血液/血清检测程序(附件E)。此外,若接收到非阴性样本,实验室应按照附件G进行通报和响应。
不要求VS或各州人员按照该流程收集样本。此类样本由执业兽医提交至NAHLN实验室。
(3)提交至诊断实验室的猪病例的血清检测。本流程检测执业兽医向PRV NAHLN实验室提交的用于诊断或日常监控疾病(除PRV外)的血清,不包括为了通过PRV血清学检测来确认猪群移动资格或猪群认证而提交的样本。若执业兽医指定进行PRV检测,则该样本不适用于本监测,除非血清符合“提交至诊断实验室的病猪组织的检测”的监测流程。
本流程可包括为进行猪群特征分析而提交的样本,以及来自有临床症状的猪群血清。对于每个养殖场所提交的样本,最多检测5个血清样本。
需要按照计划制定的比率对合格的提交样本进行检测。由于实验室的样本很多,PRV NAHLN实验室需要按照检测配额和规范(附件B)进行检测。实验室将遵照已确定的检测程序(附件E)和通报原则(附件G)。实验室也将在检测过的每个血清样本上粘贴NAHLN条形码。
样本提交信息和检测结果将被记录于PRV实验室登记表(电子表格),并在每月5日提交,或由NAHLN协调员负责校对。若实验室没有需要汇报的数据,则需要向NAHLN协调员汇报没有数据需要报告。将制定一个网页信息采集系统来完善数据输入,并实现数据输入的自动化。
检测样本应能够在空间和时间上代表所有的提交样本。该流程将检测每次提交的不超过五个样本。
(4)被定为高风险猪群的血清检测。AVIC、各州的兽医或指定人员将检查生物安全防护措施,并授权检测可能将PRV从野生宿主转移至商业猪的高风险猪群。本项监测的目标是快速确定商品猪行业中的疾病。因此,进行检测的高风险猪群可能对商品猪行业造成直接影响的猪群。
确定是否为高风险且适合在本监测流程中进行检测的猪群,应考虑以下因素:野猪的集中程度,以及其同设施的接近程度;该设施中的用于直接或间接跨州销售的猪;已购得猪的感染风险;能够接触到野猪的房屋/设施/管理(生物安全措施的有效性)等。
附件B(PRV高风险猪群的监测)中列出了因有大量商业猪群和野猪存在而需要额外重视的县名清单。该清单仅为可能的高风险区域的参考。各州应检测其认为有必要保护的猪群,或迅速找到各州商业猪群中的疾病。
高风险猪群的例子包括:可通往户外,且位于已知野猪群10英里(1英里≈1.609千米)内的商业猪群;在野猪群狩猎俱乐部10英里范围内的商业猪群;提供展览用猪,特别是跨州展览的猪群,且该猪群接触过野猪。
展览用猪的检测不属于高风险检测,不属于本监测计划。曾是野猪的受限制猪群,或同野猪杂交的猪群不属于用于检测的高风险猪群。此类猪群被认为是野猪群的扩大部分。
可通过农场现场检测、市场检测、高风险垃圾饲养检测、小型屠宰场检测或其他必要方法收集高风险猪群的检测样本。若农场现场的取样被确定为最合适的样本收集方法,应采用95/10程序(附件F)检测猪群。可根据设施类型安排高风险猪群的检测时间:可通往户外的猪群每两年进行一次抽样;完全圈养但没有围栏的猪群,或户外饲养但拥有有效围栏的猪群,每五年进行一次检测;完全圈养、拥有适当的生物安全措施(包括有效的围栏)的猪群,则无需检测。
请联系地区传染病学家确定抽样的猪群数量和方法。样本应提交至PRV NAHLN实验室(见附件A)。各州应在提交样本前联系实验室以确定其是否能够检测。
美国农业部农场现场抽样数据表必须同样本一同运送,具体示例参见附件D。送至实验室的样本若无此数据表,则不得用于进行分析。每个提交的样本上必须有独立的条形码。AVIC或指定人员负责记录所需数据。可在以下网站获取当前版本的数据表: http://www.aphis.usda.gov/animal_health/animal_dis_spec/swine/pseu_surv_proced_manual.shtml
(5)报告接触野猪猪群的血清检测。适合该检测程序的猪来自可能跨州移动且接触到或可能接触到野猪的高风险户外商业猪群。本流程依赖于生产者或所有者的自愿报告。若生产者怀疑有野猪入侵,或观察到其猪群中有野猪,可联系相关部门报告野猪入侵。野猪的入侵包括直接接触,或有证据证明野猪同围栏线有接触。
在接到报告后,AVIC、州兽医或指定人员将同各自的地区传染病学家讨论面临的情况,并根据需要确定是否适合进行检测,或加强猪群监控和监测。发现疑似接触后的一段时间后(考虑到血清转阳时间)在农场按照95/10的采样程序现场采集血样,用于血清检测(附件F)。
上文中的“高风险猪群的血清检测”[检测流程(4)]中说明了数据采集方法。在本流程中,应直接观察到或者高度怀疑猪群直接暴露于野猪。若报告暴露,则应就采样方法和样本提交的实验室咨询地区传染病学家。样本应提交至PRV NAHLN实验室进行分析。
须填写PRV农场现场猪检测数据表,并同贴有条形码的样本一起提交至NAHLN实验室。送至实验室的样本若无此数据表,则不得用于分析。
(6)屠宰场选择性宰杀母猪、公猪的血清检测。适合检测的猪为在选定的联邦/州的屠宰场进行选择性宰杀的母猪、公猪。
收集适用于监测的选择性宰杀的母猪-公猪样本,并送至位于堪萨斯州和肯塔基州的USDA实验室。对样本进行分类和监测,确保满足计划标准中现有的监测要求。样本收集减少程序可适用于某些屠宰场。此类程序将根据屠宰场的特定情况而定,并在AVIC的帮助下实施。
(7)屠宰场肉猪肌红蛋白的收集与检测。在选定的屠宰场宰杀的市场猪适用于肌红蛋白检测。使用批准的肌红蛋白检测分析方法来处理和分析从具有代表性的确定批次的市场中收集的猪肉样本。将由VS员工和/或合同人员为本流程收集样本。收集人员将样本送至指定的实验室。
尽快将数据录入到电子数据表中,并在每个季度提交至工作人员进行检查和分析。
(8)野猪的采样。野猪的PRV采样可与传统的猪瘟(CSF)检测计划相关联以提高采样效率。适合进行检测的野猪包括在各州自由生长的野猪,野生动物处(WS)的生物学家在上述各州可进入公共和私有土地捕捉野猪,并对其进行取样。疾病检测通常会同经营活动结合,如开展野猪损害管理;但是,州层面的监测和监控方法可能会根据当地专家的投入而有所不同。
WS为CSF监测计划而收集样本的可同样用于PRV监测,确定是否存在PRV。WS野生动物疾病生物学家为PRV检测收集的样本将按照WS野猪综合疾病监测程序手册提交至由WS管理的实验室,提交用于PRV监测血清的WS人员应填写数据表(附件D),并同样本一起提交。
若样本采集地区此前的野猪检测为阳性,则不再进行检测,WS确定有必要的情况除外。检测应限制在此前为阴性或PRV未知状态的地区样本中,尤其是最近有野猪入侵和/或商业猪生产的地区。WS收集的野猪样本不提交至NVSL进行确认检测。
要求在各自州内进行野猪取样的AVIC应咨询WS。为PRV分析而由除WS外的任何人提交的样本,或通过同WS的合作而提交的样本将不再USDA计划中进行分析。
二、详细的样本收集程序
本节讲述如何在现场收集组织和血液样本。为PRV监测收集的大部分组织样本将由执业兽医提交。
然而,若需要为疑似PRV病例的调查和诊断采集血样或组织样本,应按照PRV监测中组织样本和血液样本收集程序进行。可在本文第IV节中查找提交样本的详细信息。
1.所需工具。从安乐死或死亡的动物(仅为病猪)上采集扁桃体和组织;刀(和/或解剖刀)和剪刀;钳子;塑料取样袋或螺旋顶塑料管;采集血清;离心机(若可能);10~12毫升采血管或真空容器;从猪采集血液所需的针(大小可选);带卢尔锁顶端的注射器;“雷管型”离心管;猪保定装置;组织和血清采集所需的工具;记号笔(防污/防水);圆珠笔;消毒仪器和洗手所需的加热容器或桶;漂白剂(消毒剂);纸巾;冰袋;装污染的个人防护服的垃圾袋;提交样本的邮件包裹。
2.PRV检测所需的组织。若需要收集组织样本,应从以下新鲜组织中采样用于PRV检测:扁桃体;肺;大脑(若可能采集);血液(装满红盖管)。对所有动物采集血液,仅对有临床症状的猪(病猪)收集其他组织。各种组织应存放在独立的袋子或管子中,并贴上计划批准的条形码(若适用),立即冷冻或冷藏。
以下详细信息阐述了如何采集扁桃体样本。仅在VMO调查可能感染PRV的猪群时收集扁桃体,VMO将在进行调查时进行死后检查。其他PRV监测流程不进行扁桃体的收集与检测。
移除扁桃体(死猪)(见图2):

◎图2
(1)将猪以屈膝背卧位放置。
(2)从下巴附近开始,用刀尾部划开皮肤,露出下颌间和邻面颈部的组织。
(3)切割各个下颌骨中间部分的软组织,延长到每侧邻近的下颌联合,切断与舌头的连接处。
(4)切断舌头的连接处,从尾部拉出舌头的顶端,暴露出硬腭和软腭。腭扁桃体,即拥有大的内侧隔核的平两叶结构,位于软腭的尾部(红色箭头)。切割的侧面连接部位(橙色箭头)以防止舌头缩回。应收集整个扁桃体(两叶)。
(5)拉出舌头,进一步暴露扁桃体和喉头盖。注意扁桃体有浅凹的外表,因为上皮细胞内陷形成腺窝。
(6)用剪刀从后部结构的尾部分离扁桃体。
(7)用镊子夹住扁桃体的尾部,用剪刀切下扁桃体伸出的连接部分。
(8)切割扁桃体在软腭上的临近连接部分。现在,扁桃体已经切除并可拿掉。
(9)将扁桃体放置在收集容器中。
(10)在包装运送前擦掉容器表面的污染(血液、排泄物等)。
3.提交至实验室的组织样本(包括血清)的正确标签贴法。动物健康官员收集的样本贴的标签应与CSF等其他疾病计划保持一致。所有样本必须有NVSL提供的独特条形码。

◎图3
使用防污/防水笔和条形码标记每个管子或样本收集容器。每个标签上的内容包括:样本号;管子或容器内的样本类型(组织类型,即扁桃体、肺、肝等);条形码识别标签。
条形码印制为4个独立标签一组。各个样本的条形码互不相同,即便是从同一动物收集的多个样本。
应按照以下方法使用条形码:每个样本管上粘贴一个标签—确保在管子上纵向粘贴条形码;提交表单上粘贴一张标签;应销毁未使用的标签。此前使用过的条形码的重复使用将“混淆”实验室内的自动样本处理程序。所有血清样本必须有独立的条形码(图3):将样本放置在冷却器中或冰袋上。不得冷冻样本;适当处理组织和畜体;将组织/血清送至合适的NAHLN实验室 。
