姜黄素灌胃对动脉粥样硬化大鼠血管内皮损伤的逆转作用及其机制
2018-11-22艾诗媛张英
艾诗媛,张英
(西南医科大学,四川泸州 646000)
动脉粥样硬化(AS)易累及冠状动脉、颈动脉等,由AS所致的心、脑血管不良事件已经成为当前人类的首要死亡原因。大量研究表明,众多致AS的危险因素(如吸烟、高血压、糖尿病、脂代谢紊乱以及血液流变学改变、缺氧、感染等)都能引起炎症及氧化应激并导致内皮损伤与功能障碍,而炎症、氧化应激、血管内皮损伤正是AS的几个显著特征[1]。肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)是常用于反映炎症的指标,丙二醛(MDA)及总抗氧化能力(T-AOC)是反映抗氧化能力及氧化应激损伤程度的指标。血管内皮在维持血管稳态过程中发挥着重要作用,血管内皮不仅是一个屏障更是一个复杂的旁分泌器官,参与调节细胞生长、血管张力、血小板和白细胞与血管壁的相互作用等。内皮损伤可使LDL-C大量沉积于内膜下,LDL-C经氧化修饰成ox-LDL后被单核-巨噬细胞吞噬形成泡沫细胞,从而开启AS过程,还可导致血管舒、缩功能失常并促发血栓形成,从而引发心血管事件。可见,抑制炎症与氧化应激、保持血管内皮完整与功能正常是防治AS的重要措施[2,3]。事实上,与AS斑块一旦形成便难以消退不同,血管内皮损伤与功能障碍是可以完全逆转的。循环中NO含量、内皮细胞数量是常用于反映血管内皮功能及内皮损伤的指标。血红素氧合酶-1(HO-1)是细胞内一种可诱导的抗氧化酶,其过表达可有效拮抗炎症和氧化应激所致的组织与细胞损伤[4]。姜黄素是HO-1的天然诱导剂,能在基因水平诱导HO-1转录与表达[5],但姜黄素能否通过诱导HO-1过表达逆转AS患者血管内皮损伤与功能障碍却鲜见报道。2015年1月~2017年12月,本实验拟在大鼠AS模型上对此进行初步探讨。
1 材料与方法
1.1 材料 健康雄性SD大鼠32只,3月龄,体质量(200±20)g,由西南医科大学动物中心提供,在西南医科大学动物实验室喂养。丙基硫氧嘧啶、胆酸钠及胆固醇购自上海蓝季科技发展有限公司,基础饲料由西南医科大学医学动物中心提供。高脂饲料配制:0.2%丙基硫氧嘧啶、0.5%胆酸钠、3%胆固醇、5%白糖、10%猪油(自制)、81.3%基础饲料。主要试剂:维生素D3注射液及姜黄素购自大连美仑生物技术有限公司,卵清白蛋白干粉、牛血清白蛋白干粉及HO-1蛋白活性的特异性抑制剂锌原卟啉Ⅸ(ZnPPⅨ)购自Sigma公司,硫酸亚铁购自天津市光复科技发展有限公司,TNF-α、IL-6及NO检测试剂盒购自Abcam公司,HO-1免疫组化检测试剂盒购自武汉博士德生物工程有限公司,MDA、T-AOC检测试剂盒购自南京建成生物研究所。CD31抗体购自BD公司。
1.2 实验方法
1.2.1 动物分组及AS模型制备 32只健康雄性SD大鼠给予基础饲料适应性喂养1周后开始造模。大鼠随机均分为对照组、模型组、姜黄素组和姜黄素+ZnPPⅨ组。各组采用3%戊巴比妥钠腹腔注射麻醉,沿颈前正中线切开皮肤,分离右侧颈总动脉并阻断血流后,除对照组外的其余三组大鼠均用液氮冷冻该段血管15 s造成内皮损伤,恢复血流后缝合伤口,给予高脂饲料喂养,并予腹腔注射维生素D3(首次60万IU/kg,之后每周10万IU/kg),同时注射异种蛋白刺激免疫反应(背部皮下注射牛血清白蛋白40 mg/kg,每周3次,共3周;腹腔注射卵清白蛋白2.5 mg/kg,每3天1次,共5次),另在饮水中加入FeSO4(25 mg/100 mL)。对照组仅分离右侧颈总动脉而不予液氮冷冻损伤,持续喂养普通饲料并按其余三组相同的时间及操作方式处理,但所用药物均代之以生理盐水。
1.2.2 药物干预 从造模开始第14周,姜黄素组给予姜黄素100 mg/(kg·d)灌胃,姜黄素+ZnPPⅨ组给予姜黄素100 mg/(kg·d)灌胃及腹腔注射ZnPPⅨ 7.5 mg/kg隔日1次。模型组及对照组给予2 mL生理盐水灌胃和1 mL生理盐水腹腔注射。干预时间共2周。
1.2.3 标本采集 干预结束后,各组大鼠用3%戊巴比妥钠腹腔注射麻醉,经腹主动脉采血检测各项生化指标及循环内皮细胞数量。处死动物取右侧颈总动脉用于HE染色和免疫组化检测HO-1蛋白表达。
1.2.4 颈总动脉组织学观察 所取血管组织按常规操作方法经中性甲醛固定、石蜡包埋、切片、脱水、透明、HE染色,光镜下观察组织学变化。
1.2.5 血清TNF-α、IL-6、T-AOC、MDA、NO水平检测 采用ELISA法检测血清TNF-α、IL-6,比色法检测T-AOC及NO,TAB法检测MDA,操作严格按照相应试剂盒说明书进行。
1.2.6 循环内皮细胞数量测算 采用流式细胞仪检测。取外周血分离单个核细胞,调整细胞密度,吸取适量细胞悬液于1.5 mL EP管中,离心收集细胞,加入100 μL PBS混匀后,加入CD31抗体,吹打混匀,避光孵育30 min后加入500 μL PBS缓冲液洗涤2次,1 200 r/min离心5 min收集细胞,再加入400 μL PBS重悬细胞,上机检测。用CD31阳性细胞占单个核细胞总数的百分比代表循环内皮细胞数量。
1.2.7 血管组织HO-1蛋白表达检测 采用免疫组织化学染色。取各组大鼠右侧颈总动脉,用石蜡包埋,制作切片,常规脱水透明,3% H2O2溶液室温避光10 min灭活内源性过氧化酶,抗原修复液加热修复,冷却后加5% BSA室温静置20 min,滴加HO-1一抗(1∶300)4 ℃过夜。滴加二抗,室温静置20 min,加SABC室温20 min,DAB显色8 min,苏木精染液染色5 min,脱水透明后中性树胶封片保存。光镜下观察,胞质呈棕褐色者为HO-1蛋白表达阳性细胞。采用Image Proplus多媒体彩色病理图像分析软件进行分析,计算每例切片3个不重叠的400倍视野中阳性染色的累积光密度值,以其代表HO-1蛋白相对表达量。
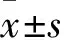
2 结果
2.1 各组颈总动脉病理组织学改变 光镜下HE染色显示,对照组血管内皮光滑完整;中膜可见梭形平滑肌细胞,弹力纤维层结构清晰完整,未见泡沫细胞。模型组动脉壁明显增厚,可见局部管壁向管腔突出,内皮下有大量泡沫细胞聚集;中膜平滑肌细胞增生,排列紊乱。姜黄素组动脉粥样硬化病变明显减轻,内皮覆盖完整。姜黄素+ZnPPⅨ组动脉粥样硬化病变与模型组相似甚至还有所加重。
2.2 各组血清TNF-α、IL-6、MDA、T-AOC水平比较 见表1。
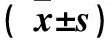
表1 各组血清TNF-α、IL-6、T-AOC、MDA水平比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与姜黄素组比较,ΔP﹤0.05。
2.3 各组血清NO水平及循环内皮细胞数量比较 见表2。
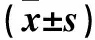
表2 各组血清NO水平及循环内皮细胞数量比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与姜黄素组比较,ΔP﹤0.05。
2.4 各组血管组织内HO-1蛋白表达比较 对照组、模型组、姜黄素组、姜黄素+ZnPPⅨ组血管组织内HO-1蛋白表达分别为11 992.8±701.5、18 333.6±904.4、40 603.2±2 029.1、37 069.8±1 535.3,模型组、姜黄素组、姜黄素+ZnPPⅨ组与对照组相比,姜黄素组、姜黄素+ZnPPⅨ组与模型组相比,P均<0.05。
3 讨论
大鼠常用于制备与人体病变相似的AS模型,但大鼠先天具有较强的抗AS能力,为此,我们对文献报道的多种造模方法[6~8]进行了综合与改良:即在常规高脂饲养基础上加用丙基硫氧嘧啶和维生素D3等药物以减少脂质消耗并促进脂质及钙对血管壁的侵入和沉积,同时用液氮冷冻损伤血管内皮,再结合皮下注射异种蛋白激发免疫性炎症反应并于饮水中加入FeSO4以增加氧化应激等。结果显示:模型组颈动脉管壁增厚,结构紊乱,内皮不完整,其下有大量泡沫细胞堆积,并有淋巴细胞或巨噬细胞浸润,表明AS模型制备成功。本实验中,模型组较对照组血清TNF-α、IL-6、MDA水平明显升高而T-AOC明显降低,且循环内皮细胞数量明显增加以及血清NO水平明显降低,表明模型组大鼠体内存在明显的炎症与氧化应激反应并伴血管内皮细胞显著损伤及功能障碍。这与临床研究[9]显示冠心病患者体内也存在着炎症与氧化应激和血管内皮损伤与功能障碍是相似的。鉴于内皮损伤与AS及相关的心血管不良事件密切相关,探讨有效逆转AS模型大鼠血管内皮损伤与功能障碍的方法对临床防治冠心病具有借鉴意义。
姜黄素是从姜黄属类植物根茎中提取的一种多酚化合物,其药理机制复杂并具有多重细胞保护作用,包括抗炎、抗氧化、抗病毒、抑制AS等[10]。近年发现,姜黄素是HO-1的天然诱导剂,可通过活化核因子相关因子2/抗氧化剂反应元件(Nrf2/ARE)这一特殊的细胞内信号转导途径在基因转录水平诱导HO-1表达[5]。本研究中的姜黄素组、姜黄素+ZnPPⅨ组血管组织内HO-1表达均有显著增加则再次印证了这一点。研究发现,姜黄素的许多药理学作用可能主要是通过诱导HO-1表达介导的[5,11]。本研究结果显示,姜黄素组较模型组血清TNF-α、IL-6、MDA水平明显降低而T-AOC明显升高,对应的循环内皮细胞数量明显减少同时血清NO水平明显升高,表明姜黄素有效地发挥了抗炎、抗氧化及保护血管内皮等作用。但姜黄素+ZnPPⅨ组以同样的方法使用姜黄素,其炎症与氧化应激指标却远高于姜黄素组而与模型组相近,在减轻血管内皮损伤的效果上也明显不如姜黄素组,表明ZnPPⅨ能阻断姜黄素的抗炎症、抗氧化应激与保护血管内皮等作用,由于ZnPPⅨ是HO-1蛋白活性的特异性抑制剂,提示姜黄素的上述作用主要是通过诱导HO-1过表达实现的。
研究发现,HO-1是存在于细胞内的一种可诱导型抗氧化酶,基础表达水平较低,但各种致细胞损伤和应激的理、化因素均可诱导其迅速表达。HO-1蛋白的主要生物学功能是催化细胞内游离血红素降解生成胆红素与一氧化碳(CO)等产物。其中,胆红素是一种细胞内源性强抗氧化剂,能清除多种形式的自由基而发挥抗氧化应激性细胞损伤作用;CO则是与NO类似的又一细胞内气体信号分子,广泛参与扩血管、调节免疫、抑制炎症、调控细胞增殖与凋亡等过程。HO-1/胆红素/CO组成的内源性保护系统在组织细胞应对炎症和氧化应激损伤中不可或缺,合理上调HO-1表达是包括AS在内的许多疾病的防治措施[4,12]。由此推测,胆红素和CO是姜黄素诱导HO-1表达逆转AS血管内皮损伤的主要效应分子。尽管各种损伤性理、化因素所致的氧化应激都有可能引起HO-1适应性表达,但许多病理状态下的HO-1适应性表达水平有限,尚不足以对抗致病因素所造成的损伤[13]。本研究也证实了这一点,即模型组致AS的损伤因素虽然也在一定程度上诱导了HO-1表达,却未能阻止血管内皮损伤及功能障碍,而应用姜黄素高效诱导HO-1过表达则能显著抑制AS大鼠业已升高的炎症与氧化应激水平,逆转受损的血管内皮细胞功能,这一结果为姜黄素在AS性心血管疾病防治中的应用奠定了基础。
