人乳头状瘤病毒少见亚型在宫颈病变患者分布状况的研究
2018-11-20李娇李娜赵静妮李琰清赵思雨刘宇峰李雨薇牛婧王亚文
李娇 李娜 赵静妮 李琰清 赵思雨 刘宇峰 李雨薇 牛婧 王亚文,★
宫颈癌是全世界女性高发癌症,人乳头状瘤病毒(human papillomavirus,HPV)持续性感染是宫颈癌发生的主要病因,约有95%的宫颈癌的发生都与HPV感染有关[1]。中国食品与药品监督管理局(China Food and Drug Administration,CFDA)规定将 13种 HPV 高危亚型(HPV16、18、31、33、35、39、45、51、52、56、58、59、68)和5种HPV中等风险亚型(HPV26、53、66、73、82)为与宫颈癌发生相关的常见亚型,并用于常规宫颈癌筛查方案[2]。常见HPV亚型的检测,在健康女性进行宫颈癌筛查及预防方面已见成效。但在临床工作中,仍有一些宫颈病变患者,应用现有HPV检测方法造成漏诊,引发不良结局。其原因与HPV检测方法的局限性[3]及病变病理类型的特殊性有关[4]。本研究将针对HPV检测亚型的数量和方法的限制因素,对HPV常见亚型检测为阴性的宫颈病变患者行HPV少见亚型的检测,以期了解HPV少见亚型的分布情况,并为疾病病因探索及病程随访提供重要补充。
1 材料与方法
1.1 研究对象
2016年1月至2017年6月在西安交通大学第一附属医院妇科门诊就诊,进行宫颈癌联合筛查女性12 043例。平均年龄(45.81±11.04)岁,年龄范围20~76岁。
1.2 主要仪器与试剂
1.2.1 HPV DNA分型检测
①仪器:ABI 2720 PCR扩增仪(美国应用生物系统公司)、凯普医用核酸分子快速杂交仪(凯普生物化学有限公司)。②试剂:人乳头状瘤病毒(HPV)21分型核酸检测试剂盒、人乳头状瘤病毒(HPV)37分型核酸检测试剂盒(PCR+膜杂交法)(凯普生物化学有限公司)。HPV 21分型可检测,包括13种高危亚型(HPV16、18、31、33、35、39、45、51、52、56、58、59、68);6 种低危亚型(HPV6、11、42、43、44、81)。HPV37分型检测试剂盒在 21种分型的基础上新增了16种少见亚型(HPV26、34、40、54、55、57、61、67、69、70、71、72、73、82、83、84)的检测。
1.2.2 病理学诊断
液基细胞自动制片染色系统(安必平医药科技有限公司)及配套宫颈细胞保存液及巴氏染液。
1.3 检测方法
12 043例女性行HPV 21种分型核酸检测以及新柏氏液基细胞学技术(thinprep cytologic test,TCT)检查,TCT为低级别宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)及以上病变者行阴道镜,取组织进行病理学检查。病理结果确诊为宫颈病变且HPV 21种基因分型结果阴性患者,行HPV 37种基因分型补充检测。
1.3.1 HPV DNA核酸检测及分型
①DNA分离提取:按照DNA分离提取试剂盒说明书进行DNA提取及扩增。②导流杂交:采用核酸分子快速杂交仪及配套试剂盒,按试剂盒说明书进行导流杂交,酶标显色。③结果判读:检测结果为清晰可见的蓝紫色圆点。Biotin对照点和内对照点为阳性,判定结果有效。
1.3.2 宫颈细胞及组织病理检查
根据2014年子宫颈细胞学Bethesda报告系统(the Bethesda System,TBS)诊断标准[5],病理科医生双人对检测结果进行判读,本研究以检测结果为不明意义非典型细胞(atypical squamous cells of undetermined significance,ASCUS)、低度鳞状上皮内病变(low-grade squamous intraepithelial lesions,LSIL)、高度鳞状上皮内病变(high-grade squamous intraepithelial lesions,HSIL)及浸润性宫颈癌(invasive cervical cancer,ICC)患者为研究对象。
1.4 统计学方法
应用SPSS 18.0统计学软件进行数据处理,计数资料采用例数和百分率(%)描述。按照HPV检测方法分为HPV 21分型、HPV 37分型组;按照宫颈病变诊断分为ASCUS、LSIL、HSIL、ICC组。各组间率比较采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 宫颈病变患者的HPV感染分布状况
本研究12 043例行宫颈癌筛查的女性,共筛查出793例宫颈病变患者,其HPV阳性率为74.27%(589/793),各组HPV阳性率分别为ASCUS组 46.23%(43/93);LSIL组 71.13%(138/194);HSIL组 76.41%(217/284);ICC组 86.04%(191/222)各组间阳性率差异具有统计学意义(P=0.001)。对204例HPV 21分型检测阴性的患者行HPV 37分型检测,研究流程及各流程患者HPV感染分布状况如表1所示。
2.2 HPV 37分型在宫颈病变患者的分布状况
本研究204例行HPV 37分型检测的患者,阳性率为22.06%(45/204),HPV 37分型在不同宫颈病变下的检测结果及累积阳性例数与阳性率如表2所示。37分型补充检测使宫颈病变患者HPV总阳性率增加5.67%(45/793),提高至79.95%(634/793)。2种HPV检测结果在各组阳性率分布状况如图1所示。

表1 研究流程及患者HPV感染分布状况(n)Table 1 Study flow and patient flow included in the study(n)
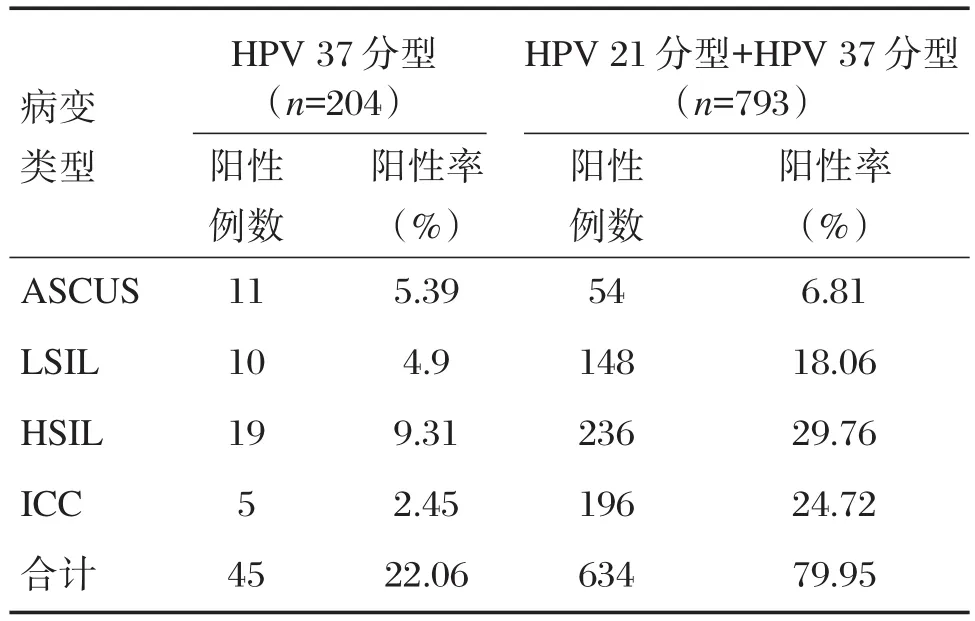
表2 HPV 37种分型基因芯片的检测结果Table 2 Results of 37 types of HPV gene chip tests
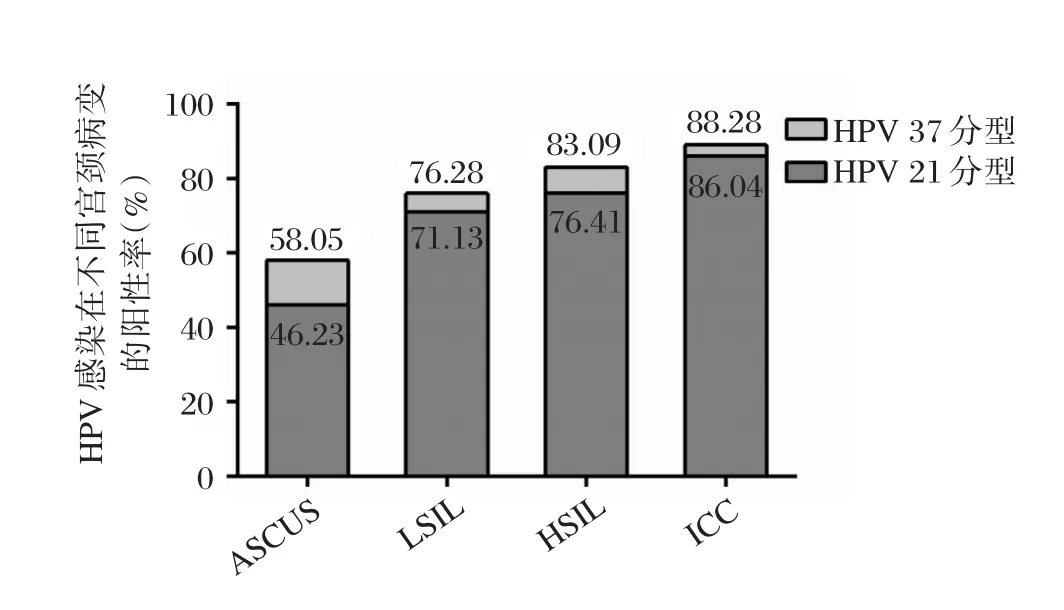
图1 HPV 21分型与HPV 37分型在不同宫颈病变的感染分布状况Figure 1 Distribution of HPV 21 and HPV 37 genotypes in different cervical pathological groups
2.3 少见亚型在宫颈病变的分布情况
45例HPV 37分型检测的阳性样本中,22例为HPV 21分型检测已包含型别,其中单一感染14例,多重感染8例。单一感染以HPV16、52、58、39为主;多重感染中,4例为常见亚型感染,4例为少见亚型和常见亚型混合感染。本研究检测出8种少见亚型,检出率分别为HPV54型,3.43%(7/204);HPV82型,2.45%(5/204);HPV84型,2.45%(5/204);HPV61型,1.96%(4/204);HPV83型,1.47%(3/204);HPV26 型,1.47%(2/204);HPV34型,0.98%(2/204);HPV40型,0.49%(1/204)。其他少见亚型未被发现。各亚型在不同宫颈病变的分布如表3。其中单一感染35例,多重感染10例,多重感染分布状况如表4。
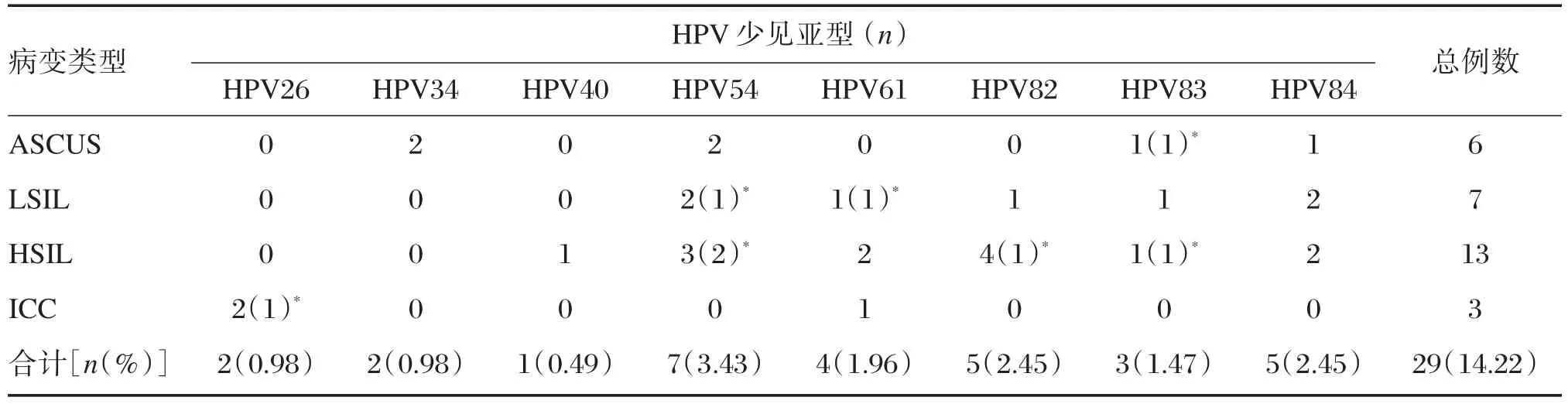
表3 少见亚型在HPV阴性宫颈病变患者的感染分布状况Table 3 Distribution of infection of HPV rare subtype in patients with HPV-negative cervical lesions

表4 不同宫颈病变下HPV多重感染分布状况Table 4 Distribution of multiple infections of HPV in different cervical lesions
3 讨论
本研究在广泛应用HPV 21分型检测进行宫颈癌普遍筛查时,发现部分宫颈癌患者HPV检测结果阴性,其发生率比既往报道多,因此,选用HPV 37分型对HPV 21分型阴性的宫颈病变患者做进一步检查,证实了部分患者漏诊的现状。其原因在于HPV 37分型具有更高的灵敏度,且可以检测出更多HPV亚型。在进行HPV 37分型检测中,仍有22例为HPV 21分型已包括亚型,而在HPV 21分型检测中未检测出来,其原因可能是病毒载量低于HPV 21分型的检测下限,或HPV 21分型检测对于某些亚型的扩增效率略低[6]。HPV 37分型相比普通筛查的型别多,可排除由于检测型别限制造成的假阴性[7]。虽然对人群进行HPV常见亚型的普筛,既可以筛出高风险人群,又可以减少患者由于致病性不高的亚型感染造成的过度恐慌,但对于已经确诊的患者,其HPV检测结果对病因探索、治疗和随访至关重要。
研究发现宫颈癌的发生90%左右都与HPV感染相关[8-9],一项全球流行率研究报告称,13.0%的鳞状细胞癌和28.2%的罕见宫颈腺癌HPV阴性,并估计常规HPV检测可能会漏掉3%~4%的宫颈癌[10]。目前研究已经公认,所有已建立和验证的针对高危型HPV感染的筛查方案,会错过1%~2%与非高危型HPV感染有关的宫颈癌[11]。本研究发现宫颈癌患者有2.45%因为型别限制未被检出,与以上结论相一致,而宫颈癌前病变的患者有5.67%在初筛时未被检出,且具有更高的未检出率。本研究认为对高危型HPV阴性的宫颈病变患者行少见亚型的检测,可以为更多患者提供临床监管的机会,并成为临床鉴别诊断宫颈癌的必要手段。
在对HPV少见亚型分型的研究中,共发现8种少见亚型的感染。与国内外研究相比,罗招云等[6]对285例HPV 21分型未能检出HPV型别者行37分型检测,成功分型251例。Igidbashian等[12]对HPV 37例宫颈癌的患者研究表明,31.1%患者在利用HC2检测高危型HPV为阴性结果,其中包括1例低危型HPV阳性和1例少见亚型HPV69/71阳性。Petry等[13]在 371例宫颈癌患者中发现31例高危型HPV检测结果为阴性,进一步检测发现有少见亚型1例HPV53、1例HPV71及3例HPV73的感染。以上研究表明,HPV“阴性”的宫颈癌中,存在因为检测型别的限制而导致的HPV检测假阴性,各研究检测出的少见亚型型别各不相同,其原因可能与HPV分布的地域特点及HPV少见亚型的感染本就是小概率事件有关,但都证明了宫颈癌患者中存在HPV少见亚型感染。本研究对象为ASCUS及以上病变患者,比单纯宫颈癌患者研究面更广,感染HPV型别种类更多,且多重感染率更高,可以推测HPV少见亚型虽没有HPV高危亚型致癌率高,但仍有一定的致癌性,是宫颈病变发生的原因之一。
本研究仍有159例宫颈病变患者未检出HPV感染,其HPV感染状况以及特殊的发病机制仍需进一步验证。其原因可能与病毒复制缓慢、异常细胞过少或者严重的细胞受损,使病毒载量过低等因素造成的假阴性有关[14]。也可能与特殊病理类型所致非HPV感染所致宫颈癌有关[15]。HPV检测在对疾病病因诊断中仍有局限性,需要临床工作者进一步研究其特殊病理类型的致癌机制。
综上所述,本研究认为HPV“阴性”的宫颈癌可能因为漏诊,而导致的监管和治疗不及时,应该加强对此部分患者检验方法的弥补。另外,是否存在非HPV感染导致的宫颈癌发生的特殊致病机制,尚需要大量流行病学深入研究。对HPV检测结果为阴性的宫颈病变患者进行少见亚型的检测,是对原有方法的有效补充,将对该类患者的病因探索、诊断治疗以及疾病随访提供补充依据。