2个不同番茄品系fasciated基因克隆及表达载体构建
2018-11-20刘爽
刘 爽
(福建农林大学园艺学院,福建福州 350002)
20世纪以来,我国番茄生产中畸形果发生率高达20%以上,特别是冬春季节温室番茄生产中畸形果发生率更高。在大果型番茄品种中,每一花序最先开的花畸形果发生最多,以第一花序畸形果发生率最高,这严重影响番茄的食用品质,且果实畸形,外观品质欠佳,亦影响销售,在生产中造成严重的经济损失[1]。因此,许多科技工作者就如何减少番茄畸形果的发生进行了一系列的研究,目前已经明确了番茄心室数是产生畸形果的主要原因,即心室数越多,果实越大,越易产生畸形果;而随着心室数的减少,果实逐渐变小,畸形果亦降低[2-4]。番茄心室的形成既与其本身的遗传特性有关[2],又与植物生长调节物质、温度、光照、营养等条件有关,各种外界环境均是通过影响番茄本身的遗传基因的表达而对番茄心室形成起作用的[3-5]。
2008年Cong等利用图位克隆的方法成功获得fasciated基因,该基因通过碱基突变或转录水平的变化控制番茄心室的形成,并经过转基因技术验证,确认是主要的控制番茄心室形成的基因[6]。本试验中的2个供试番茄品系是经过多代自交已完全纯合的材料,分别命名为多心室MLK1和少心室FL1番茄,心室数差异明显,但fasciated的序列未知。为了明确该基因在2个供试材料中的序列差异,明确供试番茄材料的心室数差异是否由fasciated序列差异或是转录水平差异引起,同时为了进一步通过该基因的过表达和沉默植株研究其调控机理,进行了本试验。
1 材料与方法
1.1 植物材料、菌种和质粒
1.1.1 植物材料 试验材料:少心室番茄品系FL1(心室 2~3个),多心室番茄品系MLK1(心室15个左右),由笔者所在实验室经多代自交获得,二者心室数及果实大小差异明显。
1.1.2 入门克隆载体 pENTR/D-TOPO®、卡那霉素抗性、pCR®8/GW/TOPO®、壮观霉素抗性,统一购自美国英杰(Invitrogen)生命技术有限公司。
1.1.3 植物表达载体 pMDC141(超量表达载体)和pB7GWIWG2(Ⅰ)(RNAi载体),分别以抗潮霉素hyg基因和抗除草剂bar基因作为筛选标记,2个载体均由笔者所在实验室保存备用。
1.1.4 菌种 pGEM-T载体及大肠杆菌Escherichiacoli感受态细胞购自北京天根生化科技有限公司。
1.1.5 主要试剂 琼脂糖凝胶回收试剂盒及质粒小提试剂盒、Gateway LR Clonase Enzyme MixⅡ购自Invitrogen公司。限制性内切酶、rTaqDNA聚合酶、LATaqDNA聚合酶以及PrimerSTAR HS聚合酶和dNTP购自大连宝生物工程有限公司。M-MLV RT及RNase抑制剂购自普洛麦格(Promega)公司。其他常规试剂采用进口分装或国产分析纯。
1.2 试验方法
1.2.1 2种不同番茄品系FL1和MLK1中fasciated的扩增 根据Genebank中fasciated的序列EU557674(783 bp),用Primer 5.0跨基因特异序列进行引物设计,由Invitrogen公司合成。引物序列如表1所示。
提取幼嫩番茄叶片总RNA,经过逆转录PCR后用fas-f-1、fas-f-1′分别扩增FL1、MLK1番茄中的fasciated基因序列(包括全部的编码序列),切胶回收后连入pENTR/D-TOPO®载体中,挑取单克隆,由Invitrogen公司进行测序后,进行序列比对。

表1 本试验所使用的引物序列
1.2.2 入门克隆建立及植物表达载体的构建 本试验采用GATEWAY技术构建植物表达载体。首先,利用引物fas-f-1、fas-f-1′分别扩增FL1、MLK1番茄中的fasciated基因,经过胶回收后将该片段分别连接到pCR®8/GW/TOPO®和pENTR/D-TOPO®入门克隆载体中,用通用引物M13+测序验证序列及连入方向的正确,通过LR反应将该基因片段最终置换到表达载体中,再通过酶切及测序的方式验证正确后将其通过电转的方法转化到农杆菌感受态细胞中去,-80 ℃保存待用。
1.2.3 LR克隆及热激法转化大肠杆菌 (1)于室温添加LR克隆反应体系(入门载体(PENTR质粒DNA)100 ng,目的载体(质粒DNA)150 ng,加ddH2O至终体积8 μL)至PCR管内。(2)将LR ClonaseⅡ置于冰上,每个样品加2 μL,柔和混匀(勿抽打)后于25 ℃反应1~48 h。(3)每个样品加1 μL Proteinase K(蛋白酶K),柔和混匀(勿抽打)后于37 ℃反应10 min。(4)取2 μL LR克隆反应物加入大肠杆菌E.coli感受态细胞,置于冰上5~30 min。(5)42 ℃热击90 s,置于冰上2~3 min,加入500 μL无抗生素的LB液体培养基。(6)37 ℃,100~150 r/min振荡培养1 h。(7)4 000 r/min低速离心1 min,取200 μL涂布于含有 100 mg/L 表达载体抗性的LB平板,37 ℃过夜培养。
2 结果与分析
2.1 2个不同番茄品系FL1和MLK1中fasciated的扩增
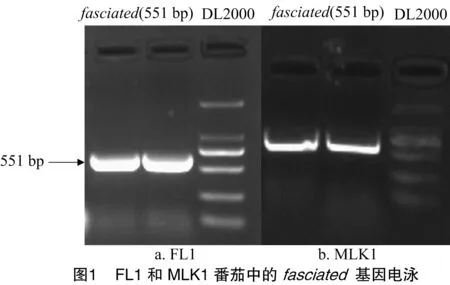
取两叶一心时期的多心室和少心室番茄茎尖生长点,提取RNA,反转录为cDNA,用于fasciated扩增,扩增的片段包括fasciated的全部编码序列(34~567 bp),长为551 bp,如图1所示。
2.2 2个不同番茄品系FL1和MLK1中fasciated序列比对
用DNAman进行序列比对,结果如图2所示,2个不同番茄品系中fasciated基因的编码序列完全一致。
2.3 2个不同番茄品系FL1和MLK1中fasciated表达载体构建的酶切检测
首先用特异性引物对LR反应的单克隆质粒DNA进行PCR检测,初步验证fasciated片段整合进入目的载体。然后对RNAi载体通过限制性内切酶酶切验证fasciated片段整合的正确性,特别是RNAi载体中的发夹结构。对超表达载体笔者直接进行了测序并进行序列的比对,测出的序列中带有部分载体序列(attB序列),以确保插入序列的完全正确性。
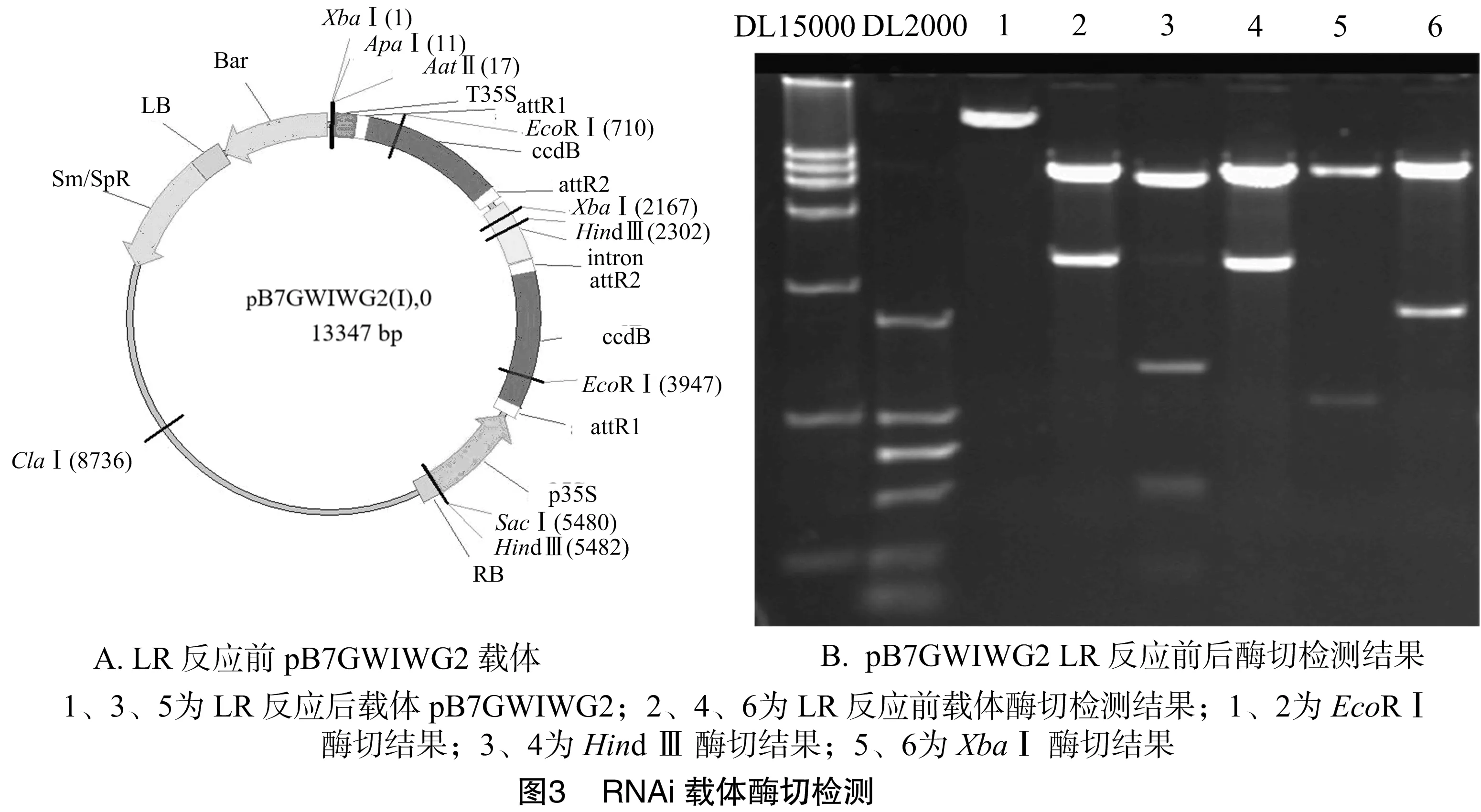
笔者选用了3种酶对构建的RNAi载体进行酶切验证,分别是EcoRⅠ、Hind Ⅲ、XbaⅠ,如图3-A所示,用EcoRⅠ、Hind Ⅲ、XbaⅠ3种酶切LR反应前的载体pB7GWIWG2分别能切出3 237、3 180、2 167 bp的片段;LR反应之后的载体用Hind Ⅲ酶切可以切出196 bp的片段以及另外2个大小的片段,这3个片段总长为2 148 bp,因为本连入片段分别在293、488 bp有该酶的酶切位点,XbaⅠ可以切出 584 bp+fas(551 bp)长度的片段,而EcoRⅠ酶切位点位于ccdB基因上,因此LR反应后不能切出片段。
对于超表达载体的构建,采用序列比对检测,测序得到的序列中包括了完整的PCR产物片段(551 bp),并且测得attB2的互补序列,说明载体构建准确无误,可以用于下一步的试验(图4)。
2.4 2个不同番茄品系FL1和MLK1中fasciated表达载体PCR检测
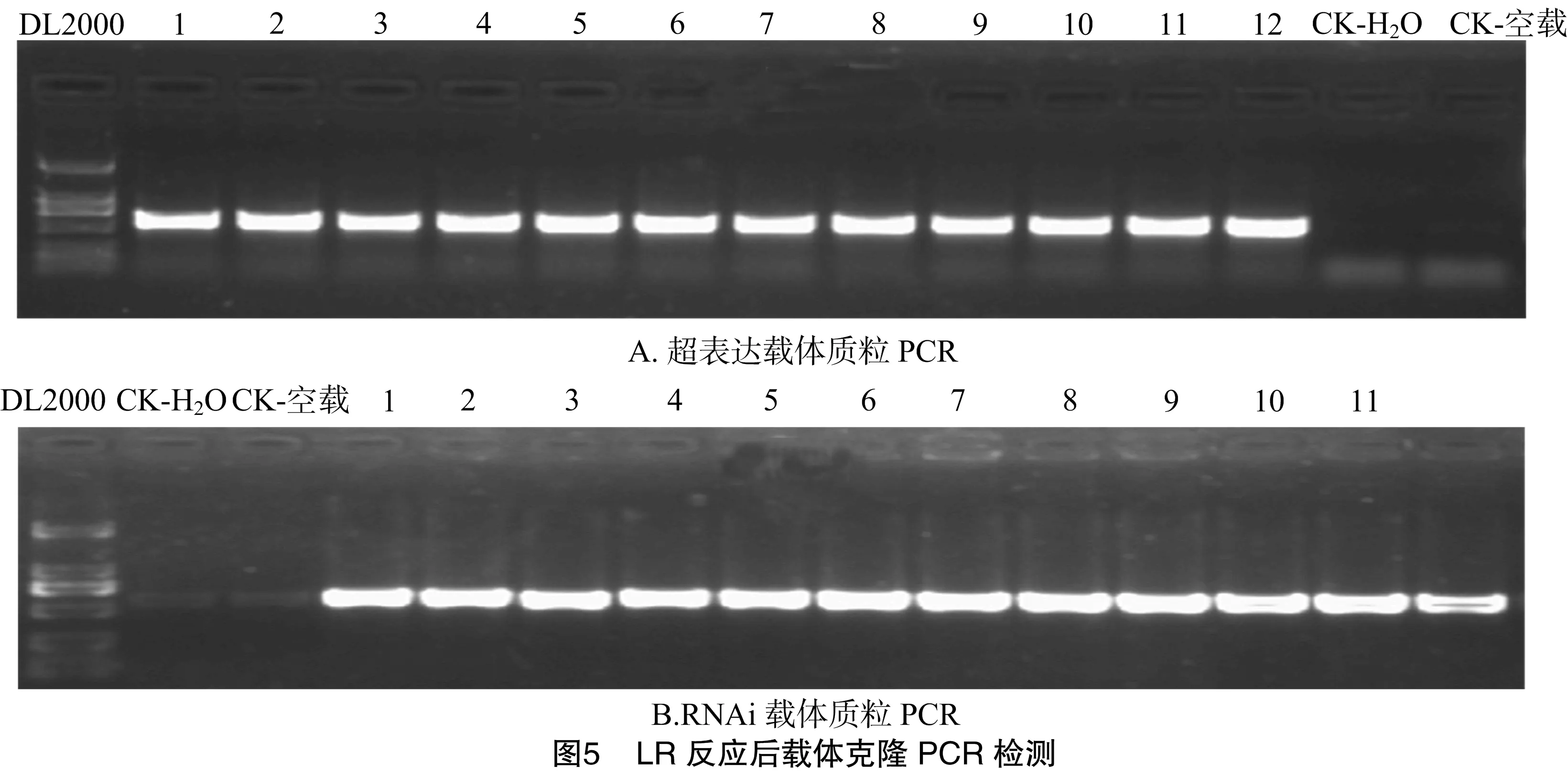
终载体的检测采用了质粒PCR的方法,挑取多个单克隆,以水和空载体质粒为对照进行PCR,结果如图5所示:对照没有目的片段出现,而选择的终载体质粒扩增出了目的片段,说明载体已经构建成功。
3 讨论与结论
3.1 讨论
本试验经过扩增得到的fasciated基因序列与Cong等的研究结果一致,说明该基因在相同作物中具有高度保守性,在供试番茄材料的心室差异并不是由于二者的cDNA序列差异造成的;同时也进行了2个供试材料fasciated基因mRNA转录水平的比较,发现少心室番茄FL1比MLK1的转录水平差异显著[5]。在这一点上,试验结果同Cong等是相同的[6],即在番茄心室数差异明显的番茄植株中,fasciated转录水平差异明显。因此,为了更深入地研究不同材料中fasciated基因的调控作用,进行了该基因的过表达与RNAi表达载体的构建。

对于植物表达载体的构建,采用了Gateway技术,该技术可以高效、准确地构建表达载体,操作简便,反应条件易于控制,反应后阳性克隆只通过PCR扩增后琼脂糖凝胶电泳即可检测,从而为植物基因功能研究提供了强有力的支持。而笔者采用的方法是在传统的基础上略加进步的载体构建方式,即利用最新的入门克隆载体,该载体上已经连入attL序列,这样就跳过了BP反应,直接将纯化回收后的PCR产物通过TOPO克隆反应连入入门克隆载体就可以进行LR反应了,与传统BP加LR反应相比更加方便快捷。在选择入门克隆的时候要注意入门克隆载体与表达载体的抗性,二者的抗性要求是不同的,这样也方便后续筛选阳性克隆,本试验构建RNAi载体的入门克隆在片段连入时对连入的方向也进行了选择,所以在设计引物时在前引物的5′端增加了CACC 4个碱基。本试验应用的Gateway技术构建载体操作简单,省去了大量的酶切、测序等验证步骤,是一种简便、高效植物表达载体构建技术。

3.2 结论
本试验对供试的2个番茄品系的fasciated基因部分序列(551 bp,包括完整的编码序列)进行了比对,发现2个供试番茄材料中该基因序列完全一致。
同时利用Gateway技术构建了fasciated基因的RNAi及超表达载体,准备将其分别转录到少心室番茄FL1和MLK1中去,为进一步研究该基因与心室之间的关系做准备。
