能源微藻油脂积累及油脂含量检测技术研究进展
2018-11-20李贵丽韩志萍魏晓奕李积华
李贵丽 韩志萍 ,魏晓奕 ,周 伟 ,龚 霄 ,李积华
(1.中国热带农业科学院农产品加工研究所/农业农村部热带作物产品加工重点实验室,广东 湛江 524001;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
由于能源短缺问题越来越受到各行业的关注,研究者逐渐把目光转向生物柴油的研发方向,当前生物质柴油的原料大部分来自植物食用油,在供应量上有所限制,因而寻求可再生且满足大量需求的稳定油脂来源是必需的。微藻生物柴油的研究起源于20世纪70年代的第一次石油危机,美国国家可再生能源实验室在1978—1996年间通过水生物种项目(the Aquatic Species Program, ASP)证明了微藻可用于生产生物燃料。作为单细胞生物,微藻生长快速,代谢能力强,培养周期短且不占用耕地,能通过光合作用将无机碳源等转化为甘油三酯等脂质成分储存于细胞[1],在特定的培养条件下,微藻还能改变细胞内各生物质的组成成分,做到高效的积累油脂。目前对高产脂能力微藻的分离筛选已有诸多报道,如Shihhsin等分离得到的链带藻株Desmodesmus sp.F2, 优化后的产油能力能达到302 mg/L·d[2],也有报道指出部分微拟球藻、绿藻、小球藻[3]产脂能力均能达到细胞干重的45%以上,其单位面积油脂产率为大豆的几十倍。另外,通过培养阶段干预和基因手段还可以提高微藻的油脂积累能力,目前普遍认为培养基中限制氮元素的浓度能提高微藻的脂质积累量[4],但也有研究指出氮胁迫培养对不同微藻来说还可以积累碳水化合物,而不是油脂[1];基因层面的研究主要在于微藻脂类代谢遗传调控,通过控制高产油脂基因或改变油脂合成途径的关键酶酶活以获得油脂的积累[5]。然而直到今天,微藻生物燃料仍未实现大规模应用,其瓶颈主要是经济成本高于化石燃料。高额经济成本的原因主要有:一是多数富油微藻偏爱在温度较低的环境中生长,当环境温度高于30℃时就出现生长缓慢或死亡的现象,而大范围连续式温度控制耗资巨大[6];二是一些通过基因技术建立的工程藻,在实验室生长状态良好,在开放池塘却显示了诸多不适[6]。同时,微藻受遗传信息、生长环境等因素的影响,其油脂累积和产量有很大差异,因此筛选高产油能力微藻、提高其生物量和油脂产率是发展微藻生物燃料的关键所在。综合现有微藻油脂生产的相关报道,从产油微藻的种类、影响油脂积累的因素、提高油脂累积方法和油脂检测方法等方面阐述了国内外微藻产油的研究进展,以期为后续的研究计划和产业化提供参考。
1 产油微藻的种类
当前已发现大约有5万株产油微藻分布于世界各地, 其总生物量中含有20%~50%的脂肪,这对生物柴油有很好的特性[4]。但因部分生长速率低、生长周期长且产脂能力不足,仅有小部分可能考虑规模生产生物燃料。目前文献报道的产油微藻主要集中在四大类,即金藻、小球藻、栅藻和部分绿藻,通过自然环境下分离纯化,分析生物量和产脂能力等指标,评价该藻作为产油微藻的优势和前景,具体已筛选得到的高产脂力的微藻有以下几种:
1.1 布朗葡萄藻
布朗葡萄藻(Botryococcus braunii)是一种在世界上广泛分布的单细胞绿藻,也被称为“油藻”, 有A、B、L 3种类别,根据其品种不同,含烃量在20%~80%之间不等[7]。布朗葡萄藻所产烃的组成和结构与石油极为相似, 不同时期藻体细胞中烃类物质含量存在差异,应用透射电镜对不同时期的藻体进行观察发现,对数期含烃颗粒分布最多[8]。对一株布朗葡萄藻在柱式反应器中培养16 d后,其粗脂质占达到干重的含量为56.6%[9]。以胞外聚合物(EPS)刺激布朗葡萄藻,可使生物膜油脂含量提高3倍左右,且油脂含量、纯度、日产率以及中性三酰甘油酯 (TAG)比例都得以提高[10]。
1.2 小球藻
小球藻(Chlorella sp.)是一种真核绿藻,生长速度快,可以有效地固定CO2,有研究发现,将海洋小球藻接种于盐度为30的f/2培养基中,在光生物反应器中培养,得到的油脂质量分数达55.35%[11];新进分离鉴定得到的小球藻Chlorella vulgaris PQG67在NaCl胁迫条件下, 油脂产率可达40%以上[12],而利用生产废水培养的小球藻Chlorella sp.MM3,脂质积累也能达到51%,同时还能去除废水中的氮和磷酸盐等成分含量[13]。另外有研究提出,将小球藻与细菌(Stenotrophomonas maltophilia)共培养能促进小球藻的的生长、油脂积累和脂肪酸组分,其油脂含量能提高36.3%[14]。
1.3 等鞭金藻
等鞭金藻在国内广泛养殖,因其个体小、繁殖快、营养丰富、易被贝类幼虫捕捉吞食和消化, 是海水鱼、虾、贝类育苗过程中良好的饵料。金藻在未调控培养时油脂平均含量已达到27.1%,比含油绿藻和含油硅藻的平均总脂含量高出了2%~5%[15]。湛江等鞭金藻的平均油脂含量是29.7%,其中不饱和脂肪酸含量占总脂的50%[16],具有生物燃料、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的开发前景,该藻经常压室温等离子体诱变后的油脂产率达到了120.2 mg/L·d,比野生株提高了 21.5%[17], 稳定传代藻株也表现出高产脂产率。
1.4 链带藻
链带藻属栅藻科,在我国新疆、西藏等高海拔地区和云南、台湾等湿热地区均有分布,特殊的生长环境引起了科研人员的研究热情。链带藻Desmodesmus sp.F2是从台湾海峡分离鉴定出来的一株产油微藻[2],在目前报道的微藻中,该藻具有非常显著的优点:一是耐高温,其在45℃下培养24 h 和50℃下培养8 h,细胞死亡率均低于5%[2];二是油脂产率最高,通过优化养殖条件,其脂质产量达到细胞干重的60%以上,这是在所有文献报道中最高的微藻产油率[2],热带海洋富油微藻Desmodesmus sp.WC08[18]也具有高温培养条件下的产脂能力,脂质含量占细胞干重的40.8%
1.5 其他绿藻
绿藻(Neochlori oleoabundans)隶属于绿藻纲绿球藻科,其油脂质量分数(干物质)最高达54%,其中三酰甘油酯占总脂质的80%[19];眼点拟微绿球藻(Nannochloropsis oculata) 、绿色巴夫藻( Pavlova viridis Tseng)、微拟球藻(Nannochloropsis sp.)的油脂质量分数分别达到55.77%,46.08%、49.75%[11],具有较高的产脂能力(表1),这些绿藻中长链脂肪酸含量高,且多为中性油脂,在生物柴油开发方向具有一定研究意义。Abou-Shanab等[20]分离出1株淡水产斜生栅藻(Scenedesmus obliquus)油脂含量高达58(±1.5)%,这些绿藻在生物燃料生产上具有优势。总的来说,部分链带藻和布朗葡萄藻相对于小球藻、金藻具有较高的油脂含量,同时,在小球藻的培养大约在10 d左右能达到最大生物量,而栅藻需要培养需要10~20 d,但链带藻相较于小球藻具有更强的环境适应能力,在高温、高寒、干旱、高海拔等地区均有栅藻的生长,因此可以根据培养环境和自身需求合理选择产油藻种。
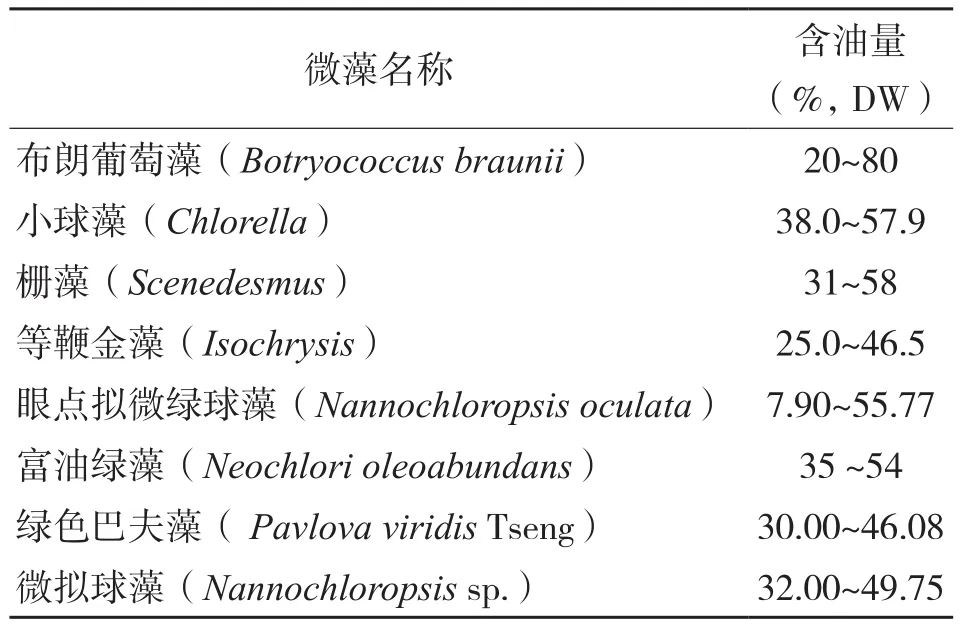
表1 部分微藻的含油量
2 影响微藻油脂积累的因素
根据藻细胞的经验分子式C106H181O45N16P[21],微藻生长需要大量的碳氮磷等营养盐,这些元素对藻细胞的生长和油脂积累存在显著影响,同时培养条件的不同对微藻细胞内成分的含量也会存在影响[21],如培养基中各主要营养元素的添加量、培养光照的强弱[3]、培养温度的高低[1]、通气量及各气体成分比例等因素都会在一定程度上改变细胞代谢产物的含量组成,具体来说影响微藻油脂积累的因素主要有以下几个方面:
2.1 营养元素
碳作为细胞生长所需的主要营养元素,参与脂代谢的重要代谢途径。自养微藻可以通过光合作用吸收溶解在水中的CO2作为碳源,或在碳酸酐酶催化下将环境中的CO32-、HCO3-快速转化为CO2用于细胞生长[21]。微藻总脂质中,高不饱和脂肪C16和C18含量较高[13],合成这些脂肪酸需要合适的碳元素供应。杨静等通过加入葡萄糖将栅藻油脂的产率提高了8倍。但也有研究表明CO2浓度过高,会抑制微藻脂类的积累[22],这可能是高浓度的CO2降低了环境的pH值。
氮元素也会影响到脂类物质的积累。当氮元素充足时,细胞生长速度快,各类有机物均能正常的积累合成;而在氮胁迫环境下蛋白质等化合物的合成积累受到限制,从而提高了脂类物质的相对含量[22]。谢友坪等[1]通过脉冲式添加氮源对Desmodesmus sp.F51进行培养,探究微藻细胞的生长及生物质组成,结果表明,脉冲添加氮源有利于微藻细胞的生长和碳水化合物的积累,但脂质积累量明显降低。也有研究指出氮胁迫培养对不同微藻来说还可以积累碳水化合物[7]。
磷元素也参与脂肪酸的转化过程[23]。李雨晨[24]研究发现磷充足条件下,微藻细胞主要促进单不饱和脂肪酸的积累,而磷缺乏时,不仅可以促进中性脂积累,还能提高C20∶5、C22∶5等长链多不饱和脂肪酸的比重。各元素以化合物的形式作为合成三酰甘油的底物,同时需要参与脂肪酸合成代谢的酶、葡萄糖和载体蛋白等的协同作用最终形成三酰甘油。
Fe3+是影响微藻油脂积累的重要元素,当Fe3+浓度分别提高2倍和10倍时,能使等鞭金藻(Isochrysis galbana)和杜氏盐藻(Dunaliella tertiolecta)最大的油脂产率分别增加1.65倍和2倍[25]。另外钙浓度对微藻生物量和油脂含量具有显著影响,当铁、钙浓度分别为 2×10-5mmol/L和0.05 mmol/L 时,最利于 Desmodesmus sp.WC08 的生长和油脂积累[18]。各元素以化合物或离子的形式作为合成三酰甘油的底物,同时需要参与脂肪酸合成代谢的酶、葡萄糖和载体蛋白等的协同作用最终形成三酰甘油。
2.2 环境因素
温度是影响微藻细胞生长代谢的重要因素之一。研究表明,虽然不同微藻细胞的油脂代谢途径以及关键酶存在差异,但温度对藻体细胞内油脂合成积累和酶活的影响是一致的[26],原因可能是在低温环境下,微藻细胞的生长代谢和活动都趋于缓慢,脂质的合成效率也较低;随温度的逐渐升高,相关的关键酶被激活,从而提高了油脂积累的效率;极高温环境中酶受高温活性被抑制或者丧失了酶活,造成不可逆的损伤,无法积累油脂。温度对于脂肪酸的组成也有影响,有研究指出当温度降低时,不饱和脂肪酸的含量会有所增加[26],这也与脂质固化理论(liquid solidfication)观点一致。
微藻像植物一样进行光合作用,对光的需求必不可少,当光照强度超过光补偿点时,微藻生物量开始积累,光照越强,生物量积累越多,但光强超过光饱和点时,过强的光照会影响光合电子传递链,造成光氧化胁迫降低生物量。因此,合适的光照条件对微藻的生长至关重要。有研究表明,高光强有利于中性脂质的积累,低光强更易积累极性脂质,通过控制光照强度使其接近光饱和点,可以使光合效率达到最大值[3,27]。CO2通气量等条件[26]的也会影响微藻的生长速度,通气量决定了氧气和碳源供应,进而影响到脂类物质积累。
室外培养时培养装置的设计对微藻的生长也会产生影响,培养装置可分为开放的回旋池和封闭的光生物反应器,开敞式回旋池比封闭的光生物池更具成本效益。回旋池的设计需要考虑池深度和池中微藻的循环问题,一般来说,深度通常设计在0.2~0.5 m之间,以保证微藻的高增长率[28],回旋池内装有桨轮会在回旋池中产生混合和运动,避免微藻的沉淀。但该系统的缺点之一是水过度蒸发到大气中,相对于光生物反应器,微藻对CO2的利用效率较低。此外,回旋池还易受到环境中其他微生物的影响,造成污染和营养消耗。因此,在目前的回旋池设计中多对其进行遮盖,以防止污染[10]。光生物反应器利用透明的直玻璃管或塑料管是水平排列、垂直排列、倾斜排列或螺旋排列,选择合适的管道直径角度安装以保证足够的光渗透到培养基上[9],从而促进较高的生物量生产率。降低了回旋池培养的污染风险且不需要占用农业用地。但光生物反应器比开敞式跑道池昂贵得多,用光生物反应器处理工业废水需要加以浓缩并转移到反应器内进一步处理[28]。现今,利用回旋池和光生物反应器混合系统是一种低成本、高效的培养微藻的方法,在该系统中,在回旋池之前使用闭路光生物反应器来控制或减少来自其他微生物的污染[10]。然后,将密集的微藻细胞转移到开阔的回旋池中进行进一步的细胞繁殖,以获得大量的生物量。该系统目前已用于雨生红球藻的培养[29],实践证明,在微藻养殖生产生物柴油中,利用混合系统生产生物柴油的全球升温潜能值(GWP)和化石能源需求量(FER)分别为42%和38%[5],与化石柴油相比,生产1 t微藻生物柴油可节省成本。
3 提高微藻产油量方法
改变微藻生长的环境条件,可以增加藻体细胞内的油脂合成和累积量。一般来说,有以下几种途径:
3.1 筛选高产油脂藻种
从自然界中分离得到的藻株,主要采用两种方法:一是根据形态特点进行初步鉴定,基于微藻生长曲线,生物量和油脂含量等指标测定微藻的产油性,进而对高产藻株进行分子生物学鉴定,通过培养获得油脂积累[30],该方法比较可靠,但较费时,不适于大规模筛选;二是采用油脂含量快速测定进行初步筛选,后进行复筛检测初筛微藻的生长和产脂量[31],该方法测定快速,大大节省了样品和工作量。Shihhsin等[3]分离得到的链带藻株Desmodesmus sp.F2, 其优化培养条件后的产油能力能达到302 mg/(Ld),Araujo等[32]测试了10种微藻产油的可行性,结果显示纤细角毛藻的油脂含量最高,普通小球藻获得了最大的油脂产量,季方等[22]从自然水样中分离筛选出一株生物量较高的微藻属,通过基因鉴定并命名为 Desmodesmus sp.EJ12-3,并优化合适的培养条件得到了最大的生物量的积累。
3.2 优化微藻培养条件
筛选得到的藻种还需要进行培养条件优化,主要包括培养温度、湿度、曝气量、光照、pH等条件[33],以提高其生物量和油脂产率。但有研究发现,微藻的生长和生物质的积累在一定程度上是矛盾的,具有高油脂含量的微藻,其生长速率普遍偏低[34],因此选择适当的培养条件对脂质积累大有裨益。熊伟等[34]利用琼脂和微孔滤膜构建了生物膜反应器,探究微藻生长和油脂积累情况,实验表明当琼脂浓度升高到8%时,微藻细胞直径从3.87 μm减小到3.35 μm,油脂产量提高了63.39%。另外,营养盐胁迫处理也能控制生物量和生物质的合成方向[35],如氮、磷元素胁迫处理对微藻的生长和油脂积累具有调控作用。氮胁迫处理培养微藻Desmodesmus sp.WC08,得到低浓度氮在生长后期更适于微藻Desmodesmus.sp.WC08的生长,氮浓度为10 mmoL/L时最有利于脂质的积累;对磷元素的胁迫处理研究发现,低浓度磷(0.1~0.5 mmoL/L)培养的Desmodesmus.sp.WC08的油脂含量较高[18]。有研究者提出用两步培养法富集油脂,即先将微藻接种于营养丰富的环境中获得高生物量,后转接至营养胁迫的环境中积累油脂[36],刘婷婷利用氮胁迫培养小球藻在30 h内脂质含量从微藻质量的20%增加到50%。但该法会使积累油脂时间延长,营养不足也会阻碍藻细胞的生长[3,37]。
3.3 基因工程改造
根据已知的油脂合成代谢途径,乙酰辅酶A 羧化酶(ACCase)基因是脂肪酸合成途径中的关键酶,超量表达的ACCase对油脂积累有重要的作用[31],除此之外,酰基辅酶A、苹果酸酶、柠檬酸裂合酶等都参与了油脂合成代谢途径[5,38]。通过现代基因工程手段,改变微藻油脂合成的相关基因,超表达油脂合成的关键酶或阻断竞争中间代谢物的关键酶的表达[5],理论上可获得高产油能力和遗传性状稳定的微藻。自1995 年始就已经有研究者将(ACCase)基因转入到小环藻中;2015年,Gomma等[39]在四尾栅藻(Scenedesmus quadricauda)中导入乙酰辅酶A羧化酶(ACCase)基因,甘油激酶基因,甘油三磷酸脱氢酶基因,使其在藻体内过表达,得到突变株总脂量比野生藻增加了1.6倍;2016年,Niu选用了三角褐酯藻过表达甘油-3-磷酸转酰酶(GPAT)基因,使藻体细胞的中性脂的含量增加了2倍[40],且不饱和脂肪酸含量较野生三角褐藻显著提高。另外,磷酸烯醇式丙酮酸羧化酶(PEPCase)是氨基酸合成途径的关键酶,能够催化乙酰辅酶A合成草酰乙酸,与脂肪酸合成竞争乙酰辅酶A,抑制脂肪酸合成[41]。基因工程改造微藻操作复杂,目前获得的突变株均存在遗传稳定性不足的问题,有待进一步发展。
4 微藻细胞油脂的测定
微藻能否用于生物柴油的生产,取决于微藻产脂能力及脂质组成,因此对于微藻油脂含量组成的测定也至关重要,目前应用的油脂测定方法主要是尼罗红荧光染色法、苏丹黑B染色法、傅里叶变换红外光谱法(FTIR)、气相色谱-质谱连用(GC-MS)等。以上4种方法都可以做到少量样品下的脂质含量的快速测定,尼罗红染色法利用荧光,灵敏度高,样品处理简单,但需要针对不同样品适当改进,苏丹黑B法灵敏性较低,对样品均一性要求较高,且只能测定样品中脂质的相对含量。傅里叶红外变换红外光谱法和GC-MS因设备昂贵且样品前处理较染色法稍显复杂,因此不如染色法使用广泛,但此两种方法的结果更为精确,具有高的分辨率和有较好的重现性,常用于精确的脂质组成成分的含量分析。
4.1 尼罗红荧光光谱法
尼罗红是一种亲脂性恶嗪类荧光染料,一般用于检测非极性疏水环境中的中性油脂。尼罗红的水溶液或DMSO溶液可以穿过多种微藻的细胞膜,与脂类物质结合,在480 nm的激发波长下显示强烈的橘红色荧光,以此测定胞内油脂的相对含量。具体方法为:取2 mL藻液与5 μL尼罗红染液(浓度为0.1 mg/m L丙酮)混匀后避光放置5 min, 用荧光分光光度计测定480 nm光激发荧光值和585 nm波长处的荧光值,利用测定的荧光值减去混合液在该波长处的自发荧光值即为染色后的相对荧光值[42]。对于一些细胞壁较厚的微藻,常规的尼罗红不易渗入胞内染色,所以张敬健等[43]对该方法进行了改进,先用微波预处理微藻40 s,并结合体积分数为1%的二甲基亚枫,浓度为1.5 μg /mL尼罗红染液,在40℃下染色5 min。得到了最佳的染色条件,并用于斜生栅藻的油脂测定中。该种方法直接快速,对于脂质含量较低的藻体检测十分有效。
4.2 苏丹黑B染色法
苏丹黑B也是一种脂溶性染料,可与中性油脂生成黑色或蓝黑色的络合物,在645 nm下测定生成络合物的吸收峰,其吸收峰的峰值和峰面积与微藻总脂质质量分数间呈线性关系。具体方法为: 准确称取0.6 g苏丹黑B粉末溶于100 mL 95% (体积分数,下同) 的乙醇中,混匀后沸水浴加热10 min,冷却后在4℃下离心收集上清液,用0.22 μm滤膜过滤后保存备用。后取苏丹黑B染液与超声破碎的湿藻泥充分混匀,沸水浴20 min, 冷却后在4℃离心10 min。取下层沉淀用50% 的乙醇洗涤3次,最后加入70% 的乙醇混匀, 用紫外分光光度计在645 nm波长下测定其吸光度[44],以此可测定微藻细胞中性油脂的总含量。彭悦等[44]采用该方法测定了球等鞭金藻和小新月菱形藻的油脂含量和利用溶剂提取法所得油脂含量基本一致,证实了该方法的可行性。
4.3 傅里叶变换红外光谱法
傅里叶变换红外光谱法(FTIR)是一种理想的油脂测定方法,油脂中的不饱和脂肪酸在红外光谱的3 000~3 100 cm-1区域有伸缩振动吸收峰,利用迈克逊干涉仪按照一定速度变化形成干涉光,再与微藻油脂形成作用产生干涉信号,该信号经收集后进行傅立叶变换形成干涉图,进而还原光谱图,通过分析红外光谱图中相关吸收峰的位置、形状等进行有机物的快速的定性定量分析。FTIR 还可以用于测定细胞中各生化组分含量,包括脂质、蛋白质和碳水化合物等。能对微藻细胞组分进行精确的分析比对[45]。
4.4 气相色谱-质谱联用法
气相色谱-质谱联用法(GC-MS)是检测微藻油脂含量及脂肪酸组成的最常用的定性定量测定方法。一般来说,微藻先经过NaOHCH3OH溶液皂化后经三氟化硼/甲醇(1∶2,V/V)恒温水浴摇匀以分离脂肪层,或利用硫酸甲醇溶液在80℃ 水浴抽提,抽提后通过加入等份的蒸馏水正己烷萃取脂肪酸,将上层萃取液取出后氮气吹干,再复溶于正己烷中[46]进行色谱质谱分析,得到的结果直接对比质谱图谱,用NIST08.LIB质谱数据库测定其保留指数。彭悦等[44]利用GC-MS探究了球等鞭金藻和小新月菱形藻的油脂含量及其组成,得到两株微藻细胞内各脂肪酸的种类和所占比例,石健[46]利用GC-MS法测定了不同营养元素浓度下的微藻脂肪酸组成情况和油脂含量的比较,所得数据精确,削弱了油脂含量快速测定的误差。
5 展望
利用微藻作为生物柴油原料的构想,虽在1980年就有学者提出,但一直未能实现,近年来的能源短缺问题和新能源的开发又让微藻生物能源的开发重新受到关注。相关研究指出,随着微藻培养条件和培养技术的不断改进,微藻成为生产新型可再生能源的主要原料成为可能。目前对于微藻油脂的研究主要集中于从自然界筛选野生藻株的培养条件优化上,而未经人工导向的野生藻株在油脂积累能力上仍存在限制,因此,基因工程技术对野生藻株驯化是解决产油能力的首选,但基因工程研究还处于初步阶段,对于微藻油脂合成检测技术也比较复杂繁琐,且检测设备昂贵,另外实验室高密度培养的微藻在进一步中试后能否用于工业化大规模培养尚需要进一步研究验证,针对生物柴油的大规模工业化生产仍然存在着很多障碍。未来或可以在生物柴油的菌种选择培养、生物反应器的设计应用、生物油脂产量优化和生物油脂的提取检测等重要的生产环节进一步探究细化并加以改进,从而解决当前能源短缺的问题,建立可再生能源生产链。
