市售盐酸二甲双胍片仿制制剂溶出曲线与溶出度研究*
2018-11-20姜建国靳茂礼曹凤习
徐 可 ,姜建国 ,朱 娜 ,郝 伟 ,靳茂礼 ,曹凤习
(1.河北省石家庄市食品药品检验中心,河北 石家庄 050031; 2.河北省药品检验研究院,河北 石家庄 050011)
盐酸二甲双胍片属生物药剂学分类系统(BCS)Ⅲ类药物,具有高溶解性和低渗透性。临床反馈,不同厂家产品临床疗效差异较大[1]。2015 年版《中国药典(二部)》[2]收载的该药现行质量标准难以反映企业间工艺控制上的差异。本研究中选择市售不同厂家生产的盐酸二甲双胍片仿制制剂与参比制剂,并对其在多种pH溶出介质中溶出曲线的相似性进行了评价[3-9],为其仿制制剂的生产工艺和内在质量提升提供参考[10],并对溶出度检查方法及限度的修订提出了建议。现报道如下。
1 仪器、材料与试药
仪器:EDT-14Lx型智能溶出试验仪(上海仪真分析仪器有限公司);LC-20AD型高效液相色谱仪,包括二极管阵列检测器、Labsolution工作站(日本岛津公司);XS105型十万分之一电子天平(瑞士梅特勒-托利多公司);ZKT-18F型真空脱气机(天津天大天发科技有限公司)。
试药:盐酸二甲双胍对照品(中国食品药品检定研究院,批号为100664-201604,纯度为100%,105℃干燥2 h);盐酸二甲双胍片均为国内市售仿制制剂(规格均为每片0.25 g,生产企业及批号见表1);甲醇、乙腈(色谱纯,美国 Merck公司);氯化钠、乙酸钠、磷酸二氢钾、无水磷酸氢二钠(分析纯,北京化工厂);冰醋酸、盐酸(分析纯,天津市科密欧化学试剂有限公司);试验用水为去离子纯净水。依据国家食品药品监督管理总局发布的《仿制药参比制剂目录(第五批)》(2017年第89号),采用盐酸二甲双胍片原研制剂(日本新药株式会社,规格为每片 250 mg,批号为 357401,356501,355801)为参比制剂。

表1 盐酸二甲双胍片仿制制剂生产企业、规格及批号
2 方法与结果
2.1 色谱条件
色谱柱:Agilent Zorbax Eclipse Plus C18柱(250 mm×4.6 mm,5 μm);流动相:磷酸盐缓冲液(取己烷磺酸钠1.88 g,磷酸二氢钠 0.78 g,加水溶解并稀释至 1 000 mL,用磷酸调节 pH 至 3.5±0.05)-乙腈(90∶10,V/V);检测波长:233 nm;柱温:30 ℃;流速:1.0 mL /min;进样量:20 μL。
2.2 溶液制备
溶出介质:参照第 17版《日本药局方》[11],4种溶出介质的配制方法及37℃时盐酸二甲双胍在各溶出介质中的溶解度见表2。各溶出介质用水均为真空脱气机经42℃脱气40 min处理后立即使用。
对照品溶液:称取盐酸二甲双胍对照品适量,精密称定。以pH=4.0醋酸盐缓冲液、pH=6.8的磷酸盐缓冲液和水为溶出介质溶解并稀释,制成每1 mL中约含盐酸二甲双胍56 μg的溶液;以pH=1.2的盐溶液为溶出介质时,由于溶剂效应,检测器响应信号相对较低,稀释成每1 mL中约含盐酸二甲双胍278 μg的溶液,作为对照品溶液。
供试品溶液:取样品适量,按2015年版《中国药典(四部)》通则 0931 第二法(桨法),转速 50 r/min,溶出介质温度为(37.0 ±0.5)℃ ,分别采用 4 种溶出介质900 mL,依法操作,经30 min取溶液适量,滤过,取续滤液,作为供试品溶液。
空白辅料溶液:称取生产企业处方中包含的所有辅料适量,精密称定,按供试品溶液制备方法制成空白辅料溶液。
2.3 系统适用性试验
精密量取2.2项下供试品溶液、对照品溶液与空白辅料溶液各20 μL(以水为溶出介质),注入液相色谱仪,记录色谱图。分别采用4种溶出介质制备的此3种溶液进样,结果相应色谱图基本一致,以水为溶出介质的色谱图见图1。二甲双胍峰保留时间约为5.2 min,理论板数按二甲双胍峰计应不小于3 000,拖尾因子不超过1.5。主成分峰与溶剂、辅料及其他杂质峰分离较好。
2.4 方法学考察
线性关系考察:以pH=4.0的醋酸盐缓冲液、pH=6.8的磷酸盐缓冲液和水为溶出介质时,精密称取盐酸二甲双胍对照品适量,精密称定,分别用溶出介质溶解并稀释成每1 mL中约含盐酸二甲双胍10,20,30,50,70,100 μg 的溶液。各精密量取 20 μL,按 2.1 项下色谱条件进样,记录色谱图,以盐酸二甲双胍质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得 回归方程 分别为 Y =79 793.1X+28 251.0,r=0.999 9(n=6),Y=79 836.7X+28 092.4,r=0.999 9(n =6)和 Y =79 881.4X+28 479.5,r=0.999 9(n =6)。结果显示,盐酸二甲双胍质量浓度在10~100 μg/mL范围内与峰面积线性关系良好。以pH=1.2的盐溶液为溶出介质时,称取盐酸二甲双胍对照品适量,精密称定,同法稀释成每1 mL中约含盐酸二甲双胍10,100,150,250,300,400 μg 的溶液,同法操作,得线性回归方程为 Y =79 832.5X-27 922.0,r=0.999 8(n=6)。结果显示,盐酸二甲双胍质量浓度在10~400 μg/mL范围内与峰面积线性关系良好。
精密度试验:取4种溶出介质制备的对照品溶液,分别按2.1项下色谱条件连续进样6次,测定峰面积。结果 pH=1.2的盐溶液、pH=4.0的醋酸盐缓冲液、pH=6.8的磷酸盐缓冲液和水为介质时的 RSD分别为0.30%,0.34%,0.30% ,0.23% (n =6),表明仪器精密度良好。
稳定性试验:取供试品溶液(J厂家,批号为3316179)适量,在室温条件下放置 0,2,4,6,8,12,16,20,24 h,按2.1项下色谱条件进样,测定峰面积。结果以pH=1.2的盐溶液、pH=4.0的醋酸盐缓冲液、pH=6.8的磷酸盐缓冲液和水为介质时的 RSD分别为0.41% ,0.34% ,0.24%,0.30% (n =9),表明供试品溶液在24 h内基本稳定。

图1 高效液相色谱图(溶出介质为水)
回收率试验:按最大处方量取空白辅料,精密加入相当于样品含量80%,100%,120%的对照品各适量,每个水平各3份,分别使用4种溶出介质,依法制备供试品溶液,再按2.1项下色谱条件进样,测定峰面积,计算回收率。结果以pH=1.2的盐溶液、pH=4.0的醋酸盐缓冲液、pH=6.8的磷酸盐缓冲液和水为介质时的平均回收率分别为 99.01%,99.12%,99.27%,99.05% (n =9)。
2.5 溶出曲线测试方法
采用日本《医疗用医药品品质情报集》(“橙皮书”)[12]中规定的盐酸二甲双胍片溶出曲线测试方法:桨法,转速 50 r/min,溶出介质 900 mL。考察样品在 2.2项下4种溶出介质中的溶出曲线。取样品12片,依法操作,经 5,10,15,20,30,45 min 时,取溶液 5 mL,滤过,精密量取续滤液2 mL,置10 mL容量瓶中,用溶出介质稀释至刻度,摇匀;以pH=1.2的盐溶液为溶出介质时,取溶液5 mL,滤过,取续滤液作为供试品溶液。精密量取供试品溶液与对照品溶液各20 μL,分别注入液相色谱仪,按2.1项下色谱条件进样,记录色谱图,按外标法以峰面积计算每片样品在各时点的累积溶出度(%),以其平均值为纵坐标、时间(min)为横坐标绘制溶出曲线。
2.6 溶出曲线相似性比较原则

图2 5家企业仿制药与原研药溶出曲线比较
依据《普通口服固体制剂溶出曲线测定与比较指导原则》,采用非模型依赖法中的相似因子(f2)法,比较仿制制剂与原研制剂溶出曲线的相似性及同一生产企业仿制制剂的批间差异。计算公式如下。其中,Rt为 t时间参比样品平均溶出量,Tt为 t时间受试样品平均溶出量,n为取样时间点的个数。
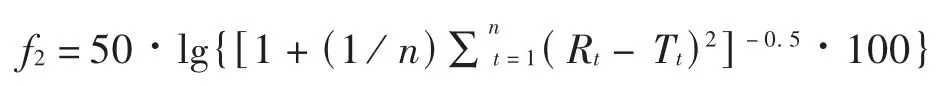
相似性判定标准:当2条溶出曲线 f2数值不小于50,或受试样品和参比样品在15 min的平均溶出量均不低于85%时,可认为溶出曲线相似。
f2从统计学上度量了2条溶出曲线之间的相似性,f2值越大,说明2条溶出曲线差异越小,若50≤f2≤100,可以推断2条溶出曲线相似(完全相同的2条溶出曲线的 f2=100)。
2.7 溶出曲线测定结果与相似性比较
原研制剂溶出曲线与批间差异:在4种溶出介质中,3批次原研制剂在15 min的平均累积溶出度均高于85%,溶出曲线相似。日本“橙皮书”中收载了A、B两种剂型的溶出曲线,试验结果证明该原研制剂为B型,属快速释放型。原研制剂批间基本无差异,产品质量控制较好。
仿制制剂与原研制剂溶出曲线相似性比较:将12家生产企业的仿制制剂分别与原研制剂比较,详见图2至图4。结果,仅G,J和H企业的仿制制剂在4种介质中15 min的平均累积溶出度均超过85%,与原研制剂溶出曲线相似,占受试仿制药生产企业总数的25.0%。其余75.0%的企业产品溶出曲线与原研制剂不相似,说明其产品与原研制剂存在质量差异,有待进一步完善生产工艺,提高产品质量。另有个别企业,如B企业生产的仿制制剂与原研制剂差异较大,在pH=1.2的盐溶液中,45 min内平均累积溶出度不足10%,在pH=4.0的醋酸盐缓冲液中仍不足40%。溶出量较低将严重影响药效的发挥。该厂家有待进一步完善处方工艺,促进药物有效成分更好地释放。

图3 5家企业仿制药与原研药溶出曲线比较

图4 5家企业仿制药与原研药溶出曲线比较
同一企业不同批次仿制制剂批间差异评价:样中含2批次仿制制剂的生产企业有3家,分别为A,B,F企业,含3批次及以上仿制制剂的生产企业有5家,分别为 E,I,J,K,L 企业,前 3 家企业选所有批次,后 5 家企业随机选取3批,测定样品在4种溶出介质中的溶出曲线。以每个企业任一批次产品的溶出曲线做参比,其他受试批次与之进行比较。选择合适的时间点,计算 f2。结果见表3。依据指导原则,J企业3批次产品在4种介质中15 min的平均累积溶出度均达到85%以上,产品溶出曲线相似,批间差异较小。且与原研制剂的溶出曲线相似,该企业产品质量优于其他生产企业。A,B,E,F,K企业的不同批次产品在各溶出介质中溶出曲线的 f2值均大于50,说明上述各企业产品批间差异都很小,不同批次产品质量基本一致。I,L企业的不同批次产品在各溶出介质中溶出曲线不相似,f2值小于50,批间差异较大。
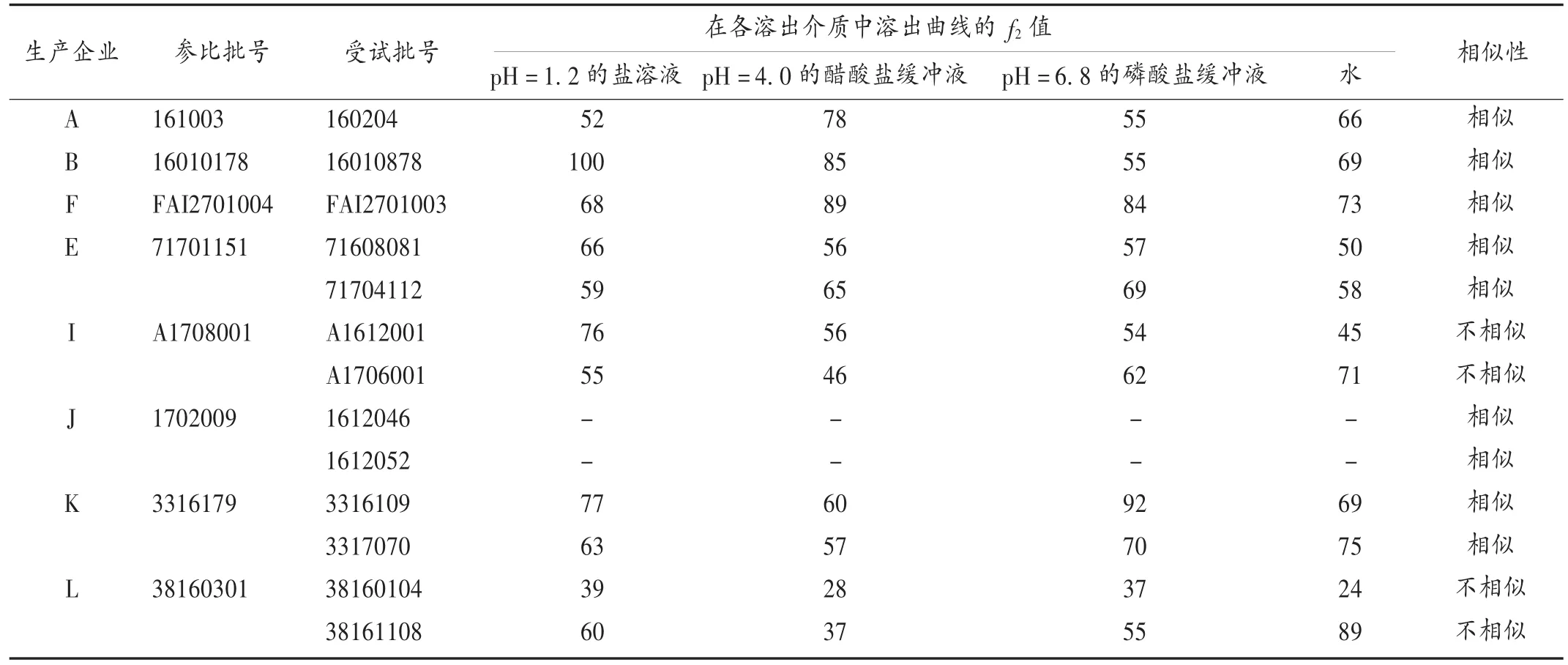
表3 在4种溶出介质中各企业不同批次产品溶出曲线相似性比较
2.8 溶出度检查项方法与限度修订建议
仿制制剂按照现行标准[2]检验表1中的41批次样品:篮法,转速100 r/min,以1 000 mL水为溶出介质,45 min取样,按2.1项下方法检测,限度为标示量的70%,合格率为100.0%,对产品质量区分度较小。
依据溶出曲线测定结果,分析盐酸二甲双胍片在水中的溶出曲线,结果见图5。可见,样品45 min的平均累积溶出度均接近100%,差异很小。3家企业样品30 min的平均累积溶出度低于85%。
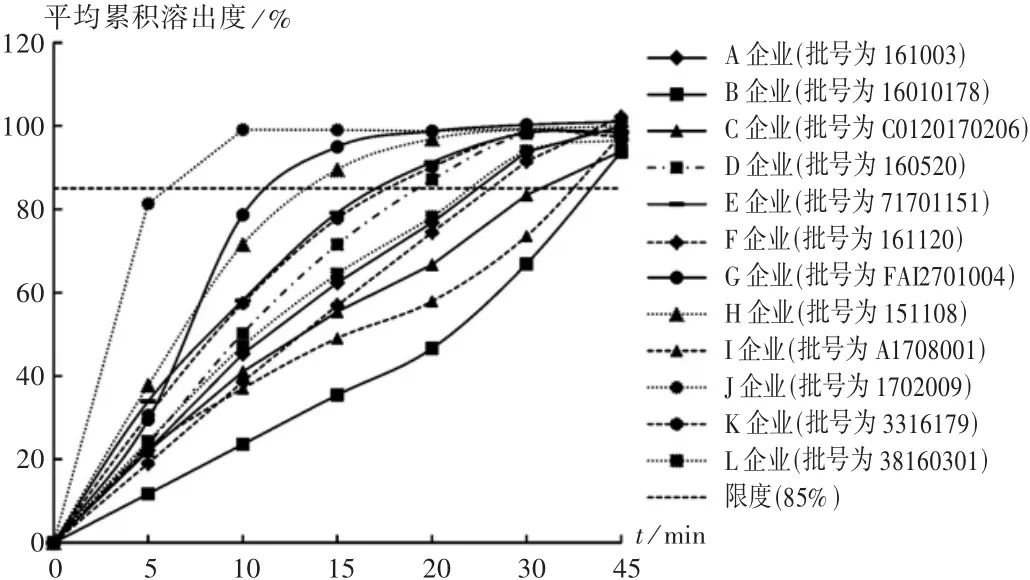
图5 12家企业仿制制剂在水中的溶出曲线
建议将溶出度测定修订为:桨法,转速50 r/min,以900 mL水为溶出介质,30 min取样,限度为标示量的85%。按拟订标准对上述41批次样品进行溶出度检查,有9家的产品符合规定,占企业总数的75.00%;其中35批次产品符合规定,合格率为85.37%,拟订标准提高了检验标准对不同产品质量的区分度。建议对现行标准进行修订,并设定更高要求的限度,促进仿制制剂总体质量的提升。
3 讨论
针对研究中发现的与原研制剂不相似的情况,与相关企业的生产、质量部门人员就产品的生产工艺、处方筛选、质量控制关键点等问题进行沟通。从企业反映的情况与相关文献资料[12-15]了解到,影响盐酸二甲双胍片溶出度的因素主要有2个:一是制片工艺中原料的粒径。剂量较小的药物与较多量的亲水性辅料共同研磨粉碎,药物与辅料的粒子逐步变小,最终形成在药物粒子的周围黏附着一层亲水性辅料粒子的状态,这样既能将药物粉碎得更细,又可使药物粒子表面的亲水性增强,改善药物的溶出度。二是辅料的成分与配比。润滑剂如硬脂酸镁等可增强片剂的疏水性,使水难以透入,致使片剂崩解迟缓。表面活性剂吐温-80、十二烷基硫酸钠等的加入,可降低介质的表面张力,改善片剂的润湿性,加快片剂的崩解。崩解剂如淀粉、羧甲基淀粉钠、低取代-羟丙纤维素、羧甲基纤维素钙等都有较强的吸水膨胀性能,促进片剂崩解。黏合剂如淀粉浆、羟丙基甲基纤维素的加入会影响制剂的溶出度。
溶出曲线能反映仿制制剂与参比制剂的质量差异,大部分仿制制剂的内在质量有待进一步提高,个别企业的产品差距较大,有待完善处方与工艺,以促进药物有效成分更好地释放,有必要进一步加强对仿制制剂溶出曲线的考察,以确保药品的质量与疗效。
