川西北高寒草甸土壤养分和微生物群落功能多样性对模拟增温的响应
2018-11-16杨有芳字洪标罗雪萍阿的鲁骥王长庭
杨有芳,字洪标,罗雪萍,阿的鲁骥,代 迪,王长庭
(西南民族大学青藏高原研究院,四川 成都 610041)
近年来,温室效应继续扩大,全球气候变暖已成为人们广泛关注的焦点.全球变暖存在显著的区域性差异,高海拔地区和高纬度地区对温度升高的响应更为敏感[1].川西北高寒草甸是我国5大牧区之一,但由于长期的人为和动物干扰导致高寒草甸退化,使草地生态系统的功能和稳定性减弱,出现土壤养分流失、生物多样性遭受破坏和区域荒漠化趋势增加等一系列生态环境问题.
土壤在陆地生态系统中处于载体地位,影响着陆地生态系统土壤养分循环格局及植物群落生产力等诸多方面.土壤微生物是土壤物质和能量流动中不可或缺的主要成员,对土壤碳氮循环、土壤结构形成以及生态系统调节等多个过程中起着至关重要的作用[2],被称为土壤养分元素循环的“转化器”,陆地生态系统稳定的“调节器”[3].同时,土壤微生物是地下生态系统的敏感指标之一,对土壤理化性质和质地有非常重要的指示作用[4],其群落结构、数量、多样性及其他特征受到立地条件的影响和制约,也能够对土壤环境(温度、湿度等)的改变而发生迅速改变[5].李娜等人[6]的研究中表明,土壤微生物活性随土壤温度升高而降低;吴静等人[7]的研究发现土壤微生物呼吸Q10值随着土壤温度升高表现出降低趋势;Zhang等[5]在青藏高原高寒草甸3年的实验发现增温增加了土壤微生物生物量,并改变了土壤微生物群落组成.
Biolog-ECO法是一种用来描述微生物群落功能的变化的方法,能够真实、直观的描绘出土壤微生物群落底物利用的动力学过程[8].截至目前,利用Biolog-ECO法对土壤微生物的研究多集中经济类型(农田、林地等)系统中[9-10],且有关增温对土壤微生物群落代谢等方面的研究比较少,尤其对高寒草甸不同土层土壤微生物群落代谢活性、对碳源的选择利用方式以及土壤养分与土壤微生物代谢活性的关系等的研究鲜有报道,而且不同环境中微生物群落功能多样性信息尚不明确.因此,本试验设置独立的开顶式增温棚进行模拟增温,利用Biolog法和实验室常规分析法对青藏高原高寒草甸不同土层土壤养分、土壤微生物群落代谢活性和功能多样性进行研究,旨在探讨高寒草甸不同土层土壤养分以及土壤微生物群落功能多样性对温度变化的响应,为深入了解未来气候变化条件下高寒草甸土壤C、N循环、养分利用动态和微生物群落功能多样性与土壤环境因子的相关性及生态系统功能的稳定性提供参考依据.为此,我们提出以下问题:(1)增温后土壤养分有无变化?(2)增温对高寒草甸不同土层土壤微生物代谢活性影响如何?(3)增温对高寒草甸不同土层微生物功能多样性有无影响?(4)不同土层土壤养分含量与微生物碳源利用之间有无相关性?
1 研究区域自然概况
野外实验在位于青藏高原东缘四川省阿坝州红原县(31°50′~33°22′N,101°51′~103°23′E)西南民族大学生态保护与畜牧高科技研发试验园区(32°49.823′N,103°35.237′E)进行.红原县气候类型属于高原寒温带半湿润季风气候.年降水量650~800 mm,80% 集中在5~9月份.年平均气温1.1℃,最高气温24.6℃,极端高温25.6℃;最低气温-10.3℃,极端低温-33.3℃.植被以莎草科中的四川嵩草(Kobresia setchwanensis),禾本科中的垂穗披碱草(Elymus nutans)、剪股颖(Agrostis matsumurae) 等,杂类草中的条叶银莲花(Anemone trullifolia)、钝苞雪莲(Saussurea nigrescens)、鹅绒委陵菜 (Potentilla anserina)和高山紫菀(Aster alpinus)等占优势.植被生长期为120~140天,7、8月份植被平均盖度超过80%,最高植被高度达45~60 cm.土壤类型为亚高寒草甸土,pH值为4.6左右,土壤中有机质比较丰富,速效氮含量较高,速效磷的含量较少[11].
2 材料与方法
2.1 样地设置
试验样地于2009年7月设置安装增温棚,周围用网围栏封育,禁止放牧.采用国际冻原计划(International Tundra Experiment,ITEX)模拟增温效应对植被影响作用的方法[12],在样地内采用完全随机区组设计,建立2种2×2×2 m开顶式小室(OTCs/CK)共20个,其中10个OTCs周围采用聚碳酸酯薄板(polycarbonate sheet)(透光率 80~90%)包裹,每个OTCs之间间隔5 m,并将底部固定于土壤中作为增温处理.用网眼为0.2 mm的钢丝网(<0.1 mm)包裹作为对照处理.在增温与对照样地内分别随机选择1个样方,安装土壤和空气温湿度测定仪(YM-01A),测定土壤0~20 cm土层和离地表30 cm处的温湿度变化,测定时间从2013年11月到2014年12月,采用植被生长季(5~9月)温湿度数据,OTC处理增高了土壤月平均温的0.73℃,降低了土壤月平均湿度的13.58%(表 1).生长季空气温度较对照升高了7.21℃,空气湿度较对照下降了4.8%(表2).
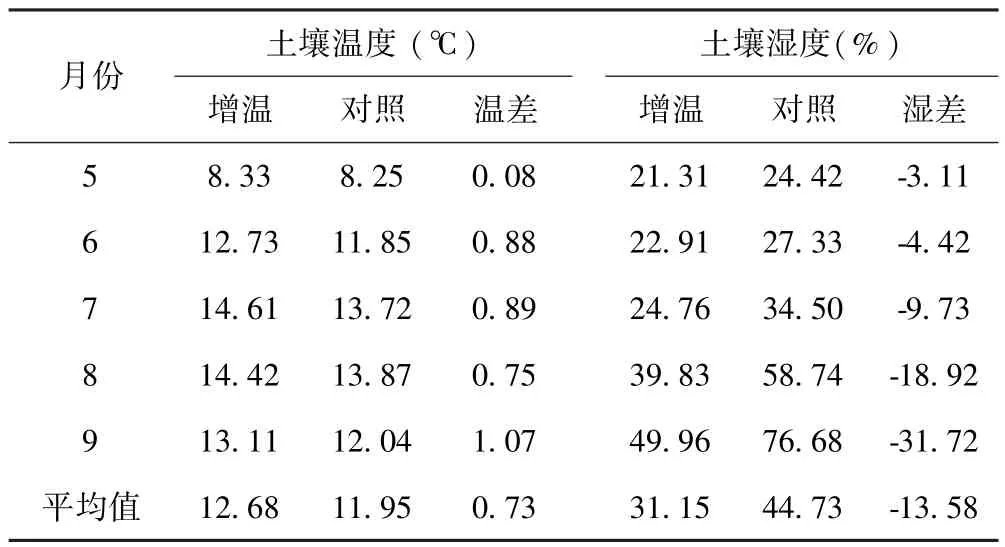
表1 土壤温湿度变化Table 1 Changes in soil temperature and humidity
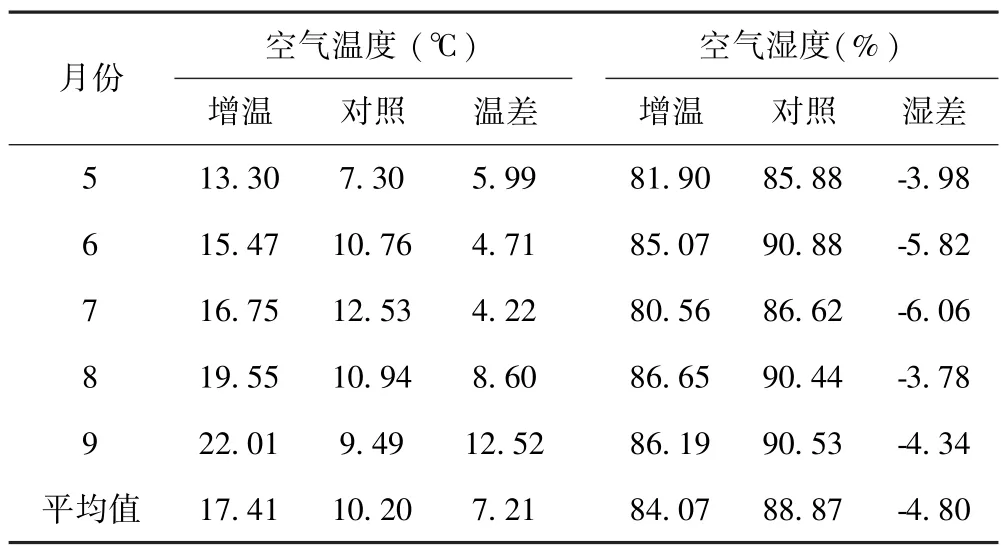
表2 空气温湿度变化Table 2 Changes in air temperature and humidity
2.2 样品采集
于2014年8月中旬在增温和对照处理中各选取3个样方,用土钻(直径3 cm)采用“V”字形法钻取5钻,按0-10 cm、10-20 cm土层分别取样,拣去石块和植被根系、枯落物等杂物后,一部分装入已经做好标记的采样袋,并迅速放入保鲜盒,立即带回实验室放入4℃冰箱保存,用于土壤微生物功能多样性的测定.另一部分同样进行标记,风干后过0.25 mm土壤筛,用于测定土养分.
2.3 土壤养分测定
土壤有机质(soil organic matter,SOM)、土壤全氮(total nitrogen,TN)、全磷(total phosphorus,TP)、全钾(total potassium,TK)、速效钾(available potassium,AK)、速效氮(available nitrogen,AN)、速效磷(available phosphorus,AP)含量测定方法参照文献[11].
2.4 土壤微生物功能多样性的测定与计算
采用Biolog-ECO生态板对0~10 cm和10~20 cm土层土壤样品中微生物功能多样性进行测定,每个土层进行3次重复.具体操作和计算参照Chaerun等[13]和党雯等[14]的方法.
土壤微生物多样性指数(Shannon-Weiner指数、Pielou指数、McIntosh指数)可以反映微生物群落物种及其个体分布均匀程度和丰富度,具体计算方法参考相关文献[11].
2.5 数据分析
采用SPSS 19.0对土壤养分数据、微生物群落多样性指数及底物碳源利用数进行单因素方差分析(one-way ANOVA),最小显著差数法(LSD法)进行多重比较(α=0.05).用Pearson相关系数评价AWCD值(Average well color development,AWCD)、微生物功能多样性指数、6类碳源利用能力与土壤养分间的相关关系.用CANOCO for Windows 5.0软件对培养72 h的土壤微生物进行主成分分析(principal component analysis,PCA)来解释土壤微生物功能特征的变化.
3 结果与分析
3.1 增温对高寒草甸土壤养分的影响
方差分析表明,增温后0~10 cm土层土壤有机质和速效氮含量较对照相比显著下降,而土壤速效磷和速效钾含量则上升;在10~20 cm土层,土壤有机质、全氮和速效氮含量显著高于对照.土壤全磷和全钾含量均没有显著变化(表3).
3.2 增温对高寒草甸土壤微生物功能多样性的影响
3.2.1 增温后高寒草甸土壤微生物平均吸光值(AWCD)变化特征
从图1中可以看出,不同处理土壤微生物的AWCD值在培养48 h内为接近为0,且无明显变化,表明微生物代谢活动不强,碳源基本上未被利用,随着培养时间的延长,在48 h到168 h内AWCD值急剧升高,底物碳源被大幅度利用消耗;在168 h以后,AWCD值仍继续增大,并逐渐趋于平缓,土壤微生物对底物的利用率降低,这符合微生物利用培养基质生长的一般情况.增温后的微生物总体活性明显高于对照处理,土壤微生物群落对碳源的利用能力表现为0~10 cm>10~20 cm,其中,增温后10~20 cm土层土壤微生物对碳源的利用消耗程度在培养144 h后高于表层土壤.
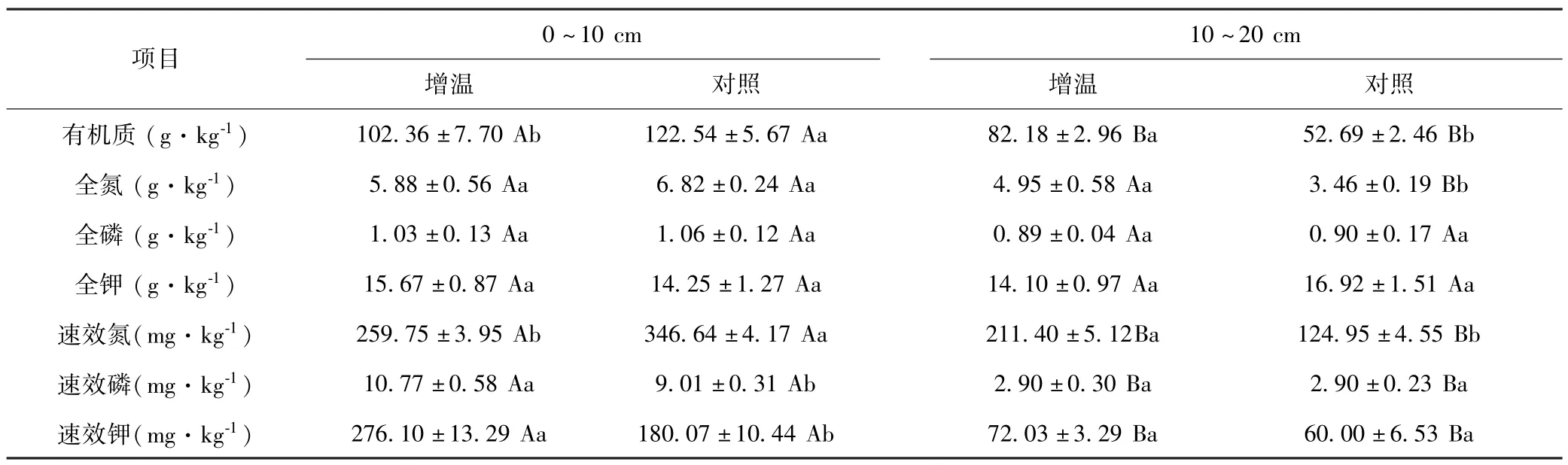
表3 增温对不同土壤深度高寒草甸土壤养分的影响Table 3 Effects of warming on soil nutrients in alpine meadow at different soil depths
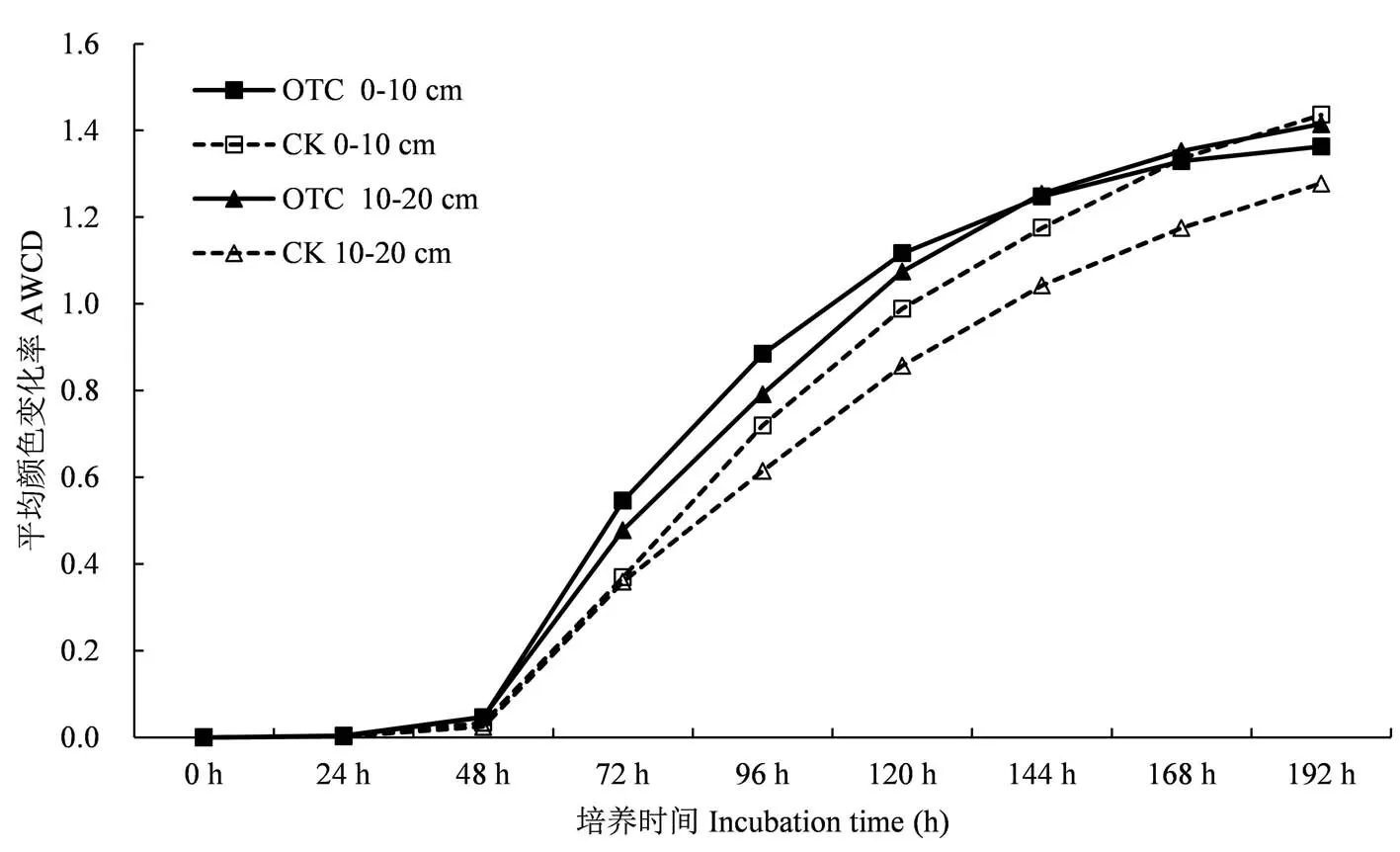
图1 增温对不同土层高寒草甸土壤微生物AWCD值的影响Fig.1 Effect of warming on soil microorganism AWCD value of different soil layers in alpine meadow.
3.2.2 高寒草甸土壤微生物群落功能多样性指数比较分析
如图2所示,土壤微生物群落在培养72 h后,McIntosh指数并没有表现出明显变化,而Shannon-Weiner指数和Pielou指数在同一土层均表现出OTCs<CK,在0-10 cm 土层分别降低了0.22、0.06,在10-20 cm分别降低了0.34和0.1.增温后0~10 cm土层土壤微生物碳源利用数显著高于10~20 cm土层,且10~20 cm土层土壤微生物碳源利用数显著低于对照.
3.3 高寒草甸土壤微生物群落对碳源利用的主成分分析
对0~10 cm和10~20 cm土层土壤微生物群落对碳源的利用分别进行主成分载荷因子分析(表4),结果表明,0~10 cm土层,主成分1和主成分2的累积贡献率为89.6%,10~20 cm土层前2个主成分数据变异贡献率为68.1%.在0~10 cm土层与PC1和PC2呈显著相关的碳源分别有13种和5种,即与PC1相关的碳源分别有4种碳水化合物类,4种氨基酸类,3类羧酸类,多聚物类和酚酸类各1种;与PC2相关的碳源分别有2种碳水化合物类,氨基酸类、羧酸类和多聚物类各1种.在10~20 cm土层分别有13种和2种碳源与PC1和PC2呈显著相关,即与PC1相关的碳源分别有8种碳水化合物类,2种羧酸类,氨基酸类、多聚物类和酚酸类各1种;各有1种碳水化合物类和多聚物类碳源与PC2相关.从图3中箭头的长短也可以看出碳水化合物是土壤微生物群落利用的主要碳源类型,氨基酸类、羧酸类、多聚物类和酚酸类次之.
图3中,除对照10~20 cm土层1个样品外,其余增温和对照样地较集中的分布于不同区域,表明微生物群落结构对碳源利用存在差异.增温后表层土壤微生物群落对碳源的利用高于10~20 cm土层,而低于对照样地表层土壤,而增温后10-20 cm土层土壤微生物群落对碳源的利用低于除对照10~20 cm土层1个样品外的其余2个样地.说明增温和土层深度对土壤微生物群落对碳源的利用均有影响.
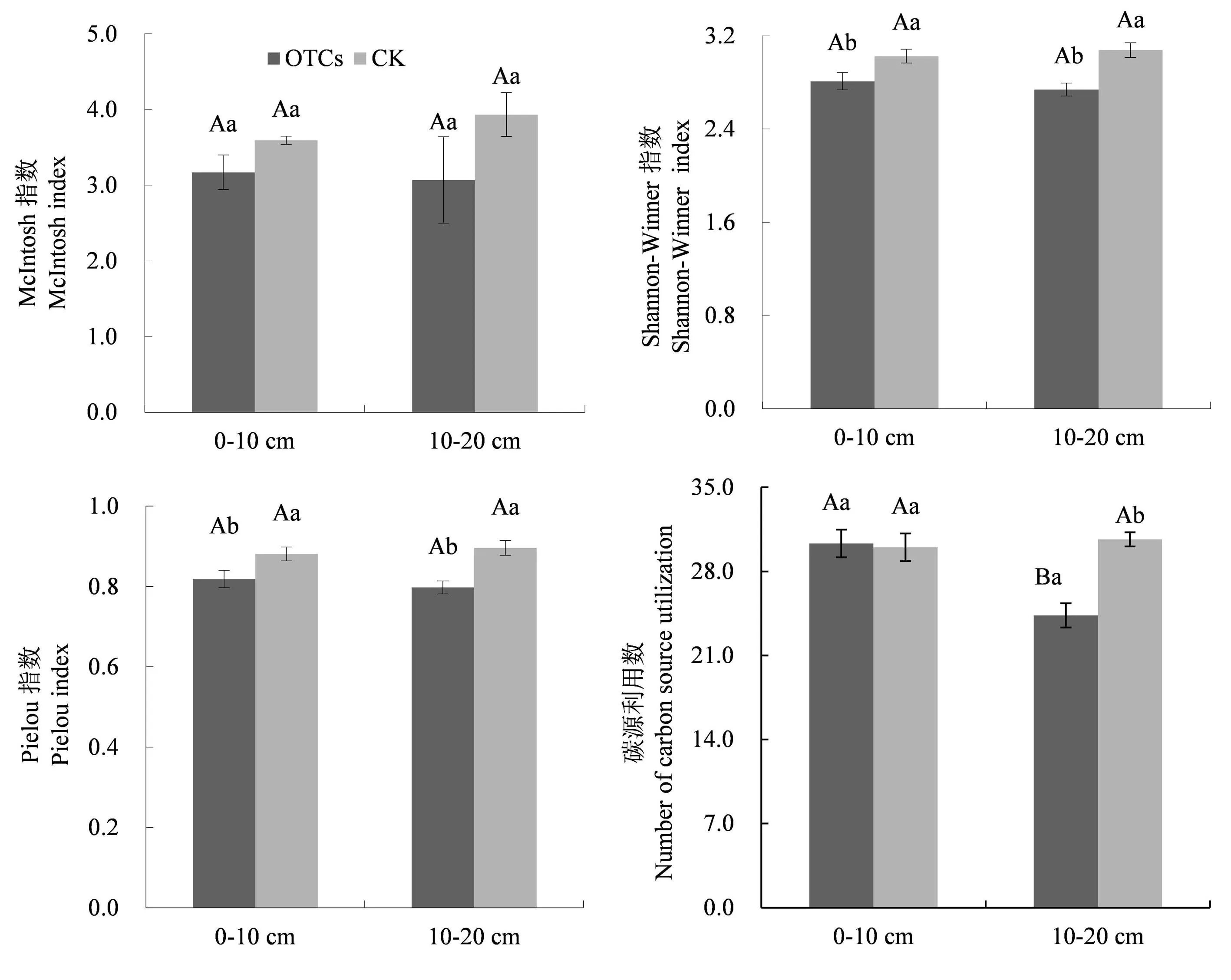
图2 增温对不同土层高寒草甸微生物群落功能多样性的影响Fig.2 Response of soil microbial functional diversity of alpine meadow soil microbial communities to warming at different soil depths

表4 主成分载荷因子Table 4 Loading factors of principal component
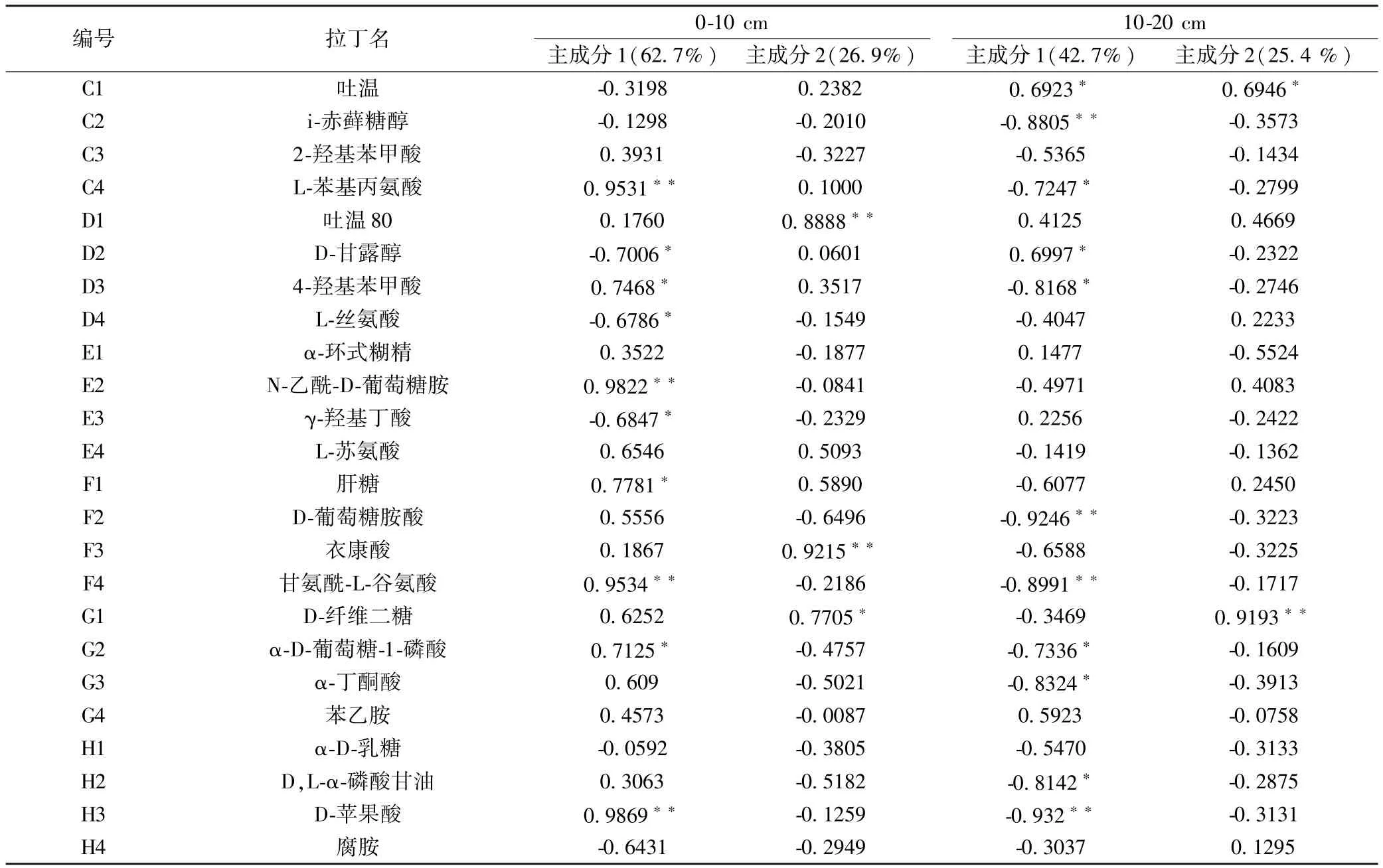
注:∗,∗∗:分别表示在0.05和0.01水平下显著相关(双尾检验).下同.
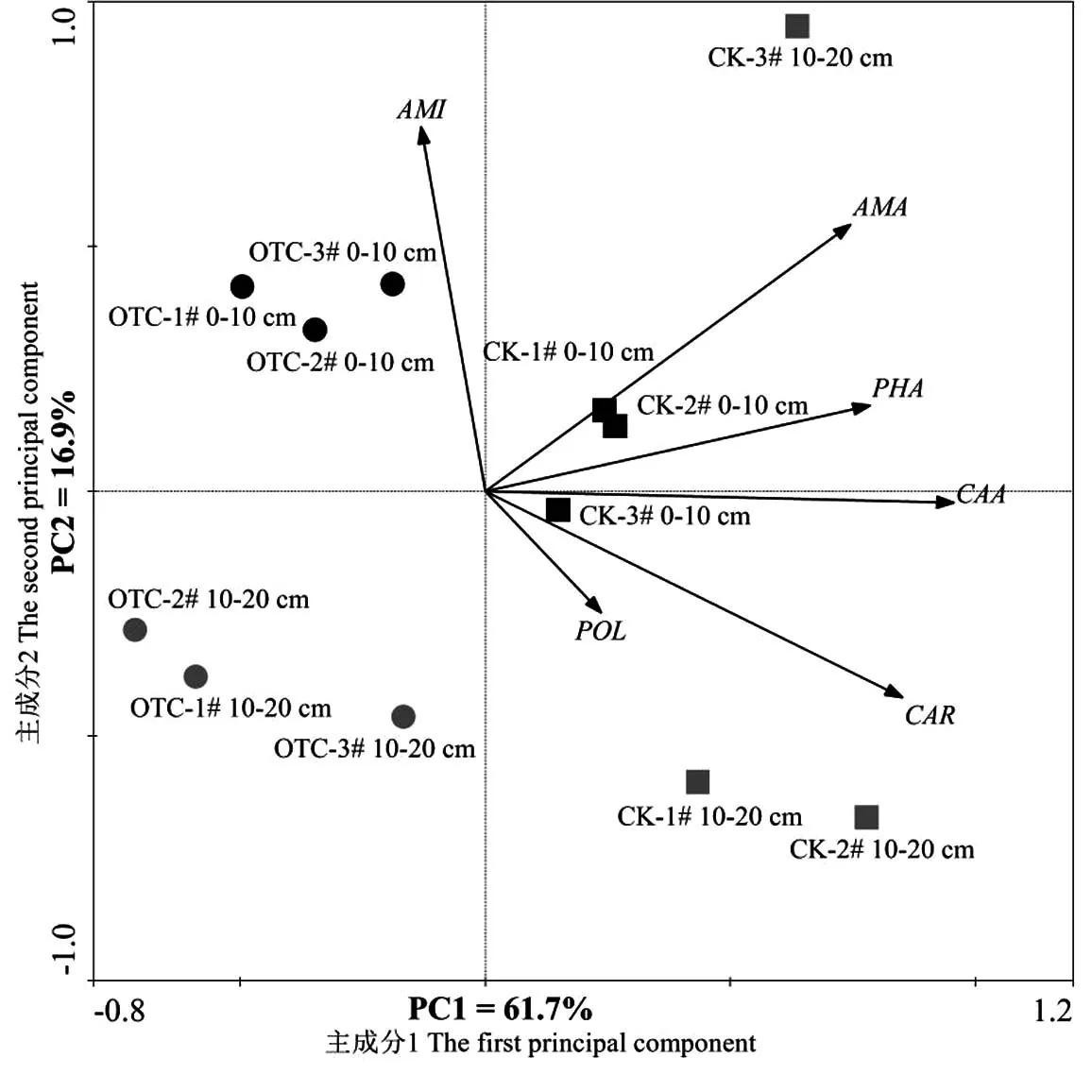
图3 增温后不同土层高寒草甸土壤微生物群落对碳源利用的主成分分析注:CAR:碳水化合物;AMA:氨基酸;CAA:羧酸;PLO:多聚物;PHA:酚酸;AMI:胺类 .Fig.3 PCA for carbon source utilization of soil microbial communities with warming at different soil depths
3.4 增温后高寒草甸土壤养分与6类碳源的相关性分析
不同土壤深度土壤养分与6类碳源的相关性分析表明,除AMA、AMI和POL与土壤养分均无显著相关性外,其余都有显著或者极显著相关.0-10 cm土层CAR与SOM呈显著正相关,与AP呈显著负相关(P<0.05),与AN呈极显著正相关,与AK呈极显著负相关(P <0.01);CAA与土SOM呈极显著正相关(P<0.01),与AN呈显著正相关,与AK呈显著负相关(P <0.05).PHA与TP呈显著正相关,与AP呈显著负相关(P <0.05).10-20 cm土层CAR与TK呈显著正相关(P <0.05);CAA与SOM、TN和AN呈显著负相关,与TK呈显著正相关(P <0.05);PHA与SOM、TN和AN都均呈极显著负相关(P <0.01)(表5).

表5 增温后不同土层土壤养分与6类碳源的相关性分析Table 5 Correlation analysis of soil nutrients and 6 types of carbon sources in different soil layers after warming
4 讨论
4.1 增温对高寒草甸土壤养分的影响
研究发现增温后高寒草甸0~10 cm土层土壤有机质含量高于对照,这可能是增温棚内的温度高于棚外温度,温度的升高加快了表层土壤中有机质的分解速率,从而导致有机质含量减少[15].土壤温度升高影响植物根系对水分的吸收,使植物根的呼吸代谢作用加强,加速了根系的衰老进程,从而增加了根系脱落物的积累,而且通过细根周转和死亡根系的分解而归还到土壤中的养分元素和有机质远远超过地上凋落物的归还量[16].草地植被根系大部分分布于0~10 cm土层中,随着土层深度的增加,其根系数量也会急剧减少[17],这就导致了土壤有机质在土壤中的垂直分布.同时,温度升高使表层土壤中有机质迅速分解,而有机质中的磷素和钾素以可溶性成分存在于土壤中,温度升高使土壤中难溶性磷酸盐的活化性增强,使矿物态的钾和次生矿物态的含钾矿物分解加速,增加了土壤中速效钾和速效磷的含量[18].有研究表明,温度和水分是影响土壤中氮含量的重要因素,土壤净氮矿化速率与土壤温度和水分变化呈正相关[19],增温棚的设置改变了棚内土壤的水热状况(表1和表2),因温度升高,增加了表层土壤中水分的蒸发,使表层土壤中速效氮的含量明显减少.另外,土壤类型、植被类型、地形地貌以及水分等环境因素都会造成土壤养分含量的变化[20].
4.2 增温对高寒草甸土壤微碳源利用代谢活性的影响
增温后高寒草甸土壤微生物群落总体活性明显高于对照处理,可能原因有:1)增温能够促进凋落物的分解速度,土壤微生物获得碳源数量增加(图2),微生物对碳源利用代谢能力也随之提高;2)高纬度地区年平均气温较低,一些适应低温生存的土壤微生物占优势,较低温度范围内温度升高,激活了这部分微生物的代谢活性[21];3)不同微生物群落有着其特定的温度适应范围,土壤微生物呼吸温度会随着土壤微生物群落结构的改变而发生变化[7];4)土壤氮素是影响土壤微生物碳源代谢的重要原因之一,与土壤微生物的代谢能力呈正相关关系[22],本试验中,10~20 cm土层氮素含量显著高于0~10 cm土层中的含量,这可能是本试验中为什么增温后10~20 cm土层土壤微生物碳源利用代谢活性在培养144 h后高于0~10 cm土层的原因.存在问题:有研究表明水分含量与AWCD值呈显著正相关[22-23],而在本研究中,增温棚内的土壤湿度低于对照,这可能还与土壤pH、酶活性的相互作用,以及微生物的生理生化特性、种群结构和群落组成等因素有关,需进一步研究探讨.
同一土层深度土壤微生物Shannon-Weiner指数和Pielou指数与对照相比均在增温后有所下降.在侯晓杰[24]等人的研究中,同一施肥条件下覆盖地膜后,土壤微生物Shannon-Weiner指数与裸地相比有所降低,这可能是因为增温棚和覆盖地膜都提高了土壤温度,温度的改变导致了土壤环境的改变,从而改变了微生物多样性.也可能与植物群落结构有关,一方面,植物群落结构组成差异导致了凋落物和根际分泌物差异,使土壤微生物的能量来源存在差异,土壤微生物群落结构也发生变化[25].另一方面,土壤微生物群落多样性与地上植被群落的生产力呈正相关[26],长期增温后,地上生物量明显减少,植物的生长发育受到一定的限制,植物的生产力降低[27],从而导致土壤微生物多样性降低.
4.3 增温对高寒草甸土壤微生物群落功能多样性的影响
PCA分析表明(图3),碳水化合类、氨基酸类、羧酸类、酚酸类以及胺类都与各主成分间有显著相关性,说明土壤微生物利用的碳源主要是它们,其中碳水化合物类碳源是土壤微生物利用的最主要的碳源之一.土壤养分与碳源的相关性分析说明土壤养分对土壤微生物碳源代谢功能有不同程度的影响,且除了胺类与多聚物类碳源与土壤养分没有显著相关性之外,其余都与土壤养分有不同程度的相关性.枯枝落叶和植物根系中的有机成分限制了土壤资源的有效性,土壤微生物获取资源的能力也存在异质性,且在不同的时间和空间尺度上植物的生产力水平往往也影响着土壤微生物群落生物量和功能[28].郑琼[29]等人的研究表明不同火烧强度对土壤微生物对碳源的利用能力有利弊作用,即短期内土壤温度大幅度升高后,土壤微生物对碳源的利用能力表现为先升高后抑制.此外,增温改变了土壤环境,导致土壤养分发生改变,土壤微生物多样性与土壤养分和根系分泌物密切相关,相互影响,从而改变了土壤微生物群落结构功能,微生物代谢活性也随之受到影响[24].
5 结论
通过对模拟增文后土壤养分和微生物功能多样性的研究,得出以下结论:模拟增温虽然显著提高了土壤微生物碳源代谢活性,但降低了土壤微生物对碳源的利用率,土壤微生物功能多样性的降低主要与增温降低了土壤中有机质和速效氮含量有关.
