β-氨基丁酸处理对采后草莓果实贮藏品质和内部还原势的影响
2018-11-14伍冬志费良航廖云霞陈偲汪开拓
伍冬志,费良航,廖云霞,陈偲,汪开拓*
1(重庆三峡学院 环境与化学工程学院,重庆,404000) 2(重庆三峡学院 生命科学与工程学院,重庆,404000) 3(南京农业大学 食品科技学院,江苏 南京,210095)
草莓(FragariaananassaDuch.)为最重要的全球性大宗水果之一,产销需求旺盛。但采后草莓果实蒸腾作用和呼吸强度旺盛,贮藏期间失水较为严重,品质劣变迅速;同时,果实无外皮保护,内部组织娇嫩多汁,故极易遭受病原菌的侵染而发生腐烂。低温贮藏是延长草莓果实货架期的有效方法,但由于采后草莓果实主要致病菌——灰葡萄孢(Botrytiscinerea)的孢子可在较低的温度下(-1~5 ℃)存活并萌发,因此单纯的低温贮藏不能从根本上抑制果实灰霉病的发生[1]。常规的化学杀菌剂如特克多、波尔多液和咪唑霉处理可有效抑制果实采后病害的发展,但长期施用会对农业生产环境及食品安全造成严重的不利影响[2]。通过绿色激发子处理来诱导果实自身抗病性可有效抑制病原菌侵染,显著降低化学药剂使用量,故日益受到食品或农业从业者的关注[3]。
从诱导抗病的角度来说,内部还原势的状态直接关联植物诱导抗病性:抗性激发子或病原菌可直接诱导植物内部还原性信号分子、还原型谷胱甘肽(GSH)和辅酶II(NADPH)等还原性小分子物质的大量生成,从而使植物细胞核中还原势显著提升,最终作用于大量可调控诱导病程相关(pathogensis-related proteins,PRs)基因的转录因子,释出大量具有转录活性的单体物质,从而启动一系列防卫反应[4]。我们先期研究也发现,经水杨酸(SA)类似物苯丙噻唑硫代乙酸甲酯(BTH)处理的葡萄果实中还原性物质含量显著增加,同时病程相关基因非表达子基因(Nonexpressor of pathogenesis-related genes 1,NPR1)表达量也急剧上升,故可推测还原势的上升与抗病性反应存在直接关系[5]。BABA是一种小分子非蛋白类氨基酸,可直接作为信号分子来诱导樱桃[6]、草莓[7]、葡萄[8]和水蜜桃[9]等多种果实活性氧迸发、抗病相关物质合成和PRs基因表达等抗病性反应,从而降低贮藏期间果实腐烂率。6-AN(6-氨基烟酰胺)是磷酸戊糖途径(pentose phosphate pathway,PPP)抑制剂,可显著抑制NADPH的生成[10]。本研究在先期成果的基础上,分析了BABA和6-AN处理对草莓果实品质参数、还原性信号分子生成量、磷酸戊糖途径关键酶活性、还原性物质积累以及PRs基因表达的影响,以期明确还原势对果实诱导抗性的调控作用。
1 材料与方法
1.1 材料
大小一致、转色均匀的八分熟草莓果实(品种“丰香”)采摘于重庆市潼南区双江镇有机草莓种植基地,采后即刻运回实验室,剔除存有机械伤和病虫害果实,平铺于操作台上用20 ℃强制冷风吹去田间热。
β-氨基丁酸(BABA),美国Sigma公司;6-氨基烟酰胺(6-AN),上海aladdin试剂公司;谷胱甘肽还原酶(GR),上海源叶生物科技有限公司;NO检测试剂盒、NADP+/NADPH检测试剂盒、GSH/GSSG检测试剂盒,南京建成生物工程研究所;Tripure Isolation Reagent试剂盒、SuperScript II试剂盒,美国Invitrogen公司。
PAL-1型数显糖度计,日本Atago公司;E-201C型酸度计,上海雷磁公司;DW-86L338J型超低温冰箱,海尔公司;UV2600i紫外可见分光光度计,日本岛津公司;DK-98-II型电热恒温水浴锅,天津市泰斯特仪器有限公司;BSC-150恒温恒湿培养箱,上海博迅医疗生物仪器股份有限公司;DYCP-31D型核酸电泳仪,北京六一仪器厂;PTC-200型RT-PCR仪器、Gel Doc XR型凝胶成像仪,Bio-Rad公司。
1.2 处理
我们先期研究证实,10 mmol/L BABA处理可显著诱导草莓果实抗病性反应,从而显著抑制果实在低温或常温贮藏期间灰霉病的发生[7]。因而,本研究以此BABA浓度为基础开展后续研究。
草莓果实经70 %酒精仔细擦拭表面后随机分为4组:(1)对照组,果实不经任何处理;(2)BABA处理组,用10 mmol/L BABA溶液对果实进行喷洒处理,在此过程中,不断旋转果实以使喷洒均匀,随后强制风吹干;(3)6-AN处理组,用5 mmol/L 6-AN对果实进行喷洒处理,随后强制风吹干;(4)BABA+6-AN处理组,先用10 mmol/L BABA溶液对果实进行喷洒处理,强制风吹干后再用5 mmol/L 6-AN对果实进行喷洒处理。操作温度均保持在(20±1) ℃。处理结束后,将草莓果实分装于聚乙烯塑料盒中,在(20±1) ℃、80%~90% RH的培养箱中贮藏5 d。在贮藏期间每天观察草莓果实发病情况,并切取健康果肉组织在液氮中速冻,最后于-80 ℃超低温冰箱中存放备检。每个处理不少于200颗果实,各处理均重复3次,整个实验重复2次。
1.3 测定指标及方法
1.3.1 发病率
当果实表面出现明显霉菌斑点时即记录为病果。

(1)
1.3.2 品质参数测定
切取健康草莓果肉用榨汁机榨取果汁后进行测定。用数显糖度计直接测定果汁中可溶性固形物含量;用0.01 mol/L NaOH溶液直接将10 mL果汁滴定至pH 8.2,根据消耗量来计算可滴定酸(TA)含量;用酸度计直接测定果汁pH值[11]。
1.3.3 抗氧化活性、总花色苷和酚类含量测定
取5 g果肉冻样用50 mL冷丙酮匀浆,再以 5 000×g离心10 min(4 ℃)后取上清液测定相关指标。采用pH示差法[12]测定果实总花色苷含量,用Flion-Ciocalteu法[13]测定总酚含量。参考SHE等[14]方法测定DPPH自由基清除率和总还原力,总还原力以700 nm吸光值进行表示。
1.3.4 水杨酸(SA)和一氧化氮(NO)含量的测定
参考龚波林[15]的方法,利用水杨酸的溴代反应生成的2,7-二氯荧光素-Br2-水杨酸反应物,通过荧光法测定果实痕量SA含量;NO含量的测定参考MURPHY和NOACK[16]的方法,以高铁血红蛋白法进行测定。
1.3.5 NADPH和NADP+以及GSH和GSSG含量的测定
NADPH和NADP+参考NAGANO等[17]的硫酸甲酯吩嗪反应法进行测定;GSH和GSSG参考RAHMAN等[18]的酶循环法,利用与5,5′-二硫硝基苯甲酸的反应来进行测定。
1.3.6 葡萄糖-6-磷酸脱氢酶(G6PDH)和6-磷酸葡萄糖酸脱氢酶(6PGDH)活性的测定
称取2 g果实冻样, 加入10 mL内含30 mmol/L甘露醇、5 mmol/L MgSO4、5 mmol/L KCl和1 mmol/L EDTA的50 mmol/L Tris-HCl缓冲液(pH 7.2)仔细匀浆,再以5 000×g离心10 min(4 ℃)后取上清液测定酶活性。G6PDH和6PGDH活性参照INDEL等[19]的方法进行测定,略有改进。3 mL G6PDH反应体系中包含0.8 mL粗酶液、1.1 mL 10 mmol/L NADP+溶液和1.1 mL 10 mmol/L 6-磷酸葡萄糖溶液;3 mL 6PGDH反应体系中包含1.0 mL粗酶液、0.7 mL 10 mmol/L NADP+溶液、0.7 mL 10 mmol/L 6-磷酸葡萄糖酸溶液和0.6 mL提取缓冲液。反应液中每分钟生成1 nmol NADPH为1个酶活力单位,以U/mg蛋白表示结果。用考马斯亮蓝比色法测定提取液中蛋白质含量[20]。
1.3.7PRs基因表达丰度的测定
取1 g果实冻样使用Tripure Isolation Reagent试剂盒提取RNA。取1 mg RNA采取SuperScript II试剂盒逆转录cDNA第一链,Oligo(dT)为引物。用Primer Premier 7.0软件设计相关基因特异性引物(表1)。以草莓18S rRNA基因为内参。扩增产物经琼脂糖凝胶电泳分离,用EB染色后用凝胶成像仪扫描并定量分析[21]。
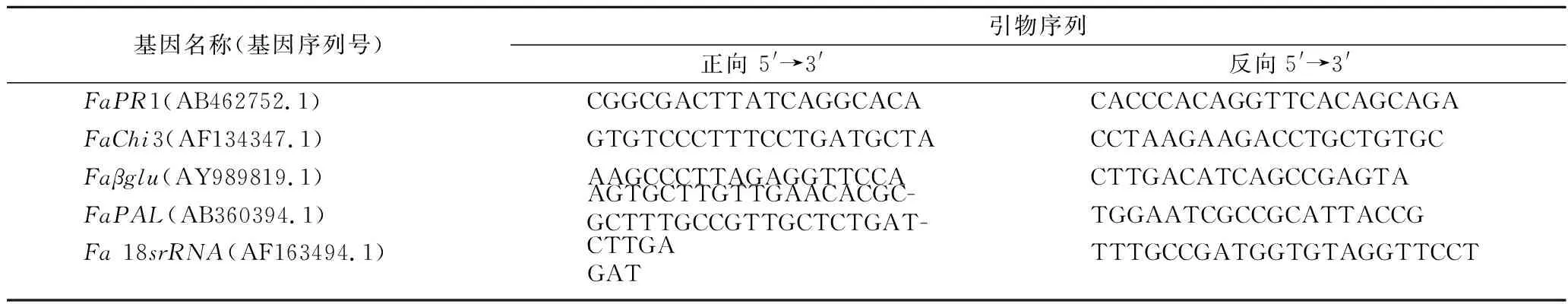
表1 草莓PRs基因特异性引物序列Table 1 Sequence of primers used for PRs genes in strawberries
1.4 数据分析
果实发病率重复测定5次,其余指标均重复测定3次。采取Duncan多重比较法(SPSS 13.0)进行差异显著性检验,5%和1%记录为显著和极显著水平。
2 结果与分析
2.1 BABA和6-AN处理对草莓果实贮藏期间发病率、品质参数和抗氧化活性的影响
如图1所示,草莓果实在贮藏期间果实病害发生率逐渐上升。
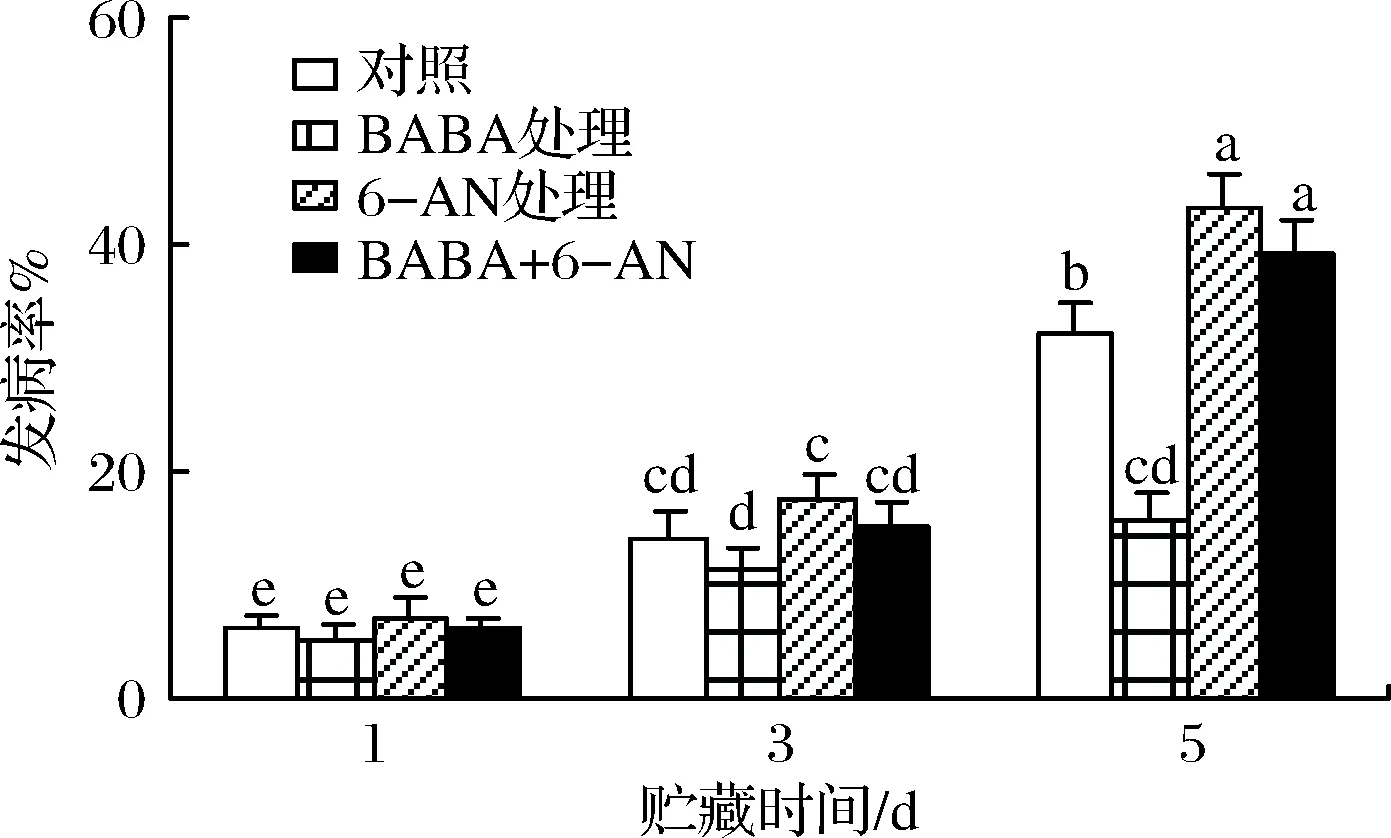
图1 BABA和6-AN处理对草莓果实贮藏期间发病率的影响Fig.1 The effects of BABA and 6-AN treatments on diseaseincidence on strawberries during 5 days of storage
对照果实在贮藏5 d后,其发病率达到31.1%;BABA处理可显著(p<0.05)抑制果实贮藏期间发病率的上升,经BABA处理的果实在贮藏结束时发病率较对照水平下降了51.6%。单一6-AN处理或BABA+6-AN复合处理则均加剧了果实病害的发生,果实发病率在贮藏结束时分别较对照水平上升了34.2%和22.1%。
同时,草莓果实经10 mmol/L BABA处理后,其TSS、总花色苷和总酚含量以及DPPH自由基清除率和总还原力均显著(p<0.05)高于对照组水平;TA含量和pH值则与对照果实相比无显著差异。单一6-AN和BABA+6-AN复合处理显著降低了果实各项品质指标和抗氧化活性,至贮藏5 d后,除pH值外,果实中其他各品质指标数值以及DPPH自由基清除率和总还原力均显著(p<0.05)低于对照组水平(表2)。
2.2 BABA和6-AN处理对草莓果实贮藏期间NO和SA含量的影响
如图2所示,对照草莓果实NO含量在整个贮藏期间基本维持稳定,而SA含量则随贮藏时间的延长而逐渐下降;经BABA处理的果实中NO含量在贮藏1 d后明显上升,并在随后贮藏时期内均显著(p<0.05)高于对照果实,同时BABA处理也显著延缓了果实SA含量的下降,使SA含量在整个贮藏期间均显著(p<0.05)高于对照果实。单一6-AN处理及BABA+6-AN处理均抑制了草莓果实中NO和SA生成量,经6-AN处理的果实中NO和SA含量在整个贮藏周期均显著(p<0.05)低于对照果实。
2.3 BABA和6-AN处理对草莓果实贮藏期间NADPH和NADP+含量的影响
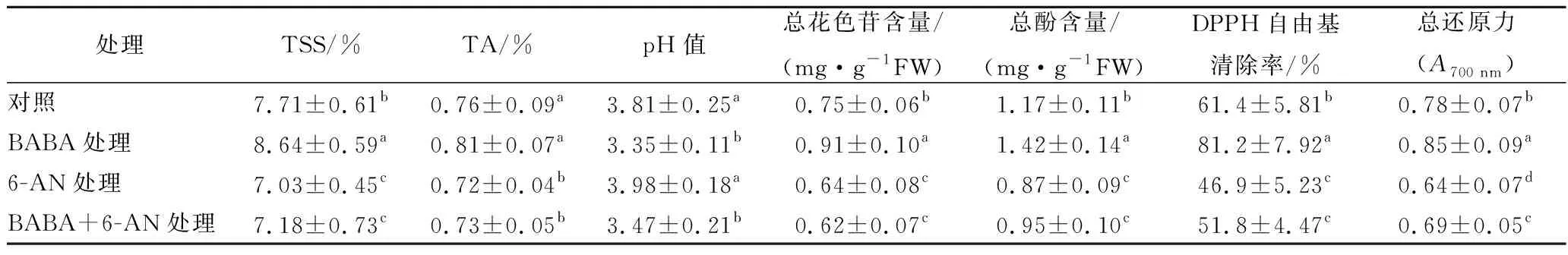
表2 BABA和6-AN处理对草莓果实贮藏5 d后品质参数和抗氧化活性的影响Table 2 The effects of BABA and 6-AN treatments on quality parameters and antioxidant activities instrawberries after 5 days of the storage
注:各列数据存有不同字母即存有差异性显著(p<0.05)。
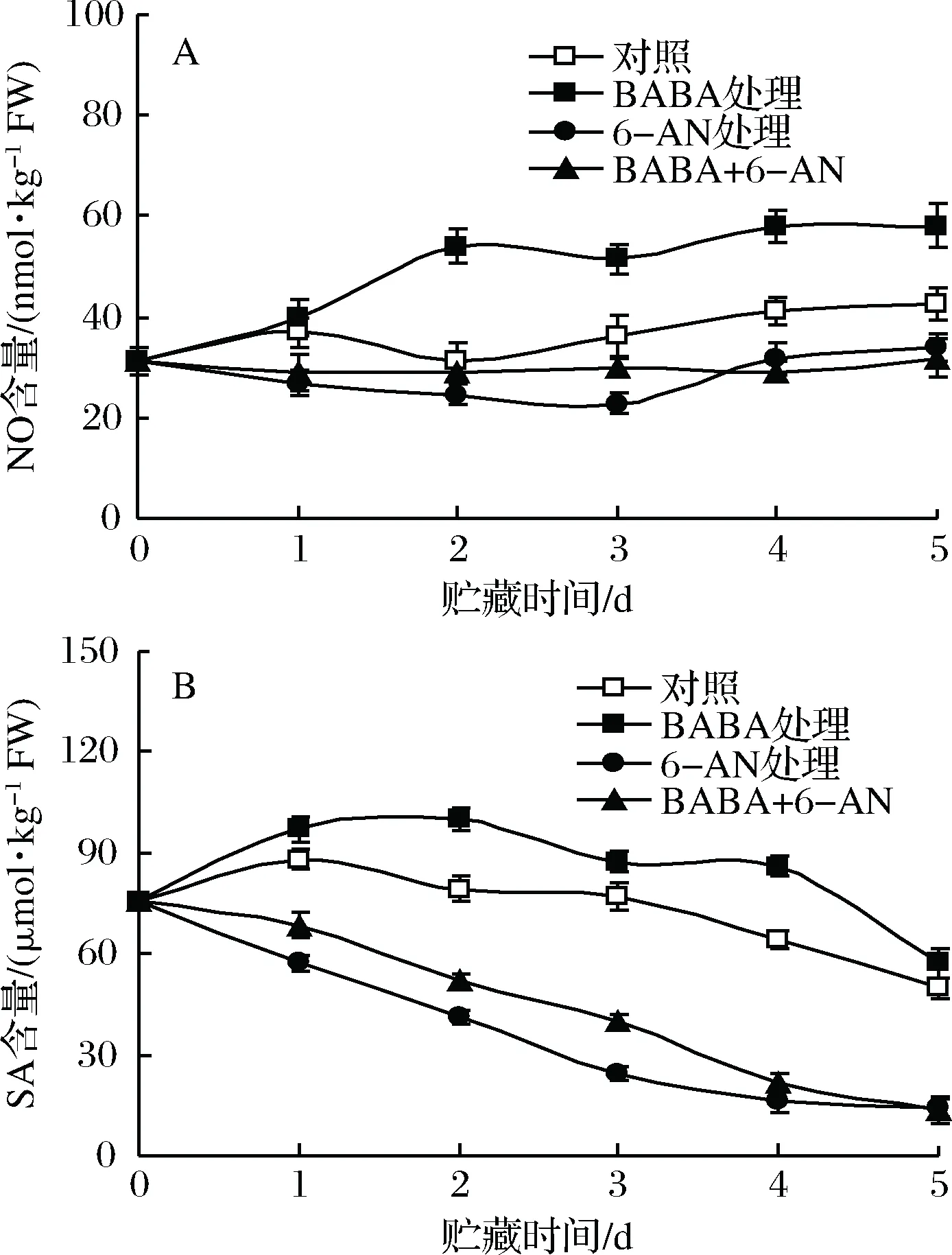
图2 BABA和6-AN处理对草莓果实贮藏期间NO(A)和SA(B)含量的影响Fig.2 The effects of BABA and 6-AN treatments oncontents of NO (A) and SA(B) in strawberries during5 days of storage
如图3所示,在20 ℃ 贮藏期间,对照草莓果实中NADPH含量在贮藏前2 d逐渐上升,随后缓慢下降;GSSG含量则基本维持稳定。10 mmol/L BABA可促进果实NADPH生成,并降低NADP+的积累。经6-AN或BABA+6-AN处理的果实中NADPH含量在整个贮藏期间均显著(p<0.05)低于对照果实;同时,经6-AN或BABA+6-AN处理的果实中NADP+含量则在贮藏后3 d均显著(p<0.05)高于对照果实。单一6-AN处理较BABA+6-AN处理更为显著(p<0.05)的提升了果实NADP+含量。
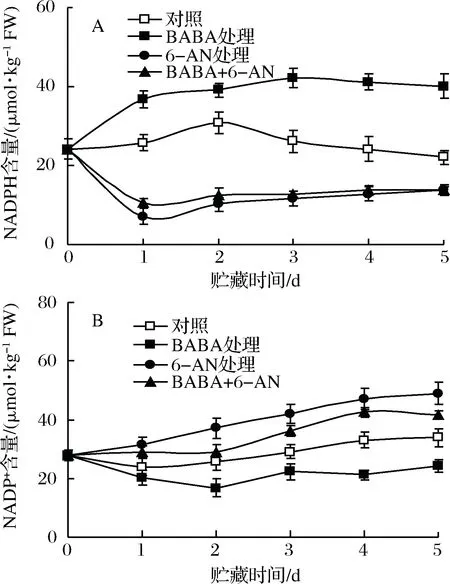
图3 BABA和6-AN处理对草莓果实贮藏期间NADPH(A)和NADP+(B)含量的影响Fig.3 The effects of BABA and 6-AN treatments oncontents of NADPH (A) and NADP+ (B) in strawberriesduring 5 days of storage
2.4 BABA和6-AN处理对草莓果实贮藏期间GSH和GSSG含量的影响
对照草莓果实中GSH含量在贮藏期间呈缓慢下降趋势,而GSSG含量则逐渐上升。经BABA处理的果实中GSH含量迅速上升,其含量在贮藏2 d后均显著(p<0.05)高于对照果实;6-AN处理显著(p<0.05)抑制了果实中GSH产生,经单一6-AN或BABA+6-AN处理的果实中GSH含量在整个贮藏期间显著(p<0.05)低于对照果实(图4-A)。经BABA处理的果实中GSSG含量逐渐下降,但经单一6-AN或BABA+6-AN处理的果实中GSSG含量在整个贮藏时期内均显著(p<0.05)高于对照果实(图4-B)。
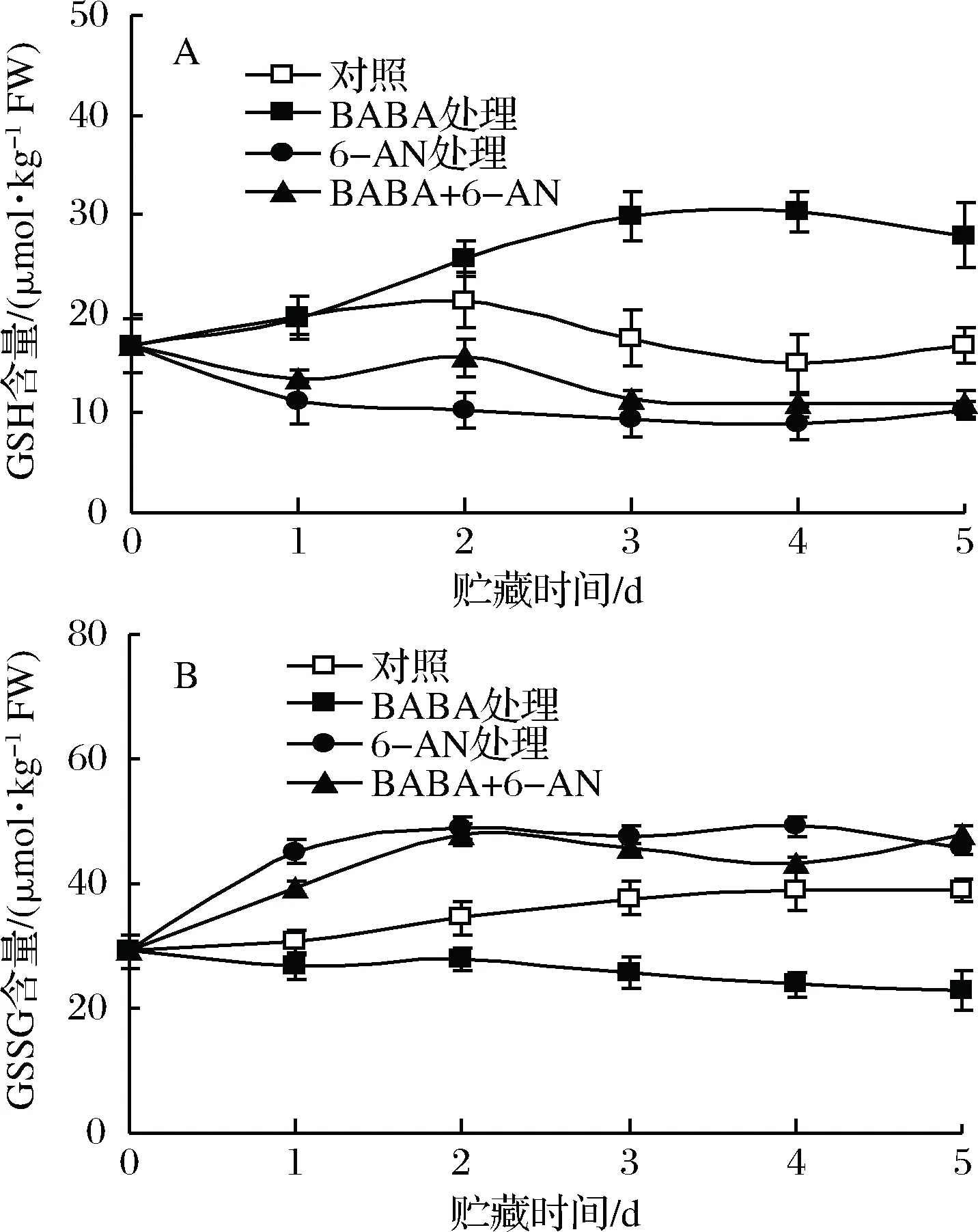
图4 BABA和6-AN处理对草莓果实贮藏期间GSH(A)和GSSG(B)含量的影响Fig.4 The effects of BABA and 6-AN treatments oncontents of GSH (A) and GSSG (B) in strawberries during5 days of storage
2.5 BABA和6-AN处理对草莓果实贮藏期间G6PDH和6PGDH活性的影响
在20 ℃贮藏期间,对照草莓果实中G6PDH活性逐渐降低,而6PGDH活性则缓慢上升。BABA处理有效延缓了果实G6PDH活性的下降并在贮藏2 d后诱导了6PGDH活性的上升,使2种酶活性在贮藏2 d后均显著高(p<0.05)于对照果实。单一6-AN处理或BABA+6-AN处理显著降低了果实中G6PDH和6PGDH活性,经6-AN处理的果实中G6PDH在整个贮藏期间显著(p<0.05)低于对照果实,同时6PGDH活性也在贮藏2 d后显著(p<0.05)低于对照水平(图5)。
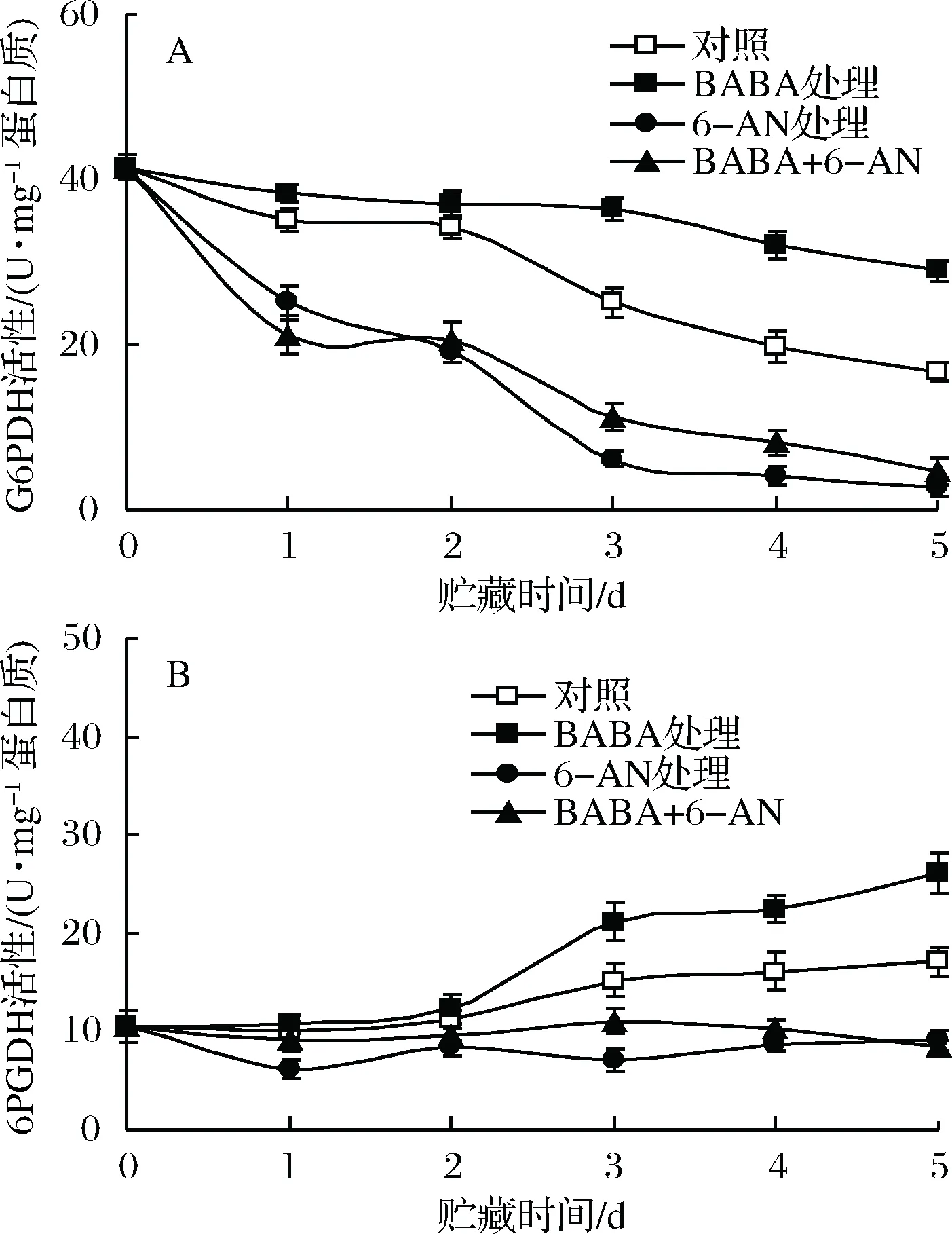
图5 BABA和6-AN处理对草莓果实贮藏期间G6PDH(A)和6PGDH(B)活性的影响Fig.5 The effects of BABA and 6-AN treatments onactivities of G6PDH (A) and 6PGDH (B) in strawberriesduring 5 days of storage
2.6 BABA和6-AN处理对草莓果实贮藏期间PRs基因表达丰度的影响
如图6所示,对照草莓果实中FaPR1、FaChi3、Faβglu和FaPAL等PRs基因表达量在整个贮藏期间均无显著(p>0.05)变化。经BABA处理的草莓果实在整个贮藏期间PRs基因表达量均显著(p<0.05)高于对照水平;单一6-AN处理或BABA+6-AN处理则抑制了这些PRs基因表达量的上升,使FaPR1、FaChi3和FaPAL基因表达丰度在贮藏期间均显著(p<0.05)低于对照果实。
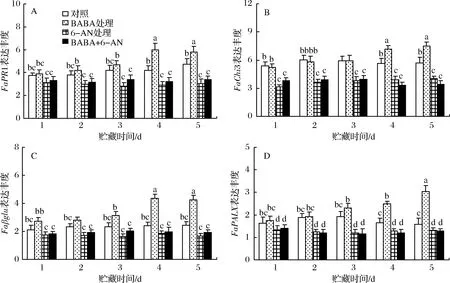
图6 BABA和6-AN处理对草莓果实贮藏期间FaPR1(A)、FaChi3(B)、Faβglu(C)和FaPAL基因(D)表达丰度的影响Fig.6 The effects of BABA and 6-AN treatments on expression levels of FaPR1 (A),FaChi3 (B),Faβglu (C) and FaPAL (D) in strawberries during 5 days of storage
3 讨论
BABA可通过信号传导的方式显著诱导多种果实抗病性反应[22]。我们先期研究发现,10~500 mmol/L BABA处理可有效诱导草莓[7]、葡萄[8]和水蜜桃[9]等果实活性氧迸发和抗病相关酶活性的上升,提升果实抗病性,从而抑制果实采后腐烂的发生。SA和NO是重要的传导分子,可直接调控下游抗病基因的表达[23]。PR1基因是典型的植物抗病基因标记物[24];PAL基因经转录翻译后可合成苯丙烷类关键酶PAL,从而诱导植保素、酚类物质及木质素等抗病物质的合成[25];Chi和βglu基因经转录翻译后可合成细胞壁水解酶几丁质酶和β-1,3-葡聚糖酶,可降解真菌细胞壁[26]。在本研究中,10 mmol/L BABA处理显著提升了草莓果实中抗性信号分子NO和SA积累量并诱导了FaPR1、FaChi3、Faβglu和FaPAL等PRs基因表达量的上升,同时经BABA处理的果实发病率也显著降低而贮藏品质和抗氧化物质含量则明显提高。这说明,BABA可在草莓果实内部进行有效的联级信号传导,促使抗性信号分子的积累,从而进一步诱导PRs基因的表达,最终抑制了果实病害的发生并维持果实品质。与此结果相类似,经BTH或茉莉酸甲酯(MeJA)处理的葡萄果实中,其NO含量也急剧上升,并伴随着PRs基因的表达,从而降低了果实采后灰霉病[4,27]。
通常情况下,植物受到病原胁迫后,其组织内活性氧会瞬时迸发,进而使植物组织产生大量应激性还原反应,促进抗氧化酶活性以及还原性物质如NADPH、GSH和抗坏血酸含量的迅速升高,从而降低组织内氧化势,提高还原势;而高还原势可将众多与抗病相关的转录因子转化为活性单体,最终诱导下游PRs基因表达[28]。对拟南芥的研究发现,经SA处理或病原菌侵染后,该模式作物组织中H2O2含量在瞬时急剧上升后迅速下降,但还原性成分如NAPDH却大量生成,从而使细胞中氧化势下降而还原势上升,将活性较低的WRKYs和TGAs等转录因子共聚体还原为单体形式,从而启动一系列下游防卫反应。因此,植物内部还原势的状态直接关联植物诱导抗病性。SA和NO既是抗病信号传导分子,亦作为还原性物质能直接调控植物内部还原势[23]。另一方面,PPP途径是在生命体中普遍存在的糖代谢支路,是戊糖分解的必经途径,可使葡萄糖直接氧化脱氢并脱羧以提供生物合成的还原剂NADPH和核酸合成的原料核糖,因此可提高细胞还原势并提供各种生化反应原料。G6PDH和6PGDH是该途径的限速酶,其活性与NADPH合成量存有极高正相关性[31]。6-AN可高效阻遏PPP途径中的电子传递,能专一性的抑制NADPH合成[10]。在本研究中,BABA处理可显著提高草莓果实内源还原性信号分子NO和SA生成量以及GSH含量;同时,BABA处理也同时诱导G6PDH和6PGDH活性的提高,进而促进NADPH的合成。因此,BABA处理可有效提高草莓组织还原势。与此相反,单一6-AN或BABA+6-AN处理则显著降低了果实中NO、SA和GSH的含量,抑制G6PDH和6PGDH活性和NADPH的积累,而同时果实中NADP+和GSSG含量则明显上升,这说明6-AN显著降低了果实还原势。伴随着草莓果实还原势的变化,经BABA处理的果实中PRs基因表达丰度明显上升,果实发病率显著降低;而经单一6-AN或BABA+6-AN处理的果实中PRs基因的表达受到明显抑制,果实发病率急剧增加,暗示6-AN处理导致的果实还原势降低严重限制了BABA诱导抗性的形成。因此,BABA诱导草莓果实抗病性的机理可解释为:BABA处理可通过直接诱导还原性信号分子的生成,并通过调控PPP途径关键酶活性以积累还原性物质,全面增强草莓果实内部还原势,从而诱导一系列PRs基因的表达,最终提高果实抗病性并抑制了草莓果实贮藏期间腐烂的发生。
4 结论
(1)10 mmol/L BABA处理可显著降低草莓果实贮藏期间的腐烂率并维持果实品质。
(2)10 mmol/L BABA处理可提升草莓果实还原势,从而提高PRs基因表达丰度以形成果实抗病反应。
