脂肪类型对乳化肉糜中蛋白膜形成情况的影响
2018-11-14周纷郑金月孙迪许帅强刘登勇邵俊花
周纷,郑金月,孙迪,许帅强,刘登勇,邵俊花,*
1(渤海大学 食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013) 2(上海海洋大学 食品学院,上海,210306)3(沈阳农业大学 食品学院,辽宁 沈阳,110866)
在乳化型肉糜产品生产过程中,蛋白质通过产生乳化作用来稳定和改善肉糜的乳化性质,因而蛋白质可作为乳化剂使用[1]。其中,在斩拌过程中通过加水或者盐提取出来的盐溶性蛋白质分3种形式存在:蛋白凝胶基质、水溶相和脂肪球表面的蛋白膜[2]。此外,研究发现通过对油-水-蛋白质三相体系进行均质,蛋白质分子可以迅速地吸附到油滴表面,在界面形成保护膜,严密地将油滴裹住,基于蛋白质在油滴间产生排斥作用以及蛋白膜抵抗对乳化体系被破坏的能力,使油滴与油滴之间隔开,阻止小油滴间的聚集,最终形成水包油型乳浊液[2-4]。
在乳化体系中,以肌球蛋白为主的蛋白质群功能特性主要表现为:在脂肪球表面形成具有黏性和高强度膜的能力以及在热诱导下形成三维黏弹性凝胶网络结构的能力[5-6]。一般来讲,蛋白质吸附在脂肪球表面发生乳化反应包括2个主要的分子活动:蛋白质在油脂分子表面的定位和随后利于吸附的构象重排[7]。在乳化过程中,盐溶性肌原纤维蛋白分子会部分展开,同少量肌浆蛋白吸附在脂肪球表面,形成一个半刚性的界面蛋白膜,降低水油间界面张力[8]。蛋白质和脂肪的理化特性以及相互作用影响乳化的形成及其最终产品的质构特性[9-11]。MILANI等[12]研究发现半乳甘露聚糖、黄原胶和果胶等均可以通过改变表面或界面的张力和吸附能力来改善油水界面的稳定性。ZOU等[13]研究发现玉米蛋白的Zeta电位和湿度与界面稳定性有密切的关系。GEISEL等[14]通过研究微凝胶的界面流变特性和结构,发现pH值较高时界面形成的是较软的凝胶结构,pH值较低时界面变得紧凑、脆弱。同时,界面特性在防止乳化液絮凝和泡沫膜排水的方面具有重要的作用,从而改善了食品的稳定[15]。
因此,本文通过探究不同类型的脂肪对乳化肉糜体系中蛋白膜形成的影响,为全面了解蛋白质基质及蛋白分子在界面上的特性提供理论依据,进而为蛋白膜的形成情况对凝胶类肉制品的生产改良作出理论性指导。
1 材料与方法
1.1 材料与试剂
新鲜猪背最长肌和背膘,购于锦州市大润发超市。瘦肉和脂肪分别绞碎,每300 g为1份,分装于聚乙烯真空包装袋中,-18 ℃贮存备用。大豆油(鲁花,100%油)和黄油(总统牌,脱盐)购于锦州市大润发超市。所用NaCl、三聚磷酸盐(STP)、十二烷基硫酸钠(SDS)、Na2HPO4、NaH2PO4等均为分析纯。
1.2 仪器与设备
高速组织捣碎机,上海精科实业有限公司;磁力搅拌器,江苏国华仪器厂;UV2250紫外-可见分光光度计,日本岛津公司;T25 digital Ultra-turrak均质机,德国IKA公司;BT-9300ST激光粒度分布仪,丹东市百特仪器有限公司;AL104电子天平,梅特勒-托利多仪器(上海)有限公司;Discovery DHR-1流变仪,美国TA公司;StephanUMC-5C真空斩拌机,德国Stephan机械有限公司;BCD-215KALM海尔立式冷藏柜,青岛海尔股份有限公司;电热鼓风干燥箱,上海跃进医疗器械厂。
1.3 方法
1.3.1 肉糜样品制备
肉糜配方:2%食盐;0.3%三聚磷酸盐;57%瘦肉;15.7%冰水;25%黄油、豆油或背膘。
肉糜制备程序参照YOUSSEF等[16]的方法并稍作改动:将瘦肉在真空斩拌机中低速斩拌30 s,然后添加食盐和三聚磷酸钠盐,高速斩拌1 min,停2 min(进一步促进盐溶性蛋白质的溶出),加入脂肪(黄油、豆油和背膘)和1/3 冰水并高速斩拌1 min;加入剩余冰水再高速斩拌3 min;肉糜最终温度不超过15 ℃。
1.3.2 乳化肉糜中乳化层的提取
根据YOUSSEF等[16]的方法,并进行适当的改动:称取一定量肉糜,加入3倍体积(质量/体积)磷酸缓冲液(0.2 mol/L, pH 6.5)用玻璃棒搅拌混匀(约1 min),10 000×g离心20 min,明显出现3层:粗乳化层(含有部分油脂层)、肌肉蛋白溶液层和沉淀物。小心收集粗乳化层,加去离子水搅拌清洗,于4 ℃,10 000×g离心20 min。重复以上步骤3次,收集乳化层。测定蛋白浓度后,用磷酸缓冲液将乳化层稀释至蛋白浓度为10 mg/mL的乳化液,用于各指标的测定。
1.3.3 乳化特性测定
参照LINDER等[17]的方法进行乳化活性和乳化稳定性的测定:取制备好的乳化液25 mL置于离心管中,在4℃,1 200 r/min的条件下离心5 min,出现明显分层现象,测定离心管中乳化液的体积。另取该乳化液25 mL于80 ℃下加热30 min,冷却至室温后于1 200 r/min条件下离心5 min,方法同上。每个处理组平行测定5次,实验重复3次。
(1)
(2)
1.3.4 脂肪微粒吸收蛋白量的测定
采用MOURTZINOS和KIOSSEOGLOU[11]的方法测定脂肪微粒吸收蛋白量,并稍有修改,取一定量1.3.2中得到的乳化层,加入4倍体积(质量/体积)Tris缓冲液(含有1% SDS)充分搅拌混匀,-20 ℃下冻存12 h,4℃下解冻,再在-20 ℃下保存12 h,4 ℃下解冻,如此重复操作3次。最后在10 000×g离心10 min,乳化体系破坏,脂肪和蛋白质分离,上层为脂肪,下面为分离出来的与脂肪结合的蛋白溶液。上浮的脂肪用于脂肪微粒平均粒径和脂肪总体积测定,下层的蛋白溶液用于SDS-PAGE蛋白成分分析,Zeta电位及蛋白含量测定以进行单位界面脂肪微粒吸收蛋白量的评价。
采用双缩脲的方法[18]测定该蛋白质溶液中蛋白质含量,即为吸收蛋白含量。
单位界面吸收蛋白量Γs/(mg·m-2)=ΓT/ST
(3)
式中:ΓT,吸收蛋白量;ST,界面的总表面积。
ST=6V/d3,2
(4)
式中:V,脂肪总体积;d3,2,脂肪微粒表面积平均直径,即粒径对表面积的加权平均值[19]。
1.3.5 乳化液和脂肪微粒粒径的测定
采用BT-9300ST型激光粒度分析仪分别测定1.3.2中的乳化液和1.3.4中乳化体系破坏后得到的脂肪微粒的大小,从而得到乳化液和脂肪微粒的粒度分布图谱。测定具体参数设置如下:物质折射率实部为1.52,物质折射率虚部为0.10,介质折射率为1.33,分散剂为水,分析软件为配套软件[20]。其中,D10、D50 和D90 分别表示微粒的累积体积占颗粒体积群总体积的10%、50%和90%时的粒径大小,即小于该粒径的微粒体积占颗粒群总体积的10%、50%和90%[21],每个处理组平行测定3次,实验重复3次,选取D10、D50 和D90 进行结果分析。
1.3.6 SDS-PAGE凝胶电泳
参考XIONG等[22]的方法并加以修改,取1.3.4分离出来的蛋白质溶液,测定其中吸附的蛋白质组成成分,采用10%的浓缩胶,4%的分离胶,电泳上样量为10 μL,电泳起始电压为80 V,样品进入分离胶之后改为120 V,待样品到达底线处,结束电泳。运用Quantity One软件进行扫描和分析。
1.3.7 Zeta电位的测定
根据CRUDDEN等[23]的测定方法,并作适当的修改,用Nano ZS-90 Zeta电位仪测定乳化液和蛋白溶液中蛋白的Zeta电位值,温度设置为25 ℃,每个处理组平行测6次,实验重复3次。
1.3.8 统计学分析
本实验中数据均是3个平行,3次重复实验的结果,数据分析均采用SPSS 19.0软件进行统计分析,方差分析采用ANOVA分析,数据进行正态分布检验,符合正态分布的多重比较采用Duncan’s 法,不符合正态分布的用Kruskal-Wallis 检验,差异显著性为p<0.05。并应用Pearson系数进行相关性分析。作图采用软件Origin 8.6和Sigma Plot 12.5。
2 结果与分析
2.1 脂肪类型对乳化液乳化活性和乳化稳定性的影响
乳化活性(emulsifying activity,EAI)和乳化稳定性(emulsifying stability,ESI)的增加有助于乳化物的形成和稳定[24]。在乳化过程中,蛋白分子吸附到油水界面的速度越快,降低界面张力的速率越高,则蛋白质乳化活性就越高,反之,乳化活性则较低[25]。由图1可以看出,乳化液乳化活性的变化趋势为豆油组<黄油组<背膘组,这说明背膘和黄油的添加,可以在一定程度上加强油脂与蛋白质的相互作用,使得蛋白质分子吸附到背膘和黄油的油水界面的速度较快,降低界面张力的速率也较高,从而增强了蛋白质的乳化活性[25]。而且前人研究发现,在乳浊液中蛋白质和界面之间的疏水作用可以促进蛋白质吸附在界面上[1],因此上述结果也可能是背膘和黄油的添加改变了乳化液中蛋白质表面疏水基团的暴露程度,促进了蛋白质吸附在油相界面上,使得油脂吸附的蛋白质量增加,因而增加了乳浊液的乳化特性[26-27]。此外,在各组乳化液的乳化稳定性变化趋势中黄油组乳化稳定性表现为最好,其次是背膘组,这说明黄油和背膘的添加可以增加乳化液的乳化稳定性,这可能是因为在乳化液中黄油和背膘与蛋白质发生的相互作用,加强了黄油和背膘颗粒或者液滴表面吸附蛋白质的能力,从而增加了蛋白质量,促进颗粒或者液滴表面蛋白质膜的形成,使得颗粒或者油滴之间不能相互靠近,进而增加了体系的稳定性[28-29]。
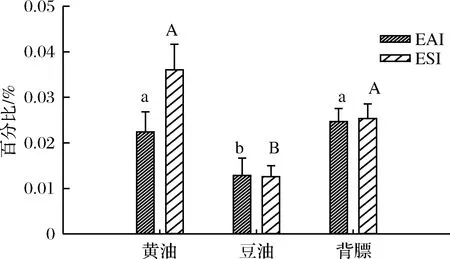
图1 脂肪类型对乳化液乳化特性的影响Fig.1 Effect of lipid types on emulsifying properties ofemulsion注:不同大小写字母分别表示处理组之间ESI和EAI的差异显著(p<0.05)。
2.2 脂肪类型对乳化液中微粒粒度分布的影响
由表1乳化液中D10、D50和D90对应的粒径大小可以看出,乳化液微粒大小均表现为豆油组>黄油组>背膘组,并且豆油组的乳化液微粒显著(p<0.05)大于另外两组。这可能是添加豆油的乳化液中蛋白质不足以覆盖均质过程中新形成的界面,使得相邻油滴因共用界面蛋白质而发生絮凝[30]。这也说明背膘组和黄油组的乳化液中,脂肪颗粒或者液滴周围形成的界面蛋白膜,可以减少脂肪颗粒或液滴的聚集[31]。

表1 脂肪类型对乳化液微粒和脂肪微粒粒径大小的影响(x±s,n=9)Table 1 Effect of lipid types on particle size distribution parameters of emulsion and lipid particle(x±s,n=9)
注:不同小写字母标注的同列数据具有显著性差异(p<0.05)。R-D10、R-D50和R-D90分别表示1.3.4中乳化体系破坏后脂肪微粒的D10、D50和D90。
由相关性分析结果(表2)可知:乳化液的D10、D50和D90与乳化液的乳化活性均具有显著负相关性,这说明乳化液中颗粒越小,乳化液的乳化活性越大。乳化液的D90分别与乳化稳定性呈极显著负相关(p<0.01),这说明乳化液微粒累积体积占总体积90%时对应的粒径越小,则乳化液稳定性就越高。此外,乳化液的EAI与乳化体系破坏后得到的脂肪微粒大小中D10和D50均呈极显著正相关(p<0.01)。

表2 不同指标相关性分析Table 2 Correlation among variables
注:*在 0.05 水平(双侧)上显著相关, **在 0.01 水平(双侧)上显著相关。
图2是乳化液中微粒和乳化体系破坏后脂肪微粒大小的分布图,其中横坐标是乳化液微粒的直径大小,纵坐标是某一粒径的微粒占颗粒群总体积的百分比。
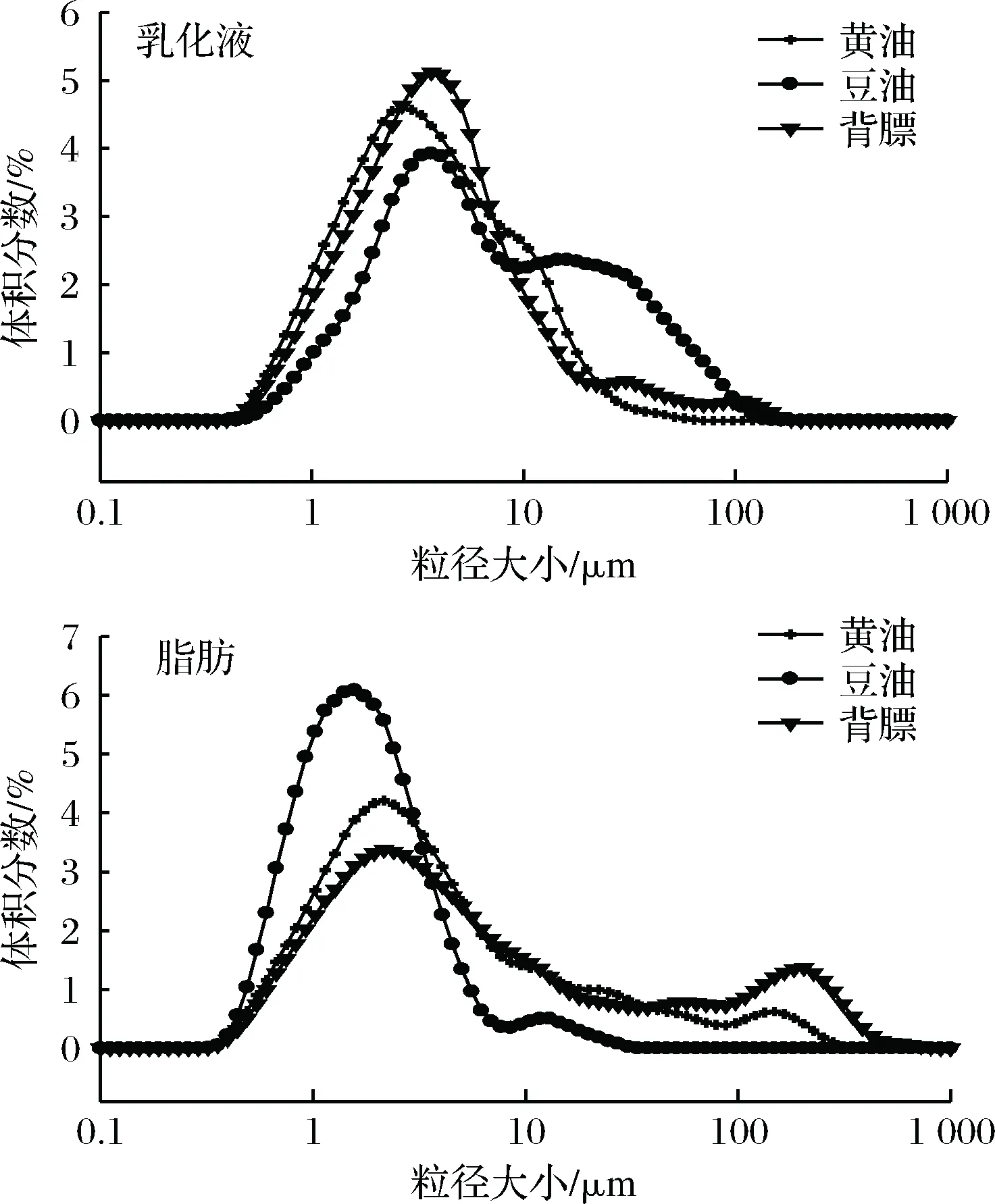
图2 微粒粒径大小分布Fig.2 Particle size distribution
由图2可以看出,乳化液中微粒的分布比乳化体系破坏后脂肪微粒分布集中。由乳化液图整体上可以看出,背膘和黄油组乳化液中粒度分布曲线呈“单峰”型,而且出现单峰的范围不一样。黄油组在粒径为2.70 μm左右出现单峰,背膘组在粒径为3.67 μm左右出现峰值,豆油组则是在整个粒径分布范围内呈“双峰”,第一个峰出现在粒径为3.61 μm左右,第二峰出现范围是9.75~34.62 μm,这说明蛋白质与背膘和黄油的乳化作用较好,使得颗粒细微化。
在脂肪微粒粒度分布图中,可以明显地看出3组处理样品在1~10 μm出现第一个峰,并且在此范围内颗粒数量占颗粒群总体积表现为豆油组最多,其次是黄油组,说明豆油和黄油的颗粒大小偏小,这可能与脂肪的本身状态有关(固体和液体)。随着粒径的增大,背膘和黄油的脂肪微粒分布均表现为一个长长的拖尾,其中黄油微粒大小为143.58 μm左右出现了第二个峰值,而背膘则在207.98 μm左右出现的第二个峰值,这与豆油的第二个峰值出现的粒径范围相比,粒径偏大。同时结合乳化液微粒粒度分布的研究结果可以说明,在乳化层中,蛋白质能够较好地乳化背膘和黄油,使得颗粒细微化,而乳化体系破坏后,脂肪颗粒或者液滴表面的蛋白膜被破坏,导致脂肪聚集,颗粒偏大。
乳化液的理化性质受其中分散相微粒的大小和粒度分布的影响[21]。图3是乳化液中微粒和乳化体系破坏后脂肪微粒粒径累积分布的情况,其中横坐标是微粒的直径大小,纵坐标是微粒占颗粒群总体积的百分比累积情况。
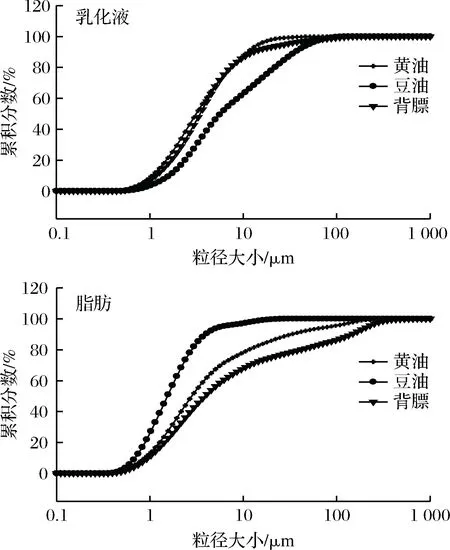
图3 微粒累积分布Fig.3 Particle cumulative score distribution
图3可以看出,乳化液中微粒的粒径累积分数3组之间没有明显的区别。3组样品的乳化液均在粒径大小为1~100 μm达到100%,其中黄油组和背膘组的累积分布情况相似,仅在粒径大小为17.52 μm左右达到定值,而豆油组的乳化液粒径分布相对其他两组较缓达到100%,这说明在黄油组和背膘组的乳化层中,蛋白质乳化二者的能力比较强,乳化液的乳化活性和乳化稳定性也就会比较强,从而使得颗粒细微化,这与图1中黄油和背膘组乳化活性和乳化稳定性表现较好结果一致。
由乳化体系破坏后脂肪微粒的累积分数分布图中,可以看出豆油在粒径大小为30.39 μm左右,微粒累积分数达到定值,黄油在312.00 μm左右达到定值,而背膘则是在较大的粒径处达到了100%累积分数,这同时验证了表1中各脂肪D90对应的粒径大小为背膘>黄油>豆油的结果。但是,脂肪微粒的累积分数在达到定值之前,当粒径处于同一大小时,微粒累积分数趋势均呈现的是豆油>黄油>背膘,这可能因为乳化体系破坏后,黄油组和豆油组中脂肪聚集,颗粒偏大,导致同一粒径大小时,累积分数较低,同样这说明了在乳化层即乳化体系未破坏前,蛋白质能够较好的乳化背膘和黄油,颗粒细微化,使得黄油和背膘乳化液中微粒较小,即验证了表1中二者乳化液粒径较小的研究结果。
2.3 脂肪类型对乳化液Zeta电位的影响
Zeta电位可表征溶液中颗粒表面电荷量,是对颗粒之间相互排斥或吸引力的强度的度量[32]。其中,静电排斥能够较好稳定乳液以及阻止液滴之间的聚合[33]。通常情况下,Zeta电位绝对值大于60 mV时,荷电粒子相当稳定;Zeta电位绝对值在30~60 mV时,荷电粒子比较稳定;Zeta电位绝对值小于30 mV时,荷电粒子不稳定,容易聚集[32,34]。由图4可以看出,乳化液和肌肉蛋白质溶液中Zeta电位均为负值,其中,3种油脂乳化液中Zeta电位的变化趋势并不明显,各组乳化液的电位值绝对值低于20 mV,说明乳化液并不稳定,而乳化体系破坏后得到的各组蛋白溶液中Zeta电位具有显著性差异(p<0.05),并且绝对值均高于乳化液中Zeta电位值,这说明肌肉蛋白溶液的稳定性要高于原乳化液。
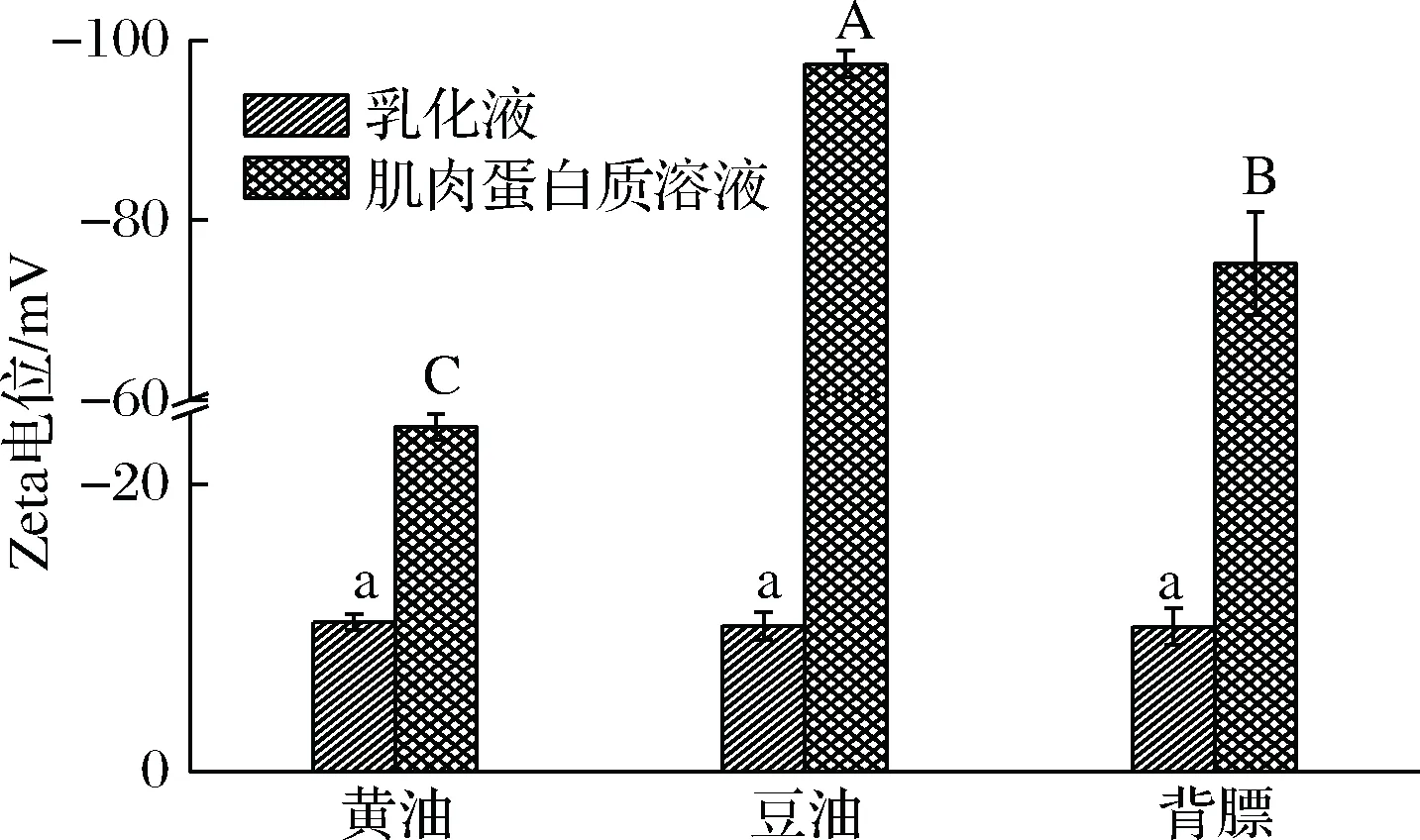
图4 脂肪类型对乳化液Zeta电位的影响Fig.4 Effect of lipid types on Zeta potential of emulsion注:不同大小写字母分别表示处理组之间乳化液和肌肉蛋白质溶液的Zeta电位差异显著(p<0.05)。
另外,乳化体系破坏后得到的豆油和背膘组中电位值的绝对值均大于60 mV,这说明豆油组和背膘组乳化体系破坏后得到的肌肉蛋白质溶液的稳定性较好。此外,从肌肉蛋白质溶液的Zeta电位的变化趋势可以看出,豆油组的Zeta电位绝对值最高,为97.40 mV,故说明豆油组乳化体系破坏后得到的肌肉蛋白质溶液较稳定,而黄油组乳化体系破坏后,肌肉蛋白溶液的Zeta电位的绝对值最低,仅为24.0 mV,较不稳定。这种Zeta电位值的差异可能是由于不同油脂的结构存在差异,因为在肌肉蛋白质制备过程中,蛋白液的稳定性和油脂在膜内、外侧的分布可能受到以下几个因素控制:油脂的极性头部的大小、油脂所带的电荷、脂肪酸链在油水界面蛋白膜中的堆积[35]。
2.4 脂肪类型对单位界面蛋白吸收量的影响
界面蛋白浓度是表征乳液稳定性的重要参数之一。一般而言,界面蛋白浓度越高,乳液就会越稳定[36]。由表3可知,表面吸收蛋白总量(ΓT)表现为黄油组>豆油组 > 背膘组,同时单位界面膜吸收蛋白量(Γs)也表现为黄油组>豆油组>背膘组。这说明随着蛋白含量的增加,黄油可以增加乳液中吸附至液滴界面的蛋白含量。此外还可以看出,由添加黄油的肉糜中提取出来的乳化层能够显著提高乳化层中脂肪微粒表面吸收蛋白总量(ΓT)和单位界面膜吸收蛋白量(Γs)(p<0.05),其中,ΓT可达到13.957 mg,Γs可达到11.330 mg/m2;而添加背膘的肉糜中提取出来的乳化层对其中脂肪微粒表面吸收蛋白总量和单位界面膜吸收蛋白量贡献不大。这可能是因为乳化层中的黄油能够较好的与盐溶性蛋白质发生相互作用,使得大量的肌球蛋白或肌动蛋白包裹在脂肪微粒表面,形成一层比较厚的蛋白膜,从而提高了脂肪微粒表面吸收的蛋白总量和单位界面膜吸收的蛋白总量[27]。此外,从d3,2来看,豆油组的d3,2显著低于另外两组(p<0.05),这和乳化体系破坏后得到的脂肪微粒粒径大小结果一致。

表3 脂肪类型对脂肪微粒表面吸收蛋白量(ΓT)和单位界面膜吸收蛋白量(Γs)的影响(x±s;n=3)Table 3 The effect of lipid types on absorption amount ofprotein (ΓT) on the lipid particles surface and unit interfacemembrane absorption amount of protein (Γs)(x±s ;n=3)
2.5 电泳
肌原纤维蛋白可分为3部分:肌球蛋白、肌动蛋白和其他起支持调控作用的蛋白[37]。在乳化肉糜体系中,蛋白质分别与豆油、黄油和背膘发生乳化作用,由于乳化层中乳化体系的破坏,肌肉蛋白质溶液中的蛋白质组成成分如图5所示。可以看出,乳化界面所吸附的蛋白种类主要有12种。其中主要包括肌球蛋白重链(myosin heavy chain,MHC)、C 蛋白(C-protein,)、α-肌动素(α-actinin)、肌间线蛋白(desmin)、肌动蛋白(actin)、肌钙蛋白 T(troponin T)、原肌球蛋白(tropomyosin)、肌球蛋白轻链 1(myosin light chain 1)、肌钙蛋白 I(troponin I)、肌钙蛋白 C(troponin C)、肌球白轻链 2(myosin light chain 2),肌球白轻链 3(myosin light chain 3)等,这与邵俊花研究的乳化层中蛋白膜组份分析相似[38]。

M-标准蛋白Marker; SO-豆油;PF-背膘;DB-黄油图5 不同脂肪吸附蛋白质SDS-PAGE电泳图Fig.5 SDS-PAGE of protein composition of fat/oilmembrane in emulsion layer
3 结论
通过斩拌不同脂肪与猪背最长肌、食盐等混合物得到乳化肉糜体系,并从中进一步提取乳化层,以乳化层为基点,研究发现脂肪类型对乳化层中蛋白膜形成具有一定的影响。其中肌肉蛋白质能够较好的乳化背膘和黄油,形成的蛋白膜能有效地阻止颗粒或液滴之间的接触,改善乳化液的乳化活性和乳化稳定性。同时由乳化层微粒分布结果分析,再次验证了蛋白质能够较好的乳化背膘和黄油,使得颗粒细微化。此外,当乳化体系破坏后,黄油可以提高脂肪吸收蛋白量,表明了黄油表面形成致密蛋白膜的能力较强,有利于增加黄油表面的蛋白吸附量,同时也有利于提高乳化液中的稳定性。
