INFα-2b联合恩替卡韦对慢性乙型肝炎患者病毒载量、外周血中Th1/Th2型细胞因子与肝功能的改善效果
2018-11-14段卫星李卫强
梁 超 段卫星 李卫强
(济源市人民医院,河南 济源 459000)
慢性乙型肝炎(CHB)系乙型肝炎病毒(HBV)感染引起的肝脏损害性疾病,全球67亿人中约有23亿人曾经感染过HBV,且每年约有100万人死于HBV感染所继发的肝硬化、肝衰竭或肝细胞癌,而中国CHB患者与HBV携带者将近1亿人,成为世界上HBV感染第一大国〔1~3〕。HBV大量复制并与机体持续发生免疫反应是CHB发病的主要原因,其临床治疗主要是通过抑制病毒复制或消除病毒进行抗病毒治疗〔4,5〕。具有抗病毒特性的细胞因子干扰素(INF)α-2b和核苷酸类似物恩替卡韦均是目前临床主要的抗病毒药物,其治疗效果均已得到临床认可,但关于二者联合用药有效性及安全性的研究尚少,本研究主要探讨INFα-2b联合恩替卡韦治疗对CHB患者病毒载量、外周血中Th1/Th2型细胞因子及肝功能的改善效果。
1 资料与方法
1.1一般资料 选取济源市人民医院2016年1月至2017年1月收治的CHB患者96例,纳入标准〔6,7〕:①符合2010年中国《慢性乙型肝炎防治指南》〔8〕的诊断标准;②乙型肝炎表面抗原(HBsAg)阳性≥48 w,HBV-DNA≥1×10 copies/ml,丙氨酸转氨酶(ALT)≥100 IU/L,总胆红素(TBiL)≤40 mmol/L;③无合并心脑血管、肺和肾脏等实质性脏器疾病,不伴有其他肝脏疾病;④入院治疗前6个月内未进行过抗病毒治疗;⑤对本研究知情,均自愿参与并签署知情同意书。排除标准〔9,10〕:①对本研究中治疗药物过敏的患者;②合并严重的免疫系统、循环系统疾病或恶性肿瘤患者;③伴有肺结核、获得性免疫缺陷综合征等传染性疾病的患者;④处于妊娠或哺乳期的妇女。采用随机数字表法将其分为对照组和观察组,各48例。两组年龄、性别、HBV-DNA、ALT、谷草转氨酶(AST)、TBiL等一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经院内伦理委员会审核批准。

表1 两组一般资料比较
1.2方法 在抗HBV感染治疗的基础上,对照组采用恩替卡韦单药治疗:每天口服0.5 mg恩替卡韦(中美上海施贵宝制药有限公司,国药准字H20052237)治疗,1次/d,饭前或饭后口服均可,连续治疗48 w(1个疗程)。观察组在对照组基础上联合INFα-2b治疗:每次给予INFα-2b(国药准字:S20030051,哈药集团生物工程有限公司)500万U肌肉注射,隔日1次,连续治疗48 w(1个疗程)。入院前及治疗48 w后采集患者清晨空腹肘静脉血5 ml,离心机离心后取上清冷藏待检,检测血清细胞因子水平及肝功能,使用普朗牌全自动生化分析仪检测肝功能指标(安徽信灵检验医学科技有限公司);采用酶联免疫吸附试验(ELISA)检测HBV标志物(上海康成生物工程有限公司)。
1.3观察指标 ①两组治疗前后HBV载量变化;②两组治疗前后外周血Th1/Th2细胞因子水平:血清INF-γ、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-4、IL-6、IL-10;③两组治疗前后肝功能指标变化:ALT、TBiL复常率、HBV-DNA转阴率;④两组治疗效果:痊愈、有效、无效、总有效率;⑤两组不良反应发生情况:头痛、乏力、发热及总不良反应发生率。
1.4疗效标准
1.4.1疗效指标 ①血清ALT复常:ALT≤40 IU/L;②血清TBiL复常:TBiL≤17.1 μmol/L;③HBV-DNA转阴:病毒载量<500 copies/ml。
1.4.2治疗效果指标 根据患者血清ALT水平,HBV-DNA和HBeAg转阴情况将患者临床疗效分为:①痊愈:ALT≤40 IU/L,HBV-DNA转阴,HBeAg转阴;②有效:ALT≤40 IU/L,HBV-DNA转阴,HBeAg阳性;③无效:HBV-DNA阳性,HBeAg阳性;④总有效率:〔(有效+痊愈)/总病例数〕×100%。
1.5统计学方法 采用SPSS21.0软件进行配对t检验、χ2检验。
2 结 果
2.1两组治疗前后HBV载量比较 治疗前,两组HBV载量比较差异无统计学意义(P>0.05);对照组治疗后HBV载量明显低于治疗前(P<0.05);治疗后,观察组HBV载量明显低于对照组及同组治疗前,差异有统计学意义(P<0.05);见表2。

表2 两组HBV载量比较
与治疗前比较:1)P<0.05;下表同
2.2两组治疗前后外周血Th1/Th2型细胞因子水平比较 治疗前,两组外周血Th1/Th2型细胞因子水平比较均无统计学意义(P>0.05);治疗后,两组INF-γ、TNF-α指标均明显低于治疗前,IL-4、IL-6、IL-10均明显高于治疗前,差异均有统计学意义(均P<0.05);且观察组治疗后INF-γ水平明显低于对照组,差异有统计学意义(P<0.001),IL-6水平明显高于对照组,差异有统计学意义(P<0.05);两组治疗后TNF-α、IL-4、IL-10水平比较差异均无统计学意义(均P>0.05);见表3。
2.3两组治疗前后肝功能指标变化 两组ALT复常率比较差异无统计学意义(P>0.05);观察组TBiL复常率、HBV-DNA转阴率均明显高于对照组,差异有统计学意义(P<0.05);见表4。

表3 两组治疗前后Th1/Th2型细胞因子水平比较
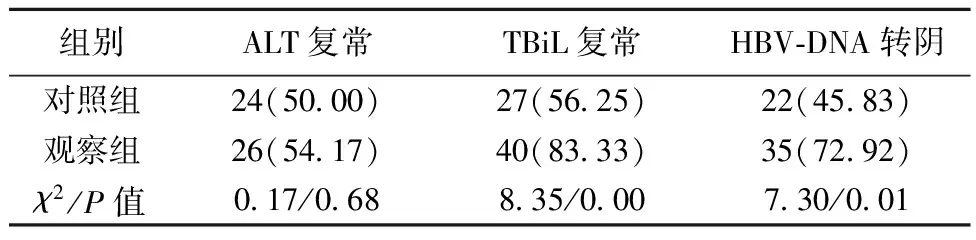
表4 两组治疗前后肝功能指标变化比较〔n(%),n=48〕
2.4两组治疗效果比较 观察组治疗总有效率(89.58%,痊愈25例,有效18例,无效5例)明显高于对照组(64.58%,痊愈12例,有效19例,无效17例),差异有统计学意义(χ2=8.49,P=0.01)。
2.5两组不良反应发生率比较 观察组不良反应发生率(27.08%,头痛2例,乏力8例,发热3例)与对照组(29.17%,头痛3例,乏力7例,发热4例)比较差异无统计学意义(χ2=0.05,P=0.82)。
3 讨 论
2005年《中国乙肝防治指南》提出抗病毒治疗的目标:最大限度地长期抑制或消除HBV,减轻肝细胞炎症坏死及肝纤维化,延缓和阻止疾病进展,减少和防止肝功能失代偿、肝硬化、肝细胞癌及其他并发症的发生,从而改善生活质量及延长生存时间〔11〕。恩替卡韦作为新型的强效、低耐药鸟嘌呤核苷类似物抗病毒药,在降低病毒载量、调节免疫状态和改善肝功能生化指标等方面均优于拉米夫定,虽然应用于临床时间较短,但逐渐成为CHB防治的首选抗病毒药物。恩替卡韦吸收进入肝细胞后,在磷酸化酶作用下转变为具有生物活性的5′-磷酸盐,可同时作为HBV-DNA合成酶的生物成分及作用底物,在HBV病毒复制的起始、逆转录和延伸三个阶段与dGTP竞争进入DNA,从而起到抗病毒作用且作用强于其他核苷类似物。临床研究显示〔12~14〕,随着治疗时间的延长,单药的抗病毒效果逐渐下降且不良反应的发生概率增加,更重要的是,治疗时间越长,机体内部病毒发生耐药性的可能性越高,寻找更加安全有效且耐药性很低或无的药物、抗病毒药物的联合使用是未来治疗CHB患者的有效方案之一。
恩替卡韦联合INF-α-2b是一种治疗CHB全新策略。INF-α-2b的抗病毒机制主要是抑制病毒增生,通过与细胞膜表面的INF受体结合,诱导并激活细胞产生抗病毒蛋白,同时,作为一种免疫激活剂,诱导刺激机体产生2′-5′寡腺苷酸合成酶,发挥抑制病毒复制的作用〔15~17〕。因此,INFα-2b不仅抑制病毒增生而且改善调节机体免疫状态,是一种作用全面的抗病毒药物。本研究结果显示:联合用药组HBV载量下降程度显著高于单药组,说明INFα-2b与恩替卡韦联合使用明显增强了清除病毒的效果且将病毒复制控制在较低的载量。Th1型细胞因子中INF-γ、TNF-α与肝细胞炎症反应相关,通过激活炎症反应抑制病毒的复制,但同时也加重了肝细胞的损伤,联合用药组INF-γ较单药组显著下降,INFα-2b在炎症转归过程中对于INF-γ的抑制作用可能更加明显;Th2型细胞因子在减轻炎症水平,促进肝细胞再生中起重要作用,本研究中IL-6升高显著,说明INFα-2b增强了IL-6的表达水平,促进肝脏Kupffer细胞合成急性期反应蛋白,有助于损伤修复。但是HBV诱导的免疫反应是一个复杂的过程,而T淋巴细胞及其分泌的细胞因子只是其中一个环节,且细胞因子的表达水平与机体自身免疫状态存在复杂关系,因此,单一的细胞因子水平的增加或减少并不能说明其与CHB病程的联系,但是也从另一个角度评价了肝脏炎症状态的发展和转归。ALT、TBiL、HBV-DNA是评价肝功能的重要生化指标,联合用药组在促进ALT、TBiL复常、HBV-DNA转阴较单药组均起到了更好的作用,可能与INFα-2b和恩替卡韦互补协调大大提高了抗病毒能力有关,在增加有效率的同时且未提高不良反应的发生率,保证了联合用药在未来临床使用的安全性和可靠性〔18~21〕。综上所述,INFα-2b联合恩替卡韦治疗能提高CHB的治疗疗效,有效控制病毒水平,改善肝功能,且未提高不良反应,具有较高的治疗价值。
