真空辅助活检诊断乳腺导管上皮不典型增生的组织学低估及切缘残留问题的研究
2018-11-13梁琴张静高润芳
梁琴 张静 高润芳
目前,随着乳腺疾病诊断技术的不断提高,越来越多临床不可触及的乳腺病变(non-palpable breast lesions,NPBL)的检出率也日渐提高,这些病变中有15%~40%为恶性病变[1]。如何准确定位并活检NPBL成为早期诊断乳腺癌的关键。近年来,真空辅助乳腺活检(vacuum-assisted breastbiopsy,VAB)成为诊断早期乳腺癌的一个热点研究。目前,临床上应用较广泛的为钼靶立体定位真空辅助活检(stereotactic vacuum assisted breast biopsy,SVAB)和超声引导下真空辅助活检(ultra- sound-guided vacuum-assisted biopsy,UGVAB)。VAB采用机械切割与真空负压结合的方法,较其他微创活检方法具有组织量较多等特点,可以代替开放手术对NPBL进行活检[2-3]。而VAB造成的组织学低估是影响其诊断准确性的关键,也是其主要缺点之一。本研究应用VAB对临床不可触及乳腺病变进行活检,对其中诊断为乳腺导管上皮不典型增生(atypical ductal hyperplasia,ADH)的病例进行研究,前瞻性研究VAB的组织学低估及切缘残留问题。
资料与方法
1.病例选择:2012年3月至2016年3月,在山西省人民医院因乳腺钙化或肿块(均为临床不可触及乳腺病变,病变大小20 mm以内)行SVAB或UGVAB活检,术后石蜡病理诊断为ADH的患者为研究对象,排除VAB诊断为乳腺浸润性癌合并的ADH或者乳腺导管原位癌合并的ADH的病例。共165例ADH患者纳入本研究。所有患者均为女性,年龄20~75岁。
2.活检设备:临床不可触及钙化灶活检采用美国Selenia公司生产的的Multicare俯卧式数字乳腺活检三维立体定位系统(Hologic MultiCare Platinum)和Vacora真空辅助乳腺微创旋切活检系统,其中真空辅助旋切活检针针径为10 G。临床不可触及乳腺肿块活检采用美国巴德公司生产的安珂乳腺真空辅助活检系统(EnCor),其中真空辅助旋切活检针针径为 7 G,定位超声采用意大利百胜彩色多普勒超声仪,具有4.75~10.0 兆赫变频传感器。
3.活检方法:(1)乳腺钙化灶SVAB活检术过程。先对活检定位系统进行调试并进行原点定位。患者采取俯卧位,调整乳房位置使病灶在活检窗内适当位置,通过俯卧式数字乳腺活检三维立体定位系统进行钼靶摄片定位病灶,定位出目标病灶后进行立体定位摄片,计算出病灶的X、Y、Z立体坐标,传送至活检床。穿刺部位常规消毒后,注射2%利多卡因5 ml局麻后,先用11号刀片做 3 mm 皮肤切口,通过Vacora真空辅助乳腺微创旋切活检系统,进行真空辅助旋切活检。每个时钟方向取组织1~2条共12~24条。再次拍片根据残留钙化情况进行补切,使可疑恶性的目标钙化残留量低于5%,标本钼靶摄片确认标本中含有目标钙化,送石蜡病理检查。乳房弹力绷带加压包扎固定后返回病房。
(2)乳腺肿块UGVAB活检过程。真空活检系统准备完善后患者采取仰卧位,充分暴露患侧乳房及腋窝,结合术前超声检查报告,对目标肿块进行体表定位。常规消毒皮肤,应用彩色多普勒超声探查血管情况,避开较大血管,采用含 1:100 000肾上腺素的2%利多卡因混合液10 ~ 40 ml 局部麻醉。先用11号刀片做3 mm皮肤切口,再通过安珂乳腺真空辅助活检系统(EnCor)连接的8号旋切刀穿刺到超声定位的病变位置。超声引导下使刀槽位置处于病灶下方后开始真空辅助旋切活检,直至乳腺肿块被完整切除,抽吸积血再次确认无病灶残留,标本送石蜡病理检查。乳房弹力绷带加压包扎固定后返回病房。
4.活检后处理:筛选出VAB术后石蜡病理诊断为ADH的病例,术后2周内均进一步手术扩大切除活检,常规检查真空辅助旋切活检后的切缘,若切缘发现ADH,则定义为切缘残留,若手术扩大切除发现癌则定义为组织学低估。
5.统计学处理:应用SPSS 17.0软件进行统计分析,SVAB和UGVAB诊断ADH的低估率的比较采用四格表资料的Fisher确切概率法,P<0.05为差异有统计学意义。
结果
1.VAB组织学低估率:VAB活检病理诊断为ADH共165例,其中76例患者由SVAB诊断,89例患者由UGVAB诊断。进一步手术切除活检,15例证实存在乳腺导管内癌成份,故VAB诊断乳腺ADH的组织学低估率为9.1%,其中8例经SVAB诊断后手术切除活检证实存在乳腺导管内癌成份,7例患者经UGVAB诊断后手术切除活检证实存在乳腺导管内癌成份。其中SVAB诊断乳腺ADH的组织学低估率为10.5% ,UGVAB诊断乳腺ADH的组织学低估率为7.9%,两者低估率差异无统计学意义。见表1。

表1 SVAB与UGVAB诊断乳腺ADH的比较
2.VAB手术切缘:常规检查VAB活检后的手术切缘,62例证实切缘阳性,故VAB术后切缘残留率为37.8%,其中30例为SVAB术后,32例患者经UGVAB术后。其中SVAB术后切缘残留率为39.5%,UGVAB诊断乳腺ADH的组织学低估率为36.0%,两者差异无统计学意义。见表2。
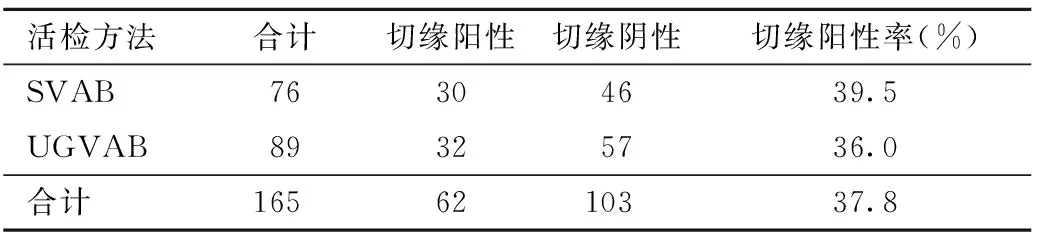
表2 SVAB与UGVAB术后切缘阳性率的比较
讨论
有研究表明,相对于可触及肿块的乳腺癌来说,触诊阴性的乳腺癌恶性程度明显降低,并且肿瘤细胞的核异型性、生物学活性和转移潜能也均降低[4]。因此,及早发现临床不可触及的乳腺病变(non-palpable breast lesions,NPBL),并尽早明确诊断,是提高乳腺癌早期诊断率、改善患者预后的关键。VAB较其他微创活检方法具有组织量较多等特点,可以代替开放手术对NPBL进行活检。
乳腺ADH是一种具有部分乳腺导管原位癌组织学特征但尚不能诊断为原位癌的病变。目前,普遍认可的乳腺癌演变过程是从不典型增生、原位癌到浸润性癌的病变过程,乳腺ADH是一种癌前病变[5-6]。早期诊断出癌前病变,并对此类病例定期检查,可以有效发现早期乳腺癌,实现乳腺癌的二级预防。乳腺ADH 在影像学检查上通常无典型的形态学特征,一般需要穿刺活检来进行病理学检查。通过VAB可以对ADH进行诊断,但组织学低估是影响其诊断准确性的关键,也是其主要缺点之一。目前,国外对VAB诊断为ADH的病例建议进行手术切除活检,是否对所有的病例都采取这种方法尚存在争议。国内关于VAB诊断ADH的组织学低估的研究较少,对于VAB诊断ADH后的处理方法也尚无统一标准。本研究结果显示,通过对VAB诊断为ADH的患者再次切除活检,发现VAB诊断ADH的组织学低估率为9.1%。其中SVAB和UGVAB诊断乳腺ADH的组织学低估率分别为10.5%和7.9%,两者差异无统计学意义,比较接近既往研究报道[7-8]。而Youn等[9]对27例SVAB诊断ADH的患者再次行局部切除术,SVAB术后钙化灶残留组ADH组织学低估率为35.3%(6 / 17),无钙化灶残留组ADH组织学低估率为30.0%(3 / 10),两组差异无统计学意义;该研究建议针对单纯微小钙化灶活检证实ADH的患者,不论有无钙化灶残留,均建议再次局部手术切除。Youn等[9]研究的组织学低估率显著高于本研究,考虑与此回顾性研究存在局限性,样本量小,且样本选择存在偏倚有关。石剑等[10]对278例临床不可触及且超声检查阴性的乳腺微小钙化行 SVAB,其中乳腺ADH共27例,占活检总数的9.8%(27 / 276),且未发现组织学低估。
本研究结果显示,VAB后再次切除活检的病例中,发现切缘阳性率达37.8%。Kettritz等[11]报道,应用VAB,肿块直径<10 mm时,76%的病例可完全切除病灶,而肿块直径为10~20 mm时,约30%的病例可完整切除病灶。而Wang等[12]发现患者在应用VAB切除良性乳房肿瘤6个月后,超声复查发现残留肿瘤率为3.4%,考虑不完全切除与初始肿瘤大小>20 mm有关。但是,本研究再次证实了VAB有较高的切缘阳性率,旋切术后肿瘤残留是其最大的问题,不宜用于乳腺癌的治疗。分析原因可总结为:(1)VAB无法判断肿瘤的切缘;(2)VAB往往不能完整切除肿瘤组织,导致肿瘤残留;(3)VAB的切除为多次碎片状切除,不符合整块完整切除的肿瘤原则。
总之,VAB作为一种微创活检方法,对乳房外观影响小,可有效检出ADH,组织学低估率较低,且SVAB和UGVAB两种影像引导活检方法低估率无显著差异,有较高的应用价值。但鉴于VAB病理诊断上的低估及较高的切缘阳性率,在高危病灶的诊断与治疗上,VAB不能完全替代切除活检。
