过表达趋化因子受体2促进脂肪间充质干细胞对皮肤损伤的修复
2018-11-13祁旻龙YuriCiervo
祁旻龙, 朱 良, Yuri Ciervo, 徐 俊
(1. 同济大学医学院,上海 200092; 2. 英国谢菲尔德大学转化神经科学研究所,谢菲尔德S10 2HQ,英国)
皮肤是最大的人体器官,对于保护机体至关重要,各种因素造成的皮肤损伤难以愈合、愈合速度慢或创伤后发生瘢痕,给患者带来极大痛苦。近年来,随着干细胞技术的发展,一种脂肪间充质干细胞(adipose mesenchymal stem cells,ADSCs)因取材方便、免疫原性低等优点,用于皮肤损伤的治疗而受到越来越多的关注[2-3]。研究表明,人类ADSCs参与调节炎症过程促进创面愈合,但由于先天缺乏趋化因子受体2(chemokine receptor 2,CCR2),其靶向性受到影响。本研究通过慢病毒技术构建过表达CCR2的ADSCs,皮下移植入小鼠皮肤创面以观察其对皮肤创面愈合的影响,为创伤修复的基础研究和临床应用提供参考。
1 材料与方法
1.1 实验材料
人皮下脂肪组织样本由同济大学附属第十人民医院妇产科提供,均来自健康成人腹部抽脂手术脂肪(征得患者及家属同意并签署知情同意书),整个实验过程均符合同济大学附属第十人民医院伦理委员会要求。质粒LV-mCCR2-IRES-ZsGreen1为实验室自有。雌性ICR小鼠30只,体质量25~30g,由同济大学实验动物中心提供。DMEM/F12培养基和胎牛血清(FBS,美国Hy-clone公司),抗体CD73、CD105、CD44和CD31(美国BD公司),ADSCs成脂、骨、软骨分化试剂盒(加拿大STEMCELL公司),其他常规试剂购自同济大学后勤物资中心。
1.2 实验方法
1.2.1 脂肪干细胞的分离和培养 新鲜的脂肪标本用磷酸盐缓冲液(PBS)冲洗3次,于无菌操作台上用无菌剪刀剪碎,加入等体积0.2%胶原酶I,置于37℃的水浴锅中消化1.5h。加入等体积的培养基终止消化,离心半径26cm,1500r/min,离心5min。去除上清,用含10% FBS的DMEM/F12培养基将细胞重悬,按106个/mL密度进行接种,记为P0代,即为ADSCs;然后将细胞培养于37℃,5% CO2的培养箱中,隔天换液。当原代细胞生长至80%~90%时,进行传代培养,去除培养皿中的上清液,加入PBS连续漂洗2遍;加入胰蛋白酶0.05%胰蛋白酶/0.5mmol/L乙二胺四乙酸(EDTA)],置于37℃,5% CO2培养箱里消化5min。贴壁细胞悬浮后转入15mL离心管中,离心半径26cm,1200r/min,离心5min,去除上清液,完全培养基重悬沉淀,以1∶3的比例接种在新的培养皿中,记为P1代。取培养至2~5代的ADSCs进行后续实验。
1.2.2 流式细胞术检测ADSCs表面标记 细胞传至第3代,首先消化,将细胞尽量吹打成单细胞。按照抗体使用说明书用PBS稀释抗体,注意避光。将稀释好的抗体加入到细胞中,轻轻吹打均匀成单细胞悬液,冰上避光孵育30min。孵育完成后,离心半径26cm,1200r/min,低温离心10min。去掉上清液,用PBS洗3遍后重悬,过流式细胞仪检测。
1.2.3 ADSCs成脂、成骨、成软骨分化及鉴定实验依诱导转化方向不同将ADSCs细胞分成三组,即成脂、成骨、成软骨3组。预先接种3组ADSCs细胞(104个/cm2)到明胶包被的6孔板中,37℃,5% CO2培养箱中培养。待细胞增殖达80%时,成脂诱导组每孔更换0.5mL成脂分化培养基;成骨诱导组每孔更换0.5mL成骨分化培养基;成软骨诱导组每孔换成0.2mL成软骨分化培养基。培养14~21d,每3天换液。诱导结束之后,吸去培养基,用PBS洗3遍。向每孔中加入0.5mL的4%多聚甲醛固定30min后用PBS洗3遍。成脂诱导组每孔中加入0.3mL油红O染液染色30min;成骨诱导组每孔中加入0.3mL茜素红S染色液染色10min;成软骨诱导组每孔中加入0.1mL阿利新蓝染色液染色30min。其后各组细胞以PBS洗2遍,然后置于倒置显微镜下观察细胞表型变化。
1.2.4 慢病毒构建CCR2-增强绿色荧光蛋白(EGFP)-ADSCs和EGFP-ADSCs 复苏293T细胞增殖达85%时,将转移质粒(过表达组LV-mCCR2-IRES-ZsGreen1,10μg;空载组LV-IRES-ZsGreen1,10μg)、Rev 2μg、VSVG 3μg、pMDL 5μg以1.5mL无血清Opti-MEM培养基稀释;60μL脂质体2000以1.5mL无血清Opti-MEM培养基稀释,孵育5min后,将上述质粒和脂质体溶液混合并孵育25min。将孵育后的质粒、脂质体混和物加入293T细胞,培养箱培养6h后以含10% FBS的DMEM/F12培养基全量换液,继续培养24h荧光观察EGFP表达,48、72h后收集病毒上清,加入聚凝胺至终浓度为8mg/L,感染ADSCs,制备CCR2-EGFP-ADSCs或EGFP-ADSCs,感染12h后换液,48h后镜下观察到绿色荧光表达即构建成功。
1.2.5 创伤模型制备及分组 将30只ICR小鼠常规饲养7d后,腹腔注射水合氯醛400mg/kg麻醉,剃去背部毛,在脊背两侧分别制备0.8cm×0.8cm创面,深至皮下。随机将小鼠均分为PBS组(注射PBS)、EGFP组(注射EGFP-ADSCs)和CCR2组(注射CCR2-EGFP-ADSCs),每组10只。
1.2.6 细胞注射及创面观察 造模隔天在小鼠背部伤口外取4个点,EGFP-ADSCs组和CCR2-EGFP-ADSCs组每个点皮下注射感染的相应ADSCs细胞106个,对照组注射等体积PBS。上述实验后小鼠分笼饲养,每天观察进食、创面变化及愈合情况,计算创面愈合率,并于造模后第9天分别切取各组移植区的全层皮肤1cm×1cm制作组织石蜡切片,H-E染色镜下观察创伤愈合情况。
1.3 统计学处理
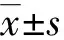
2 结 果
2.1 ADSCs的分离和培养
分离消化得到的原代细胞的接种到培养皿中,贴壁后细胞体细长,以涡旋式的方式扩增,传至3~4代时细胞形态均一,呈梭形的成纤维细胞样,见图1。

图1 倒置显微镜下观察脂肪间充质干细胞梭形细胞样Fig.1 Fibroblast-like ADSCs, inverted microscope (×10)
2.2 流式细胞仪鉴定ADSCs表型
细胞传至第3代,流式分析结果表明细胞高表达ADSCs表面抗原如CD44(95.0%)、CD73(99.5%)和CD105(98.0%),基本不表达CD31,流式术细胞结果如图2。

图2 流式细胞技术检测脂肪间充质干细胞表面抗原CD44、CD31和CD73、CD105Fig.2 By using flow cytometry technique to identify immune phenotype of ADSCs,CD44&CD31 CD73&CD105A: 细胞高表达ADSCs表面抗原CD44(95.0%)、基本不表达CD31;B: 细胞高表达ADSCs表面抗原CD105(98.0%),CD73(99.5%)
2.3 ADSCSs成脂、成骨、成软骨分化及鉴定
ADSCs成脂肪诱导14d后镜下细胞可见明显脂滴,经油红O染色脂滴呈红色,见图3A;成骨诱导21d发现明显的矿物质沉积,茜素红S染色后可见深红色矿化结节,见图3B;成软骨诱导14d经阿利新蓝染色可见呈蓝色的软骨细胞,见图3C。

图3 ADSCs成脂、成骨和成软骨体外诱导分化(×100)Fig.3 Adipogenic,osteogenic and chondrogenicdifferentiation of ADSCs(×100)A: 成脂诱导后ADSCSs呈红色(油红O染色);B: 成骨诱导后ADSCSs呈深红色(茜素红S染色);C: 成软骨诱导后ADSCSs呈蓝色(阿利新蓝染色)
2.4 慢病毒构建CCR2-EGFP-ADSCs和EGFP-ADSCs
慢病毒感染ADSCs后,于48h时在荧光显微镜下,EGFP-ADSCs组和CCR2-EGFP-ADSCs组均可观察到EGFP表达,至72h时,荧光表达较强,转导效率可达70%,见图4。

图4 ADSCs感染72h后镜下观察荧光(×10)Fig.4 Expression of EGFP in ADSCs at 72 hours after transfection(×10)图中可见转染72h时,图A图B荧光表达均较强,细胞形态呈梭形,与正常细胞形态并无差别
2.5 皮肤愈合情况检查
皮肤创伤造模及细胞移植后各组小鼠均存活,体征均正常。造模后每天测量并记录创面愈合情况,可见CCR2-EGFP-ADSCs组伤口愈合相较于另外两组明显变快,见图5。CCR2-EGFP-ADSCs组、EGFP-ADSCs组和对照组第5、9天的创面愈合率分别为(68±3.1)%和(91±2.1)%、(63±2.7)%和(87±2.1)%、(58±3.5)%和(80±2.9)%。结果显示注射了ADSC的两组愈合速度显著好于PBS对照组(P<0.05)。CCR2-EGFP-ADSCs组愈合速度显著好于EGFP-ADSCs组(P<0.05)。

图5 ADSCs移植对小鼠皮肤创伤愈合的作用Fig.5 Wound healing effects of ADSCs transplantation图中显示3组小鼠与造模后创面愈合情况,可见初始伤口面积均一,随着时间推移,注射了ADSC的两组伤口收缩速度,即愈合速度显著好于PBS对照组(P<0.05);CCR2-EGFP-ADSCs组愈合速度显著好于EGFP-ADSCs治疗组(P<0.05)
2.6 皮肤组织H-E染色结果
术后第9天,镜下可见相对于正常皮肤组织,对照组、EGFP-ADSCs组和EGFP-CCR2-ADSCs组新增上皮生长活跃,有增生的血管腔,大小不一,真皮层厚度均有增加,但3组间厚度无显著性差异。相比对照组,EGFP-CCR2-ADSCs组和EGFP-ADSCs组皮肤真皮层中存在较明显的类似于正常皮肤的毛囊结构,且EGFP-CCR2-ADSCs组较EGFP-ADSCs组更密集,可见多个椭圆形尚未成熟的毛囊结构,见图6。
表1各组小鼠不同时间点皮肤创面愈合率比较

Tab.1 Comparison of wound healing ratio in different groups
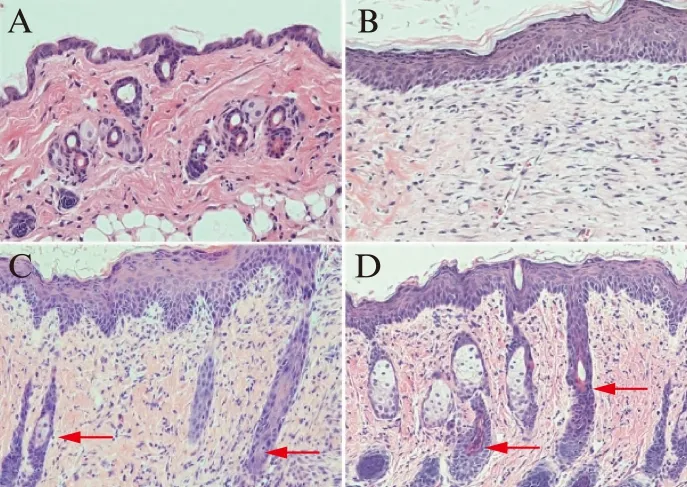
图6 各组小鼠皮肤组织H-E染色结果Fig.6 H-E staining results of skin tissue(×200)A: 正常皮肤组织;B: 对照组(注射PBS);C: EGFP-ADSCs组;D: EGFP-CCR2-ADSCs新增上皮情况;图B、C、D显示皮肤组织均生长活跃,有增生的血管腔,大小不一,真皮层厚度均有增加,但3组间厚度无显著性差异;图C、D显示存在较明显的类似于正常皮肤的毛囊结构,红色箭头所示
3 讨 论
皮肤是最大的人体器官,机械外伤、组织切除手术和疾病(如糖尿病足)等多种原因均会造成皮肤创伤。近来,随着干细胞应用研究的不断深入,越来越多的临床前和临床研究证明了干细胞移植对于皮肤损伤修复的治疗效果[6-7]。在众多类型干细胞中,来源于中胚层的ADSCs具有多方向分化潜能,因获取途径广泛,获取代价小,不涉及伦理问题等优势,成为干细胞治疗优选[8-10]。本研究通过流式细胞分选检测脂肪组织分离获得的原代细胞,发现其高表达ADSCSs表面抗原如CD44(95%)、CD73(99.5%)和CD105(98%),基本不表达CD31,并且在特定的分化培养液中分化为骨、软骨、脂肪样细胞群,验证了ADSCs的多向分化潜能。
相关研究发现,大多数情况下,移植的ADSCs在体内往往是短暂存在的,对于损伤发生部位的靶向性较差[11],其可能的原因涉及几种重要的细胞运输相关分子,如趋化因子和趋化因子受体[12]。在皮肤损伤修复炎性反应阶段,损伤部位分泌大量趋化因子,趋化因子通过其受体招募多种细胞参与损伤修复(如调控白细胞黏附、外移、归巢),趋化因子受体是一类介导行使功能的GTP-蛋白偶联的跨膜受体(GPCR),通常表达于免疫细胞、内皮细胞等胞膜上,能够与趋化因子特异性结合从而诱导免疫细胞至感染和炎症部位[13]。CCR2是重要的趋化因子受体,能通过和多种趋化因子(MCP-1、MCP-2、MCP-3、MCP-4、MCP-5)结合,广泛参与细胞的招募和介导[14-15]。相关研究表明在人ADSCs中缺乏炎症趋化因子受体CCR2。基于CCR2能增强细胞的迁移和聚集、加快组织修复过程的特点,本研究在人ADSCs中利用慢病毒感染法过表达CCR2,加强细胞炎症趋化能力,研究其是否能更加有效地促进皮肤创伤的愈合。本实验在小鼠背部制造0.8cm×0.8cm皮肤全皮层切除创面,模拟皮肤损伤,于造模第2天分别皮下注射CCR2-EGFP-ADSCs、EGFP-ADSCs和PBS。皮肤创伤造模及细胞移植后各组小鼠均存活,活动自如,各项体征均正常,未见血尿和血便。对比造模后0~9d伤口愈合情况,可见移植了ADSCs的两组小鼠伤口在注射细胞后愈合速度均高于注射PBS的对照组(P<0.05);CCR2-EGFP-ADSCs组愈合速度最快,高于EGFP-ADSCs组(P<0.05)。移植了ADSCs的两组新生皮肤真皮层中存在较明显的类似于正常皮肤的毛囊结构,对照组中未发现此结构,并且EGFP-CCR2-ADSC组较EGFP-ADSC组更密集,可见多个椭圆形尚未成熟的毛囊结构,提示过表达CCR2的ADSCs在一定程度上促进创伤修复再上皮化。
综上所述,本研究通过慢病毒感染构建过表达CCR2的ADSCs,移植到创伤模型小鼠的创面四周,与常规的ADSCs治疗法和注射PBS的对照组进行比较,可见愈合速度显著加快,并有促进上皮化趋势,初步证实了过表达CCR2促进ADSCs对皮肤损伤的修复,但其具体分子机制尚需进一步深入研究。
