恶性疟原虫PfMAg-1对裂殖子入侵功能的影响*
2018-11-09王振生高宇辉
高 雪 王振生 高宇辉 王 恒
(中国医学科学院基础医学研究所病原生物学系,北京 100005)
疟原虫在宿主红细胞内经裂体增殖过程而导致红细胞破坏、裂殖子释放入血后的再次入侵其它红细胞是造成宿主发病的原因。在这个过程中,恶性疟原虫裂殖子是唯一游离于红细胞存在的形式,可诱导机体产生针对裂殖子相关抗原的特异性抗体,并通过补体激活以及调理作用有效清除裂殖子(Bouharoun-Tayounetal., 1992)。因此,在设计红内期疟疾疫苗时,疟原虫裂殖子表面的抗原多被选用为候选抗原(Crunkhorn, 2018)。
在恶性疟原虫裂殖子入侵过程的不同阶段,顶膜抗原-1(apical membrane antigen 1,AMA1)、相对分子量为175 kDa的红细胞结合抗原(erythrocyte binding antigen, EBA175)、裂殖子表面蛋白1~8(merozoitesurfase protein, MSP)等微线体、棒状体蛋白、裂殖子表面蛋白在裂殖子接触、粘附红细胞,内陷形成纳虫空泡时发挥了关键作用(de Koning-Wardetal., 2003; Chiuetal., 2016),与裂殖子入侵相关的蛋白是红内期疟疾疫苗研发的重要靶蛋白(Patarroyoetal., 2017)。迄今为止,MSP1是最受关注的裂殖子表面蛋白之一(Kochetal., 2017; Pauletal., 2018)。研究表明,3~8岁患疟疾儿童体内的抗MSP119抗体能够有效抑制裂殖子入侵红细胞(Rileyetal., 1992)。临床实验显示,将以MSP142为基础的疫苗FMP1-AS02 A接种马里的成人后,其体内产生的IgG抗体能够特异性识别恶性疟原虫株MSP1蛋白(Theraetal., 2006),但是将此疫苗接种肯尼亚儿童后却未产生有效的保护(Ogutuetal., 2009)。因此,基于单一MSP1的疟疾疫苗依然存在不足,有必要筛选新的裂殖子相关蛋白,作为疟疾疫苗的候选抗原。
pfmag-1是本实验室利用保护性单克隆抗体筛选出的恶性疟原虫红内期表达基因。该基因位于恶性疟原虫4号染色体,全长2 912 bp,在基因组上仅有一个拷贝(路妍, 2001)。序列比对分析发现,pfmag-1基因仅为恶性疟原虫所特有,在其他型感染人类的疟原虫中均未发现其全长同源序列,只检索到PfMAg-1蛋白C端与约氏鼠疟原虫的PypAg-1蛋白C端有42%的同源性(高宇辉, 2007)。曾有研究报道PypAg-1蛋白免疫可以有效降低感染小鼠的虫血率,延长小鼠的存活时间(Burnsetal., 1999)。由此推测,PfMAg-1蛋白可能是恶性疟原虫表达的重要蛋白。本实验室的前期研究显示,PfMAg-1蛋白分子量为70.2 kDa,是恶性疟原虫裂殖子表面相关蛋白,在裂殖体晚期表达,且具有期特异性(高芳明, 2002)。间接免疫荧光实验显示PfMAg-1分布在裂殖子细胞膜表面附近(Gaoetal., 2009),提示该蛋白与裂殖子入侵红细胞过程相关。疟原虫的体外生长抑制实验证实,抗PfMAg-1蛋白C端重组蛋白的抗体对体外培养的恶性疟原虫抑制率可达73%(Gao, 2002),提示PfMAg-1可能作为疟疾疫苗的候选抗原。为了进一步研究PfMAg-1在恶性疟原虫红内期的生物学作用,本研究利用CRISPR/dCas9技术构建了用于敲低疟原虫PfMAg-1表达的质粒,获得PfMAg-1低水平表达虫株。裂殖子入侵实验证实PfMAg-1低水平表达可降低恶性疟原虫裂殖子入侵效率,提示PfMAg-1蛋白参与了恶性疟原虫裂殖子入侵红细胞的过程。
1 材料与方法
1.1 主要试剂
pCas9-BSD-sgRNA(pCBS)-dCas9Stu1-PfSir2a(上海巴斯德研究所江陆斌教授课题组惠赠),质粒小提试剂盒、qRT-PCR试剂盒(全式金),限制性内切酶、T4连接酶(NEB),无内毒素质粒大提试剂盒(MN)、KOD高保真DNA聚合酶(TOYOBO),通用型柱式基因组提取试剂盒(北京康为世纪),胶回收试剂盒(QIAGEN),无缝克隆试剂盒(南京诺为赞)。
1.2 敲低质粒的构建
登录CRISPR RGEN Tools网站(http://www.rgenome.net/)(Cuietal., 2018),设计靶向pfmag-1基因特异性的向导RNA(single guide RNA, sgRNA):A T G C A T G T T T C C G C T G C T TG。根据同源重组法的原理,设计上游引物:5′-A G T A T A T A A T A T T G G T A C G T A T G C A T G T T T C C G C T G C T TG-3′;下游引物:5′-T C T A G C T C T A A A A C A G G C C T C A A G C A G C G G A A A C A T G C AT-3′,并将单链互补DNA退火成双链DNA。参照无缝克隆试剂盒说明书,将双链DNA与经SnaBⅠ、StuⅠ双酶切的原始质粒pCas9-BSD-sgRNA(pCBS)-dCas9Stu1-PfGCN5连接。连接产物转化感受态细菌DH5α,并涂抗性(含100 μg/mL氨苄青霉素)平板,在平板上挑取数个重组菌,进行酶切鉴定并送上海生工生物工程有限公司测序。此为敲低疟原虫中pfmag-1基因的质粒,记为MAg1KD。
1.3 恶性疟原虫的转染
需要转染的质粒:敲低质粒MAg1KD、未连接sgRNA的原始质粒pCas9-BSD-sgRNA(pCBS)-dCas9Stu1-PfSir2a,作为对照。取虫血率为5%,生长时期为14~16 h的环期疟原虫,适量1×Cytomix洗涤2次。电转体系为:含环期疟原虫的红细胞100 μL,质粒100 μL(质粒浓度需稀释为1 μg/μL),2×Cytomix 200 μL。将电转混合物转入2 mm电击杯进行电转,电转化参数为310 V,950 μF,电阻无穷大,狭缝2 mm3。电转完成之后将混合物转移至培养皿中,加入适量完全培养基置于37℃三气培养箱培养。
1.4 转染虫株的筛选与鉴定
在转染第3 d,疟原虫为环状体期,且原虫率达7%~10%时,开始使用含2.5 nmol/L BSD的完全培养基至筛选出转染虫株:敲低株MAg1KD虫株及对照株Control虫株。PCR扩增药物筛选基因bsd:阴性对照以3D7虫株的基因组DNA为模板扩增bsd基因;阳性对照以Control虫株的基因组DNA为模板扩增bsd基因,实验组以MAg1KD虫株的基因组DNA为模板扩增bsd基因。设计上游引物:5′-A G C A T C C C C A T C T C T G A A G AC-3′,下游引物为:5′-C A C A T A A C C A G A G G G C A G C AA-3′。参照KOD高保真DNA聚合酶说明书,反应条件为:94℃预变性2 min后进入循环;98℃ 10 s,55℃ 30 s,68℃ 15 s,延伸35个循环;最后68℃充分延伸7 min。PCR产物经1%琼脂糖凝胶电泳,回收目的片段并进行纯化,将纯化后的PCR产物送上海生工生物公司测序。
1.5 疟原虫中pfmag-1基因mRNA转录水平的检测
采用实时荧光定量PCR法检测。由于pfmag-1基因在疟原虫的裂殖体期高表达,因此对MAg1KD虫株与Control虫株连续2次同步化,40 h后即为裂殖体时期,提取MAg1KD虫株和Control虫株裂殖体期的总RNA。以总RNA为模板,反转录成cDNA后进行实时荧光定量PCR。pfmag-1基因上游引物序列为5′-C G T G C C C T A G T G A G T G C A TG-3′,下游引物序列为5′-C A T C G C T A A A T G C T C A T C A T TG-3,扩增片段大小为137 bp;内参U6基因的上游引物序列为5′-G G C T C T C T T C G G A G A T G C C G TT-3′,下游引物序列为5′-A A A A A A T T A C A T T C C T T C T C G A A CG-3,扩增片段长度为130 bp。反应条件为:95℃ 5 min进行预变性;95℃ 10 s,60℃ 15 s,72℃ 20 s,进行40个循环。反应在ABI7300荧光定量PCR仪上进行,设cDNA样品3次重复。利用2-ΔΔCt相对增量法计算相对表达量。
1.6 转染虫株生长曲线的绘制
将筛选得到的转染虫株扩大培养,连续两次5%D-山梨醇同步化后,涂片计算虫血率。于6孔板中,每孔200 μL含虫红细胞并调整初始虫血率为0.1%,以此时虫血率数值为第1 d,以后每隔24 h统计虫血率,连续统计8 d,统计期间只更换培养基,不增加或弃去红细胞,每个样品设置3个复孔,重复3次实验。最后以时间为横坐标,虫血率数值为纵坐标,绘制转染虫株的生长曲线。上述转染虫株生长至40 h时,为疟原虫的裂殖体时期,各随机选择50个疟原虫,对裂殖体内的裂殖子数目进行统计,每个虫株设置3个复孔,重复3次实验。
1.7 裂殖子入侵红细胞能力实验
富集晚期裂殖体,涂片计算此时虫血率。于6孔板中,每孔200 μL含虫红细胞并调整初始虫血率为0.5%,以此为初始时间,继续培养至12 h,此时为环状体时期,涂片计算虫血率,每个虫株设置3个复孔,重复3次实验。
1.8 统计学方法
2 结果
2.1 敲低质粒MAg1KD的构建
设计靶向pfmag-1基因的sgRNA,sgRNA引导dCas9识别靶基因pfmag-1,在dCas9携带的抑制蛋白Repressor作用下抑制pfmag-1基因的表达(图1)。
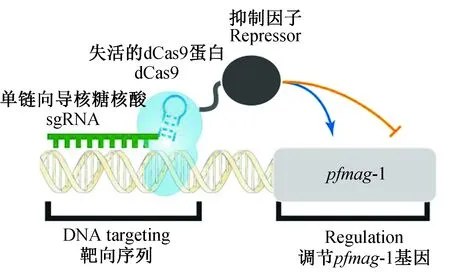
图1 CRISPR/dCas9技术下调pfmag-1原理示意图Fig.1 Schematic of knocking down pfmag-1 by CRISPR/Cas9
2.2 虫株的转染和鉴定
通过电穿孔技术将Control质粒和MAg1KD质粒转染恶性疟原虫3D7虫株,经过40 d BSD药物筛选获转染虫株。为了评价转染是否成功,利用PCR检测转染虫株内的Control质粒与MAg1KD质粒,结果显示,PCR成功扩增到bsd基因,其特异条带在琼脂糖凝胶电泳399 bp位置,与理论长度一致,进一步测序结果表明,序列与BSD编码序列完全相符,说明Control质粒和MAg1KD质粒成功转入恶性疟原虫3D7虫株内(图2-A)。为了检测pfmag-1基因mRNA表达是否受到调控,通过qRT-PCR检测pfmag-1基因的转录水平。与Control虫株相比,MAg1KD虫株转录水平降低了65.32%,表达水平具有统计学差异(P=0.0403)。说明MAg1KD虫株中PfMAg-1表达显著降低(图2-B)。
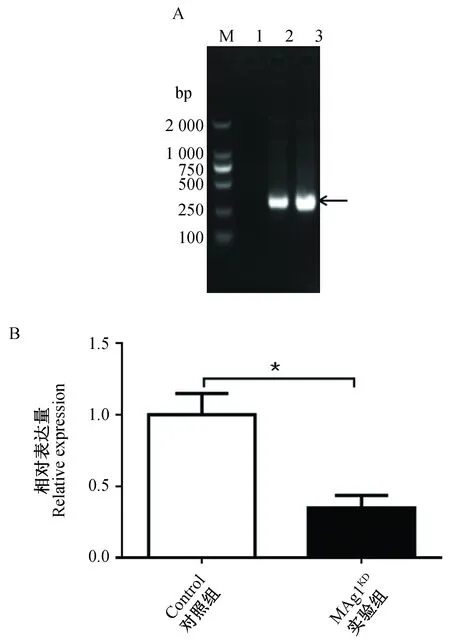
图2 转染虫株的鉴定Fig.2 Identification of positive strainsA. 药物筛选基因bsd的PCR鉴定. M:DNA Marker DL2000;1:未转染质粒的3D7虫株;2:转染对照质粒Control的虫株; 3:转染敲低质粒MAg1KD的虫株。B. 裂殖体期pfmag-1基因mRNA转录水平的qRT-PCR验证。A. PCR identification of bsd. M. DNA Marker DL2000;1∶3D7 strain of untransfected-plasmid; 2:Control strain of control plasmid transfected; 3:MAg1KD strain of knock-down plasmid transfected. B. qRT-PCR validation of transcript levels of pfmag-1 mRNA in schizont stage.
2.3 pfmag-1基因下调表达降低裂殖子入侵能力
通过长达4个周期的体外培养,观察绘制MAg1KD虫株与Control虫株的生长曲线,结果显示,与对照组相比,MAg1KD虫株的生长速度低44.77%(44.77%±26.20%)(图3-A),提示pfmag-1具有上调疟原虫体外增殖的作用。为探究其内在原因,本研究观察了MAg1KD虫株裂殖子数目及其入侵功能变化给增殖带来的影响。裂殖子数目计数结果显示,MAg1KD虫株与Control虫株的裂殖子数目没有统计学差异(P=0.3693)(图3-B)。裂殖子入侵红细胞能力实验结果显示,MAg1KD虫株的虫血率比对照组Control虫株低43.31%,即下调PfMAg-1表达的疟原虫,裂殖体期裂殖子入侵能力显著降低,差异具有统计学意义(P=0.0369)(图3-C)。由此,MAg1KD虫株的体外增殖速率的降低是由裂殖子入侵红细胞能力的下降引起的。
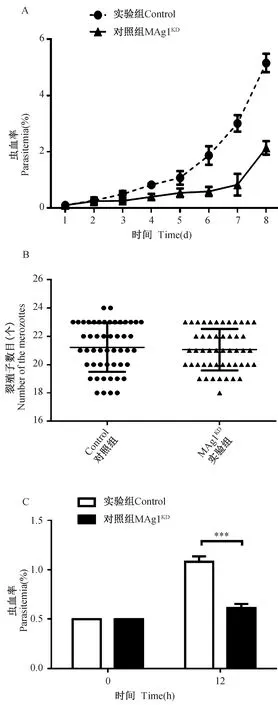
图3 下调pfmag-1基因降低裂殖子入侵能力Fig.3 Reducing merozoite invasion with knocking down of pfmag-1 geneA. 转染虫株的生长曲线; B. 转染虫株的裂殖子数目实验; C. 转染虫株的裂殖子入侵实验。A. Growth curve of transfected strains;B. The number of merozoites in transfectants;C. Invading experiment of the merozoite of transfected strains.
3 讨论
本实验室利用传统的同源重组介导的打靶技术构建敲除pfmag-1基因的质粒,多次重复转染实验未能获得转染虫株,而相同技术条件下获得了对照组pfmif基因敲除的恶性疟原虫虫株(郭莉, 2015),因此我们认为未能获得pfmag-1基因敲除虫株可能有两方面的原因:(1)pfmag-1是恶性疟原虫生长的必需基因,敲除该基因会导致疟原虫死亡;(2)尽管多次转染,但由于传统的同源重组介导的打靶技术的效率较低,仅约10-6(Capecchi, 1989),且从质粒转染到筛选出特定虫株需要6~12个月的时间,因此不能排除转染技术未获成功这一因素。本研究采用了江陆斌实验室的CRISPR/dCas9技术。该技术衍生于CRISPR/Cas9基因操作原理(Simonetal., 2018),在CRISPR/Cas9基础上通过点突变的方式将Cas9失活得到dCas9(dead Cas9),使核酸酶失去切割活性,同时保留其特异靶向目的基因的功能,通过干扰靶基因的表达达到基因表达调控的目的(Pulecioetal., 2017)。在本研究中,通过设计特定sgRNA使dCas9和pfmag-1结合,由于dCas9与抑制基因表达的蛋白融合,从而可以实现下调pfmag-1基因的表达,从而排除上述两种因素导致的对实验结果分析的不确性,为探究pfmag-1基因的生物学功能提供了更为有效的技术手段。
PfMAg-1在红内期恶性疟原虫晚期特异性表达且定位于裂殖子细胞膜表面,这些特点均提示PfMAg-1在红内期恶性疟原虫进入裂殖体和裂殖子的发育繁殖阶段中发挥作用。本研究通过PfMAg-1低表达虫株的构建,发现当PfMAg-1的表达水平降低后,恶性疟原虫裂殖子入侵红细胞的机会明显受到抑制,进一步表明PfMAg-1具有促进裂殖子入侵新的红细胞从而升高虫血率的作用。尽管如此,PfMAg-1在这一过程中的具体分子机制仍待进一步验证。
由于PfMAg-1位于裂殖子膜外,在裂殖子释放入血及侵入红细胞的过程中显然会被宿主免疫效应细胞识别、递呈,随之诱导产生针对PfMAg-1蛋白的特异性抗体,参与裂殖子的清除。鉴于PfMAg-1是恶性疟原虫特有的抗原蛋白,在宿主和其他物种中没有类似物,因此有可能成为疟疾疫苗的候选靶抗原。
综上,本研究通过PfMAg-1对红内期恶性疟原虫裂殖子入侵功能的探讨证实其在裂殖子入侵红细胞时发挥重要作用,为进一步评价PfMAg-1蛋白作为潜在疟疾疫苗候选物的研究奠定了基础。
