多模式心脏影像学在缺血性心力衰竭患者介入左心室重建中的作用
2018-11-09王建张哲义赵之伟赵军卢庆王焱
王建,张哲义,赵之伟,赵军,卢庆,王焱
人口老龄化和各种心脏疾病终末期导致慢性心力衰竭(心衰)的患病率逐年增加,沉重的医疗负担和预后差是患者及家庭面临的严峻问题。缺血性心肌病患者通常无法在心肌梗死(心梗)时间窗内开通罪犯血管,导致大面积心肌坏死后形成疤痕[1]。心脏外科既往在冠状动脉(冠脉)旁路移植的同时切除梗死区域的疤痕,进行左心室重建,在部分患者中能够改善预后[2]。但外科手术创伤大、费用多,手术风险高,因此未能在临床上广泛开展。目前,通过经导管途径的左心室重建术或左心室分区术,旨在减小左心室容积,改善或消除大面积左心室疤痕患者的室壁活动异常,增加患者心输出量并降低血栓栓塞和疤痕相关的恶性心律失常的发生,是缺血性心衰介入器械治疗领域的热点。我院于2015年初开展经导管途径使用PARACHUTE装置进行左心室重建,目前已成功完成25例。2017年初我院心脏团队使用REVIVENT系统完成8例心外膜左心室重建。早期临床研究[3-6]结果显示,该方法有较高的手术成功率和短期安全性,术后患者的有创心排量、超声心动图以及包括NYHA心功能分级、6分钟步行试验在内的心功能指标均较术前有所改善。多模式心脏影像学检查在左心室重建的患者筛选、介入器械选择、手术方案及心功能评估、远期预后判断等方面,与以往外科左心室重建有较大不同。本文将通过介绍介入左心室重建的器械治疗进展,重点阐述多模式心脏影像学评估在伴有左心室严重重构的缺血性心力衰竭患者中的应用。
1 缺血性心力衰竭患者的左心室功能的临床评估
缺血性心力衰竭患者由于陈旧性心肌梗死,坏死心肌收缩力下降或丧失,左心室收缩顺序改变、疤痕区域的矛盾运动,严重影响心梗后重塑的左心室功能[7];在心腔内压力的作用下,坏死处的疤痕组织向外膨出形成室壁瘤,是急性心梗后的常见并发症之一[8]。室壁瘤内血栓栓塞的风险也是导致心梗患者再次发生心脑血管事件的重要因素[9]。此外,心梗后大面积疤痕形成的缺血性心力衰竭患者伴有恶性心律失常、心功能不全或功能性的二尖瓣返流时,是ICD、CRT(-D)或MitraClip的植入指征。但国内左室射血分数(LVEF)降低的缺血性心肌病患者ICD的植入率很低[10],梗死疤痕区域的存在导致患者对心脏再同步化治疗的低应答[11]。STICH研究中,冠脉旁路移植时行左室重建也未能降低缺血性心衰患者的总体死亡率[12];但后期亚组研究[2]分析显示,外科左心室重建后,左心室收缩末容积指数减小>30%或>60 ml/m2,死亡风险明显降低。
因此,筛选适当的缺血性心力衰竭患者,进行左心室重建,能够消除左心室室壁瘤或心肌疤痕区域的矛盾运动,减小左心室容积。根据Laplace定律,室壁的应力直接与心室腔直径与收缩压乘积有关,与室壁厚度呈负相关。减小左心室容积,使左心室舒张末内径缩小,心脏收缩做功减少。在筛选患者时,详尽的病史询问是临床决策的基础,包括患者心梗的救治情况,再血管化和抗血小板、抗心衰药物等治疗策略;临床上使用纽约心功能分级、6分钟步行试验及明尼苏达心力衰竭生活质量评分等工具对患者的心功能状态进行评估;心脏彩超作为最易获得的影像学工具可对患者的左心室形态、血栓、疤痕节段或室壁瘤范围、心肌收缩功能及合并的瓣膜疾病进行初步了解。此外,通过生化检查了解肾功能、血脂控制、B型脑钠肽(BNP)/N末端脑钠肽前体(NT-proBNP)水平,有助于进一步判断患者全身器官储备状况。通过多学科组成的心脏团队,讨论患者心功能、心肌灌注状况、心衰药物的优化以及进行左心室重建可能带来的益处及风险。
2 缺血性心力衰竭患者的左心室功能评估
以往对于心脏影像学在左心室重建中的应用,仅局限于对左心室解剖结构的了解。而左心室重建的临床决策需要更多的容量、心梗疤痕范围、心室同步化、室壁应力及心尖形态等方面的评估。左心室容积的准确测量对于左心室收缩功能的评估具有重要意义。左心室容积测量的常用检查方法包括:左室造影、心脏CT、心脏超声和磁共振。左室造影基于二维图像的粗略计算,误差较大。心脏超声和心脏CT有多种计算容积的方法,但其计算是基于一定的几何假设,与患者实际情况有一定误差,尤其是在患者的左心室形态发生明显改变的情况下,如对心梗后室壁瘤患者采用心脏彩超测量的左心容积是不准确的。作为容积测定金标准的心脏磁共振,不基于任何几何假设,将心室腔进行逐层扫描,最后经计算得出心室腔容积。
此外,切除室壁瘤后的左心室整体同步收缩对于手术结果以及远期预后判断具有重要意义。既往研究表明,左心室重建后左心室的同步化收缩明显改善,一方面与手术切除了不同步化区域有关;另一方面,由于左心室重建切除了室壁瘤,对非心梗区域的室壁应力也有一定的影响。除了传统的心脏彩超可以对室壁运动的同步性做出评估外,心脏磁共振的tagging技术,也可对手术前后左心室心肌的同步化运动情况进行了解。
3 介入左心室重建的器械及患者纳入标准
目前已运用于临床的介入左心室重建装置包括PARACHUTE和REVIVENT装置,手术器械原理和过程详见既往临床报道[5,6]。国际上相关临床研究[13]在进行当中,所采用的筛选程序有共同的纳入和排除标准,但所采用的不同器械也有不同的纳入和排除标准(表1)。
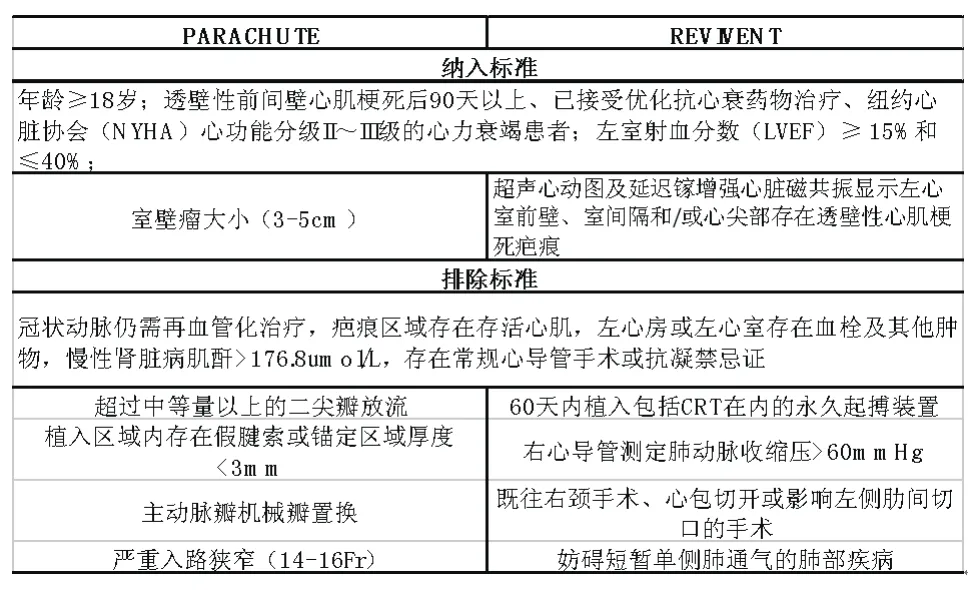
表1 介入左心室重建的筛选标准
PARACHUTE系统是Cardiokinetix公司专门研制的用于治疗伴有心尖部室壁瘤形成的缺血性心力衰竭患者的介入器械装置。该装置包括入路系统、输送系统和心室分区系统3部分,通过14F和16F两种型号的的鞘管和扩张器,将65~95 mm四种不同大小的伞状封堵器送至植入部位,通过头端的球囊打开植入装置,使植入装置的金属支架锚定于附着部位,实现室壁瘤和左室正常心肌的分区(图1)。植入装置的表面覆有膨体聚四氟乙烯,装置植入后需抗凝3个月待内皮覆盖装置。由于该装置是在不断活动的心室腔内植入伞状装置隔离正常心室腔和室壁瘤。由于心脏彩超难以在我们采用心电门控的心脏CT回顾性扫描,对一个心动周期(0~100%)每10%进行左心室重建,测量收缩期和舒张期的左心室心尖部室壁瘤的周长、高度并选择植入器械的大小;根据室壁瘤与正常心室腔、主动脉的空间关系,选择适当形态的指引导管。此外,通过心脏CTA排除室壁瘤内血栓(图2A)、植入区域存在假腱索(图2B)及钙化(图2C)等影响PARACHUTE植入等情况。血栓是所有介入左心室重建的禁忌症,心脏彩超由于心尖部近声场的影响,发现心尖部血栓的敏感性相对较低,尤其是对PARACHUTE植入后降落伞内形成血栓,通过经胸心脏彩超难以发现。心脏CTA或磁共振的敏感性较高。在PARACHUTE植入术后1年的患者随访中,心脏彩超未发现,而心脏CTA发现PARACHUTE伞内形成血栓(图3),而后对该患者延长华法林抗凝时间并严密监测INR达标后血栓消失。
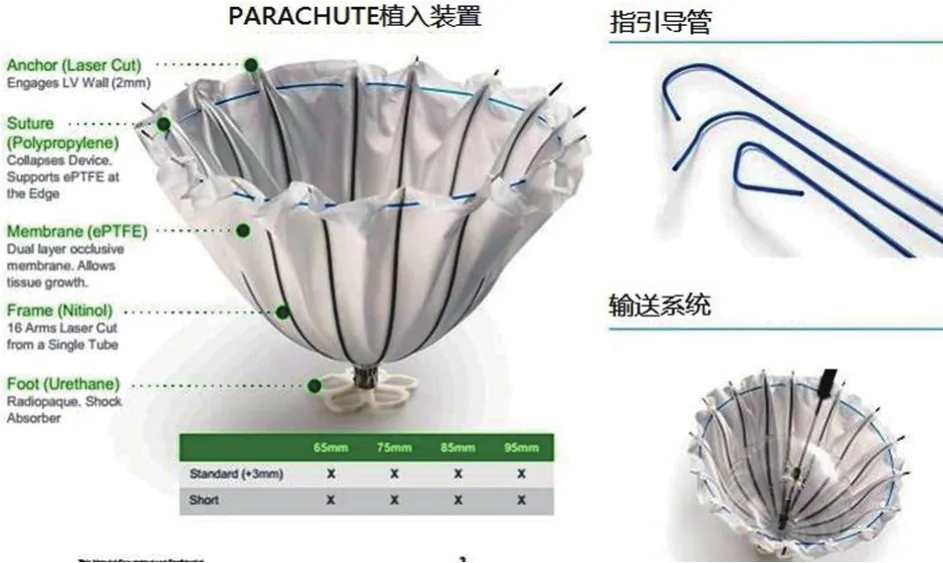
图1 介入左心室重建的筛选标准
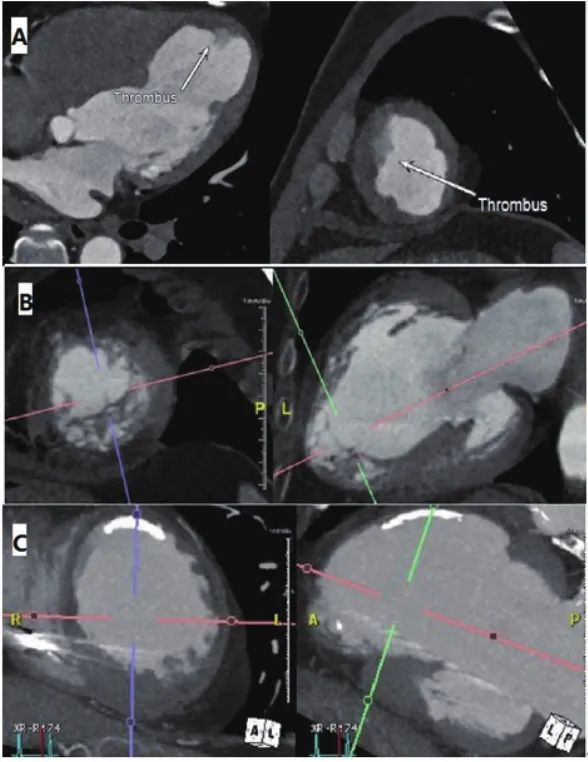
图2 心脏CTA中影响PARACHUTE植入的情况
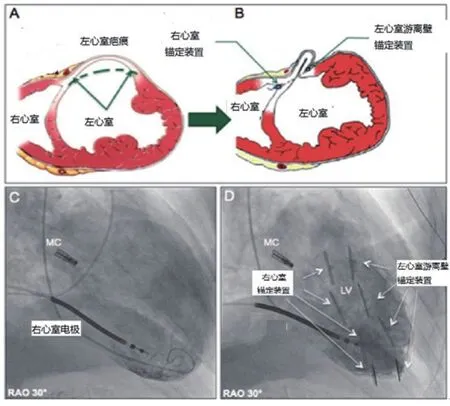
图3 Revivent系统及原理
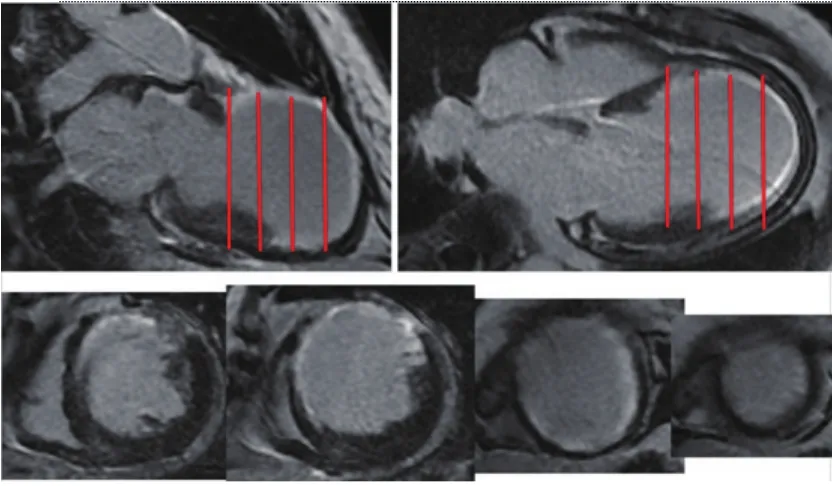
图4 典型的前间壁心梗疤痕
REVIVENT系统是BioVentrix公司研发的用于减小心肌梗死后前间壁大面积心肌梗死疤痕的缺血性心力衰竭患者。该系统通过穿刺右侧颈内静脉置入14F鞘管和左胸侧切口建立手术入路,利用分别置于室间隔右室流出道的内锚定和左心室游离壁的外锚定,将心梗疤痕游离出左心室,起到减小左心室有效容积和恢复心尖锥形结构的作用(图4)。该装置除了常规的心功能评估方法外,极依赖于对心肌梗死疤痕范围的确定。目前,磁共振延迟镓增强能够显示心肌梗死后纤维化的疤痕组织(图5),对于手术范围的判断具有重要的指导意义。
综上所述,介入左心室重建是未来心梗后出现严重左心室重构的缺血性心衰患者的重要器械治疗手段。以多模式的心脏影像学评估为基础,通过经导管或杂交手术的方式,对梗死疤痕区域进行处理,消除矛盾运动、改善心室同步,缩小左心室容积以降低室壁应力,降低心脏氧耗,提高患者心功能。
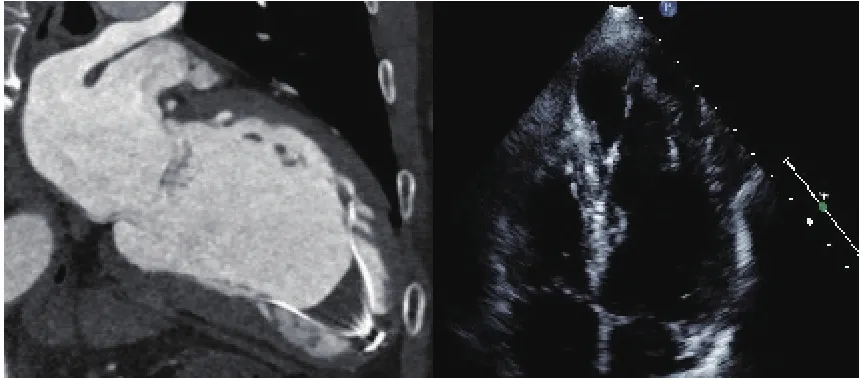
图5 PARACHUTE伞内血栓
