microRNA在心房颤动电重构及治疗中的进展
2018-11-09周天一金艳韩志君
周天一,金艳,韩志君
心房颤动(房颤,AF),是临床上最常见的心律失常之一,房颤具有极高的卒中、心力衰竭风险,也是认知障碍、痴呆的独立危险因素。房颤主要由心房重构,自主神经系统改变,炎症因子和氧化应激,肾素-血管紧张素-醛固酮系统异常等引起[1]。而心房重构在房颤中起到至关重要的作用。miRNA是一类大约22个核苷酸的内源性非编码小分子RNA,通过与靶mRNA结合,参与mRNA降解或转录后翻译抑制,调控靶基因的表达。近年来大量研究表明,miRNA与房颤关系密切,对miRNA的研究进一步阐明了房颤的机制,为有效治疗房颤提供更多策略。
1 miRNA与房颤电重构
房颤的心房重构首先表现为电重构,即心房肌细胞离子通道的改变,导致跨膜离子流异常,引起心房有效不应期、动作电位时程缩短,动作电位传导速度减慢,不应期离散度增加等改变,逐步进展为持续性房颤并引起心房纤维化,细胞凋亡等结构重构。miRNA主要通过影响编码离子通道的基因,使其表达或功能异常,影响房颤的发生及发展。
1.1 钙通道钙离子通道主要分为L型与T型两种,目前研究主要集中在动作电位平台期主导内向电流的L型钙离子通道。miRNA-208b、miRNA-29a、miRNA-328、miRNA-155、miRNA-106b-25、miRNA-499经试验证实均通过钙通道影响房颤的发生及发展。
1.1.1 miRNA-208bmiRNA-208为心脏特异性miRNA,有miRNA-208a和miRNA-208b两种亚型,分别表达于心脏发育的不同阶段。2009年,Callis等[2]在小鼠模型上过表达miRNA-208a,从而导致心律失常的易感性增加。2013年,Nishi等[3]对29个进行心血管手术的患者的右心房组织进行miRNA微阵列分析,结果显示:与窦性心律患者相比,房颤患者miRNA-208b的含量明显上调。2016年,Susana等[4]对慢性房颤的患者与绵羊心房组织进行活检,发现miRNA-208b的水平上调,进一步研究发现,上调的miRNA-208b能减少L型钙离子通道亚基(CACNA1C和CACNB2)和肌浆网钙ATP酶(Serca2a)的表达并且降低其功能,从而影响房颤。
1.1.2 miRNA-29aZhao等[5]证实miRNA-29a-3p的靶基因是CACNA1C,房颤患者miRNA-29a-3p表达增多,通过沉默CACNA1C,减少L型钙离子通道的表达,从而降低L型钙通道离子流的密度,引起电重构。
1.1.3 miRNA-328Lu等[6]发现miR-328在犬的房颤模型和房颤患者中均有明显的上调。进一步的实验证实miR-328的靶基因为CACNA1C和CACNB1,它们分别编码L型钙离子通道α1c和β1亚基。过表达miR-328可抑制CACNA1C和CACNB1的表达,导致L型钙离子通道密度减低,动作电位时程缩短,诱发房颤的发作,而降低miR-328水平则可逆转这些影响。
1.1.4 miRNA-155有研究[7]比较非瓣膜性房颤患者和窦性心律患者左心房组织miRNA表达变化,发现房颤患者中miR-155的增加最为明显,通过计算预测编码Cav1.2的CACNA1C为miR-155的直接靶点。同时,质粒和基因测定的构建报告显示,miR-155能抑制CACNA1C的3'非翻译区的荧光素酶活性。可以看出Cav1.2和miR-155在房颤电重构中发挥了重要作用。
1.1.5 miRNA-106b-25研究表明,雷诺定受体(RyR2)蛋白的水平在阵发性房颤患者的心房中升高,Chiang等[8]通过建立miRNA-106b-25-/-的小鼠模型,发现总RyR2蛋白增加了42%,心肌细胞总肌质网钙离子渗漏增加。遥测心电监护记录显示miR-106b-25-/-小鼠表现出更频繁的心房异位搏动,且比野生型同窝小鼠更易于诱导房颤。可以认为miRNA介导的RyR2变化,引起的钙离子渗漏可能是房颤的潜在机制。
1.1.6 miRNA-499Ling等[9]研究表明,CACNB2是miRNA-499的重要靶目标,永久性房颤患者的心房组织与无房颤史的患者相比,CACNB2显著下调了67%,最终证实miR-499能与CACNB2的3'非翻译区的结合,抑制CACNB2的表达。miR-499介导的CACNB2表达下调可能在房颤电重构中具有重要作用。大多数影响L型钙离子通道的miRNA,如miRNA-208b、miRNA-29a、miRNA-328、miRNA-499,都是通过同时或抑制其中一个的亚基的靶基因,来达到抑制L型钙离子通道的目的,使钙离子回收减少;而miRNA-106b-25则通过增加钙离子的渗漏,引起细胞内的钙超载,诱发房颤。
1.2 内向整流钾通道(Ik1)
1.2.1miR-26Luo等[10]发现房颤的动物模型或患者miR-26水平降低,KIR2.1蛋白(Ik1的主要亚单位)水平上升,miR-26的过表达可抑制编码KIR2.1蛋白的KCNJ2的表达;相反,使miR-26表达降低可提高KCNJ2的表达,该结论在小鼠模型中得到了验证,可以认为miR-26控制KCNJ2的表达,其下调可能促进房颤的发生。
1.2.2 miR-1Girmatsion等[11]现永久性房颤患者心房组织的miR-1的水平显著下降,同时伴随编码KIR2.1亚基的KCNJ2基因的表达增加,导致Ik1的密度增加,引起动作电位时程缩短,进一步导致折返与房颤。
1.3 延迟整流钾通道(Iks)除了编码KIR2.1亚基的KCNJ2基因,研究表明,编码延迟整流钾通道的KCNE1和KCNB2也是miR-1的靶基因。Jia等[12]通过建立兔右心房快速激动的模型,发现miR-1表达上调,KCNE1和KCNB2下调,心房有效不应期(AERP)缩短,慢激活延迟整流钾通道电流(IKs)增加。当miR-1通过体内慢病毒感染进一步上调时,KCNE1和KCNB2下调更显著。最终通过荧光素酶活性测定证实KCNE1和KCNB2为miR-1的靶基因。电生理测试表明较短的AERP,极大增加房颤可诱导性。由此看来,miR-1具有诱导产生房颤的作用。
1.4 小电导钙激动钾离子通道3(SK3)SK3由KCNN3基因编码,被认为涉及房颤的病理生理过程。2013年Ling等[13]发现房颤患者的心房组织miR-499比窦性心律高2.33倍,而SK3蛋白表达下调46%。通过过表达以及敲除实验认为miR-499能够抑制KCNN3的3’非翻译区,从而抑制SK3的表达,提高房颤发生的可能性。对上述所有miRNA与各离子通道关系的总结(表1)。
2 miRNA与房颤治疗
目前对于房颤的治疗主要是药物转复、射频消融术等,或以控制心室率及抗凝药物、左心耳封堵预防血栓栓塞为主[14]。但房颤经射频消融术后仍复发可能,而保守治疗需长期口服抗凝药物,需患者有极高的依从性[15-17]。尽管抗凝治疗能有效预防卒中,但我国房颤患者的抗凝药物使用率仍然堪忧[18]。
以miRNA为治疗靶点的治疗方式可成为治疗房颤的新策略[19]。miRNA模拟技术(miR-Mimic)是一种基因沉默方法[20]。此方法是产生非天然双链miRNA样RNA片段,其5'端具有与靶基因特有的3'UTR中的选定序列部分互补的基序。一旦导入细胞中,模拟内源性miRNA结合其靶基因,产生基因的转录后抑制。对于已知的在房颤中水平下调的miRNA,或许可通过“miRNA mimics”,增强内源性miRNA的功能,拮抗房颤引起的心房重构。
对于在房颤中上调的miRNA,可通过antimiRNA、miRNA sponges、miRNA eraser、miRNA masks四种调节剂抑制其效应。抗miRNA(antimiRs)是一类携带miRNA的互补反向序列的反义寡核苷酸,通过与内源性miRNA的互补完全沉默其对靶基因的效应[21]。miRNA海绵(miRNA sponges)能够吸附miRNA,使其无法与天然靶点结合,降低miRNA效应,miRNA海绵对miRNA不是特异性的,但它们能够阻断具有相同靶位点的相关miRNA的整个家族,具体应用有待进一步研究[22]。miRNA擦除者(miRNA erasers):miRNA擦除者是与靶miRNA完全互补的寡核苷酸序列,能抑制内源性miRNA功能。miRNA面具(miRNA masks)与miRNA的靶基因具有完全互补的寡核苷酸,能与靶基因结合从而抑制miRNA与靶基因的识别、结合[23]。
miRNA尽管对房颤治疗极具前景,但真正应用于临床,仍有许多问题需要解决,如:miRNA调节剂的传递问题,如何有效地将其传递到靶器官而中途不被降解,不被肾脏滤过;另外,miRNA调节剂的选择性与安全性问题,大多数miRNA不具有特异性,miRNA调节剂可作用于不参与疾病过程的靶标,从而产生脱靶效应。
3 展望
尽管对于miRNA与房颤关系的研究还不够明确,但可以考虑在现有研究基础上,通过调节miRNA影响房颤的发生、发展,甚至治疗。
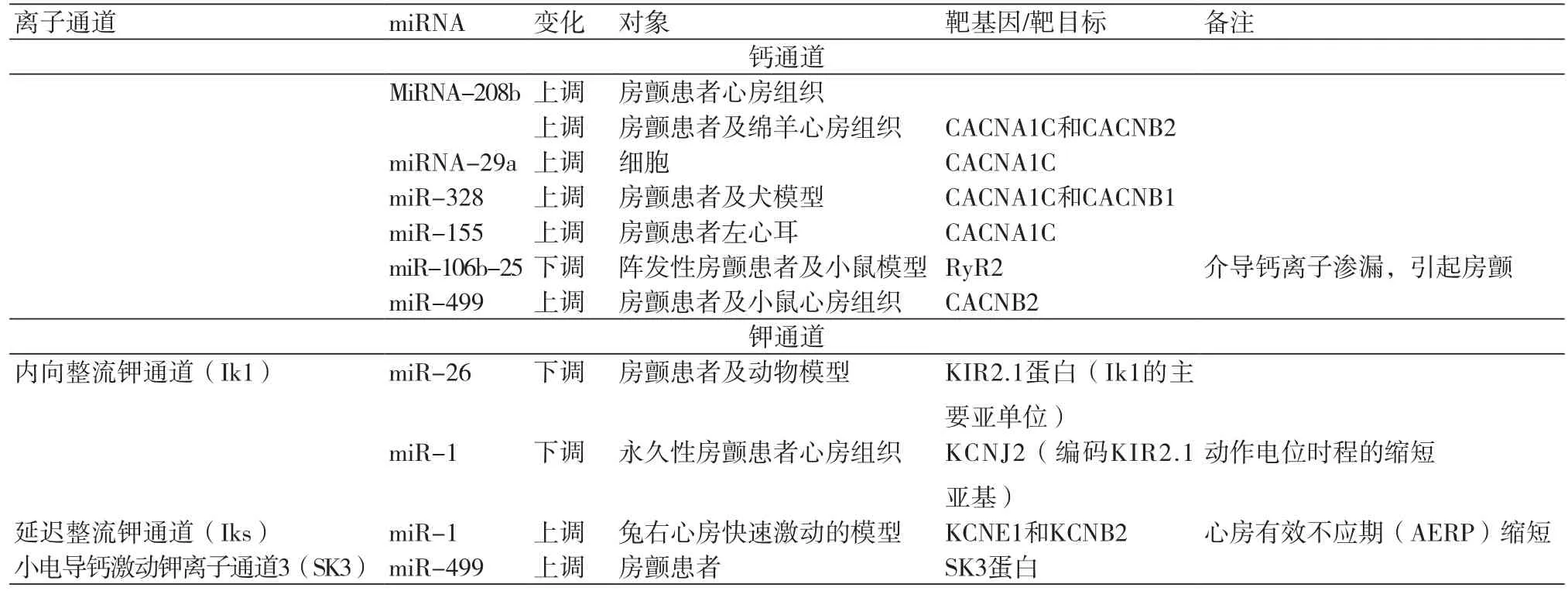
表1 miRNA与各离子通道
