PCI术后患者血小板中miR-26a、miR-223的表达水平与氯吡格雷抵抗的相关性研究
2018-11-09袁璞珺张竞超
袁璞珺,张竞超
近年来,随着我国社会老龄化问题的日益严峻,冠状动脉粥样硬化性心脏病(冠心病,CHD)的发病率一直居高不下,大大增加我国的医疗负担。目前,临床上主要采取经皮冠状动脉介入治疗(PCI)作为CHD的一线治疗方案,但是易形成支架内血栓,因此PCI术后辅以抗血小板药物尤为重要[1]。氯吡格雷作为血小板表面二磷酸腺苷(ADP)受体拮抗剂,具有不可逆抑制血小板聚集的作用,广泛用于CHD患者PCI术后抗血小板治疗[2]。但是,有研究显示,大约有4%~30%的患者对氯吡格雷缺乏反应或反应较低,称为氯吡格雷抵抗[3],及早诊断氯吡格雷抵抗对于选择合理的抗血小板治疗方案、预防微血栓形成具有十分重要的临床价值。但是目前关于氯吡格雷抵抗的发生机制尚不明确,缺乏快速有效的特异性诊断手段,越来越多的研究证实,微小核糖核酸(miRNA)与血小板的活化密切相关[4],但是关于miRNA与氯吡格雷抵抗发生的相关性研究尚少。基于前期研究,筛选血小板特异性高表达的miRNA作为候选标志物,包括miR-26a、miR-26b、miR-23a、miR-223,通过实验室方法检测miRNA在PCI术后患者血小板中的表达情况,探讨miRNA对氯吡格雷抵抗的潜在诊断价值。现研究报告如下:
1 资料与方法
1.1 研究对象与分组连续入选2017年1月~2017年12月于河南省职工医院心内科行PCI术的CHD患者168例,其中男性95例,女性73例,年龄为46~79(61.43±7.26)岁。入选标准:所有患者经冠状动脉造影确诊为冠心病;首次服用氯吡格雷服;既往未接受过PCI术治疗;由患者或家属签署知情同意书。排除标准:不符合上述纳入标准的患者;患者在治疗前出现严重的意识障碍或心力衰竭者;合并严重的肝肾功能不全者;合并严重的血液系统疾病、急慢性感染或伴有严重出血倾向者;合并恶性肿瘤者;氯吡格雷或阿司匹林禁忌者;受试前服用低分子肝素、抗感染药物、抗抑郁药物、苯二氮卓类镇静催眠药物者。根据检测患者血小板聚集抑制率,分为氯吡格雷抵抗组(66例)和正常组(102例)。本项研究已获得我院伦理委员会批准。
1.2 方法
1.2.1 治疗方法根据患者的病情,在住院期间采取病因治疗、一般治疗、药物治疗等。病因治疗:治疗基础疾病和消除诱因。一般治疗:休息和控制钠盐的摄入等。药物治疗:所有CHD患者进行PCI术前给予300 mg负荷剂量的硫酸氢氯吡格雷片(商品名:波立维®,生产厂家:杭州赛诺菲制药有限公司;生产批号:国药准字J20130083 ),术后继续服用氯吡格雷片剂75 mg/d至少12个月。
1.2.2 氯吡格雷抵抗诊断标准[5]采用光比浊法检测以20 μmol/l二磷酸腺苷(ADP)诱导的血小板聚集的通透度,血小板聚集活性(PAR)抑制率<10%定义为氯吡格雷抵抗;否则为氯吡格雷反应正常。血小板聚集抑制率=[(PAR处理前-PAR处理后)/PAR处理前]×100%。
1.2.3 血小板miRNA的检测
1.2.3.1 纯化血小板采集患者肘静脉血5 ml,置于EDTA抗凝管中;室温下160 g离心6 min,取中层上清液,即为富血小板血浆;将富血小板血浆置于离心管中,室温下300 g离心10 min,弃上清;加入3 ml Beads缓冲液重悬;加入40 ml人CD45磁珠beads试剂,室温孵育45 min;采用磁性细胞分选系统收集血小板,采用流式细胞术检测血小板纯度。
1.2.3.2 提取总RNA收集血小板1×1010个,置于EP管中;加入1 ml预冷的Trizol,充分混合均匀,静置5~10 min;加入200 μl氯仿,震荡30 s,静置5~10 min;12 000 rpm离心,取上清;加入500 μl异丙醇,震荡30 s,静置5~10 min;12 000 rpm离心,弃上清;加入1 ml 75%乙醇,震荡30 s,12 000 rpm离心,弃上清;将EP管倒置于滤纸上,将RNA充分干燥;加入20 μl DEPC水溶解沉淀,分装,置于-80℃保存备用。采用凝胶电泳检测RNA分子量;采用分光光度计检测RNA浓度。
1.2.3.3 RNA逆转录根据Taqman® MicroRNA reverse transcription kit和Taqman® MicroRNA assay kit试剂盒(日本Takara公司)说明书操作进行。将cDNA保存至-20℃保存备用。
1.2.3.4 实时定量聚合酶链反应(RT-qPCR)将25 μl反应体系(12.5 μl SYBR Premix Taq+2 μl引物+2 μl模板+8.5 μl双蒸水)置于37℃恒温水浴60 min,85℃ 5 s,加入去离子水至100 μl,各反应孔取2 μl进行PCR。冰浴中配制25 μl PCR反应体系,95℃ 30 s预变性,95℃ 5 s变性,60℃ 20 s退火,重复循环45次。引物序列如下: miR-26a(上游引物:5'-TGGCGATGGCAGTGTCTTAG-3';下游引物:5'-GTGCAGGGTCCGAGGT-3');miR-26b(上游引物:5'-CAGCTTTGAGGTTCGTGTTTGT-3';下游引物:5'- ATGCTCTTCTTTTTTGCGGAAA-3');miR-23a(上游引物:5'-CAGCTTTGAG GTTCGTGTTTGT-3';下游引物:5'-ATGCTCT TCTTTTTTGCGGAAA-3');miR-223(上游引物:5'-GTGTGGAGCAACATCTGGCCTCTA-3';下游引物:5'- TTGGTTCAGCCACTGCCGAT-3');β-actin(上游引物:5'-TGGCG A T G G C A G T G T C T T A G-3';下游引物:5'-GTGCAGGGTCCGAGGT-3')。
1.2.4 观察指标①血小板聚集情况:所有患者服用氯吡格雷之前采集静脉血,以测定基础水平血小板聚集情况,然后于治疗结束后第2 d再次抽取静脉血,再次测定血小板聚集情况。②血液生化指标:采用Beckman coulter AU680全自动血液生化分析仪(美国Beckman coulter)检测白细胞计数(WBC)、红细胞计数(RBC)、血小板计数(PLT)、血红蛋白(HGB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、血清肌酐(SCr)、尿酸(UA)、B型脑钠肽(BNP)水平。1.3 统计学处理所有数据均采用SPSS 21.0统计学软件分析,计量资料采用均数±标准差(±s)表示,两组间均数的比较采用t检验,计数资料采用例数(构成比)表示,组间比较采用χ2检验。使用多因素logistic回归分析氯吡格雷抵抗发生的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较比较两组患者的年龄、性别、体质指数(BMI)等基本资料,差异无统计学差异(P均>0.05,表1)。
2.2 两组患者血小板聚集反应情况变化两组患者治疗后,氯吡格雷抵抗组患者经10 μmol/L、20 μmol/L ADP诱导的血小板聚集率分别为(11.81±2.54)%和(12.48±2.19)%,与治疗前相比,无统计学差异(P>0.05);但是高于氯吡格雷反应正常组患者,差异具有统计学意义(P<0.05)(表2)。

表1 患者的一般临床资料分析
表2 两组患者血小板聚集反应情况(±s)

表2 两组患者血小板聚集反应情况(±s)
注:ADP:二磷酸腺苷;与本组治疗前比较,aP<0.05;与抵抗组治疗后比较,bP<0.05
项目 抵抗组(n=66) 正常组(n=102)治疗前 治疗后 治疗前 治疗后ADP(10 μmol/L)12.25±1.43 11.81±2.54 11.69±2.77 4.65±1.08ab ADP(20 μmol/L)14.16±3.15 13.28±3.04 13.97±2.53 5.74±1.21ab
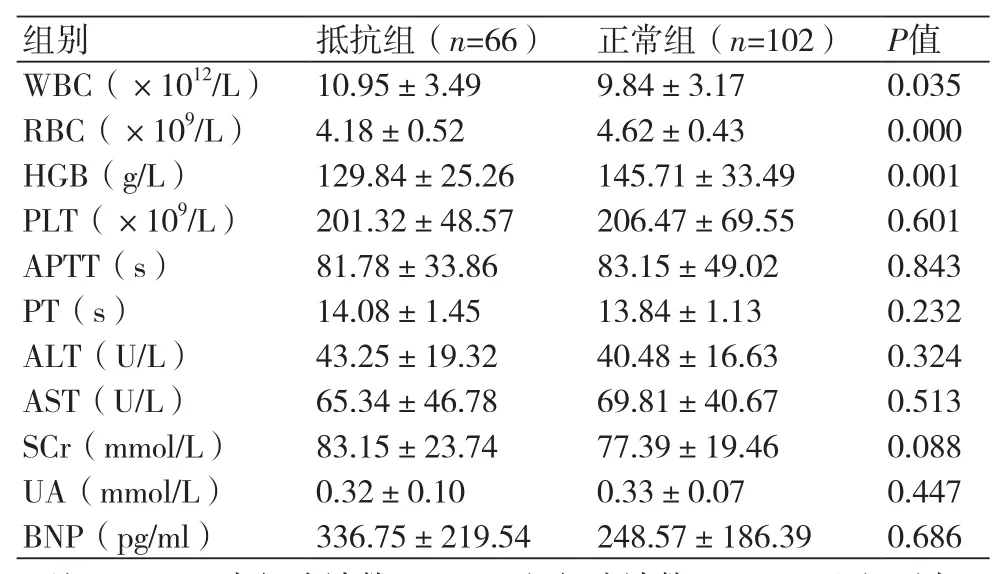
表3 两组患者血液生化指标比较
2.3 两组患者血液生化指标比较比较两组患者的生化指标,经单因素分析结果显示,两组患者WBC、RBC、HGB值存在统计学差异(P均<0.05)。为排除基线资料可能对本项研究结果产生的影响,对上述存在统计学差异的三项指标进行Logistc回归分析,结果显示,WBC、RBC、HGB不是发生氯吡格雷抵抗的独立危险因素(表3~4)。
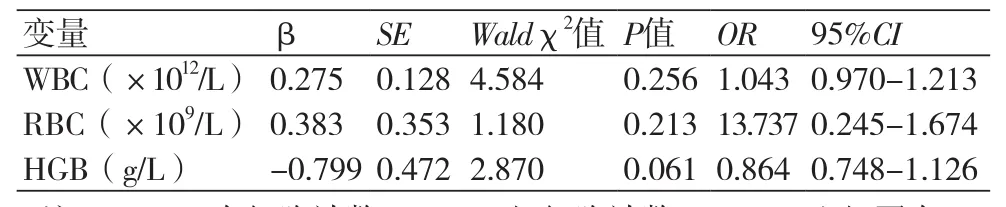
表4 Logistic多因素回归分析
表5 两组患者血小板中miR-26a、miR-26b、miR-23a、miR-223相对表达水平比较(±s)

表5 两组患者血小板中miR-26a、miR-26b、miR-23a、miR-223相对表达水平比较(±s)
项目 抵抗组(n=66) 正常组(n=102) P值miR-26a 1.86±0.18 0.53±0.15 0.000 miR-26b 0.47±0.14 0.44±0.09 0.093 miR-23a 0.43±0.16 0.39±0.22 0.204 miR-223 1.17±0.29 0.34±0.07 0.000
2.4 两组患者血小板中miR-26a、miR-26b、miR-23a、miR-223相对表达水平的差异性基于前期生物信息学研究的基础上,选取miR-26a、miR-26b、miR-23a、miR-223作为候选基因,比较两组患者血小板中候选基因的表达情况,结果显示,抵抗组患者血小板中miR-26a和miR-233表达水平明显高于正常反应组患者,有统计学差异(P<0.05);其他两种候选基因表达水平未见统计学差异(P均>0.05)(表5)。
2.5 miR-26a和miR-233对于氯吡格雷抵抗的诊断价值经ROC工作曲线分析miR-26a和miR-223对氯吡格雷抵抗的诊断价值,结果显示,miR-26a ROC曲线的AUC为0.715(95%CI:0.565~0.865),miR-223 ROC曲线的AUC为0.831(95%CI:0.718~0.945),而miR-26a和miR-223联合ROC曲线AUC为0.922(95%CI:0.848~0.997)。当miR-26a相对表达量为1.24时,Youden指数最大,因此miR-26a的诊断阈值为1.24,此时miR-26a诊断氯吡格雷抵抗的敏感性为78.4%,特异性为60.5%;当miR-223相对表达量为0.86时,Youden指数最大,因此miR-223的诊断阈值为0.86,此时miR-223诊断氯吡格雷抵抗的敏感性为82.3%,特异性为57.2%;另外,miR-26a和miR-223联合诊断的敏感性和特异性分别为92.7%,87.6%。结果提示,miR-26a和miR-223联合诊断价值高于单独诊断价值(图1)。
3 讨论
冠心病作为一种严重危害人类健康的心脑血管疾病之一,死亡率和致残率较高,病因复杂,给患者家庭增加极大的经济负担。而急性心肌梗死是导致冠心病患者死亡的重要原因之一,与冠状动脉不稳定斑块破裂迅速形成血栓密切相关[6]。斑块一旦破裂,血小板迅速聚集形成白色血栓,通常表现为非ST段持续抬高心肌梗死;若斑块破裂严重,则会大量黏附纤维蛋白形成红色血栓,导致冠状动脉完全闭塞,形成ST段持续抬高心肌梗死[7]。目前对于心肌梗死的治疗目的,首先需尽快恢复冠状动脉的血流灌注,但是抗血栓治疗也是治疗的重要环节之一[8]。而氯吡格雷是预防冠心病患者临床主要不良心血管事件发生的金标准[9]。

图1 miR-26a、miR-223在氯吡格雷抵抗和正常反应之间的ROC曲线
在本项研究中,采用临床上最常使用的比浊度法用于检测PCI术患者服用氯吡格雷前后的血小板活性,并根据血小板聚集抑制率分为抵抗组和正常反应组,在此基础上进行后续实验。另有研究显示,氯吡格雷抵抗可能与遗传因素、吸烟史、糖尿病史等有关。在本项研究中,氯吡格雷抵抗组患者和正常反应组患者一般临床特征未见统计学差异,从而避免对研究目的的影响。氯吡格雷属于新型抑制血小板聚集的噻吩砒啶类衍生物,主要通过不可逆地阻断二磷酸肌酐受体,从而抑制纤维蛋白原与GPⅡb/Ⅲa受体结合,从而抑制血小板聚集[10]。理论上,氯吡格雷具有很强的抗血小板活性作用,但是在实际临床应用中,很多患者服用氯吡格雷血小板后无反应或低反应。目前关于氯吡格雷抵抗的发生机制尚不明确,但普遍认为血小板活化因子在氯吡格雷抵抗发生过程中发挥重要作用[11]。经血小板活化因子的诱导,ADP参与血小板聚集信号的放大过程[12],血管受损后,血小板在胶原蛋白、血友病因子等影响下聚集到受损血管壁上,经肾上腺素、降钙素原等因子活化后,释放ADP,激活血小板表面的糖蛋白受体,与纤维蛋白原结合,导致血小板聚集[13]。2003年,Muller等[14]学者首先提出氯吡格雷抵抗事件,并认为ADP诱导的血小板聚集抑制率<10%即定义为氯吡格雷抵抗。
miRNA是真核生物基因中一类非编码的负性调控RNA,可以通过与靶基因3’-非编码区结合抑制RNA转录[15]。目前,关于miRNA与肿瘤和心脑血管疾病之间的关系研究已经成为全球医学界的热点,但是国内外在关于miRNA是否也参与氯吡格雷抵抗的发生以及哪些靶基因可能作为氯吡格雷抵抗诊断的候选标志物方面研究尚少。笔者通过前期生物信息学和基因芯片技术,初选氯吡格雷抵抗患者与正常反应患者具有表达差异性的miRNA谱,结果显示,氯吡格雷抵抗的患者血小板中miR-26a、miR-26b、miR-23a、miR-223、miR-191、miR-484等多种基因呈高表达,选择前四种基因作为本项研究的候选基因。另外,由于基因芯片技术虽然简单易行,筛选信息量大,但是敏感度较低,而且成本昂贵,RT-qPCR是目前实验室和临床检验科最常使用的可靠的检测方式,本项研究通过RT-qPCR检测两组患者血小板中miRNA的表达量。结果显示,在miR-26a、miR-26b、miR-23a、miR-223四种候选基因中,氯吡格雷抵抗组患者血小板中miR-26a和miR-233表达水平明显高于正常反应组患者,有统计学差异(P<0.05),其他两种候选基因表达水平未见统计学差异(P>0.05)。进一步分析miR-26a、miR-223对氯吡格雷抵抗的临床诊断价值,结果显示,miR-26a和miR-223单独和联合诊断ROC工作曲线下面积分别为0.715,0.831,0.922,特异性和敏感性分别为78.4%和60.5%,82.3%和57.2%,92.7%和87.6%,联合诊断的临床价值、敏感性和特异性明显提高。
综上所述,氯吡格雷抵抗患者血小板中miR-26a和miR-223表达较正常反应者明显上调,联合检测血小板中miR-26a和miR-223的表达水平可作为氯吡格雷抵抗的诊断方法,具有良好的临床推广价值。
